2.3.1物质的量、摩尔质量课件(共26张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.1物质的量、摩尔质量课件(共26张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 703.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
物质的量、摩尔质量
学习目标:
1.了解物质的量、气体摩尔体积及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、物质的粒子数之间的相互关系进行简单计算。
分点突破(一) 物质的量的单位——摩尔
1.物质的量
(1)物质的量
①概念:物质的量是一个物理量,它表示含有一定数目粒子的集合体。
②符号及单位:符号为 n ,单位为摩尔。
n
(2)物质的量的单位——摩尔
2.阿伏加德罗常数
(1)概念:1 mol任何粒子的粒子数叫做阿伏加德罗常数。
(2)符号:符号为NA,通常用 6.02×1023 mol-1 表示。
(3)物质的量、阿伏加德罗常数与粒子数之间的关系:n=。
6.02×1023 mol-1
1.1 mol H、1 mol H+、1 mol H2所表示的含义是否相同
提示:不相同;虽然都是1 mol粒子,但粒子种类不同,它们分别表示1 mol氢原子、1 mol氢离子、1 mol氢分子。
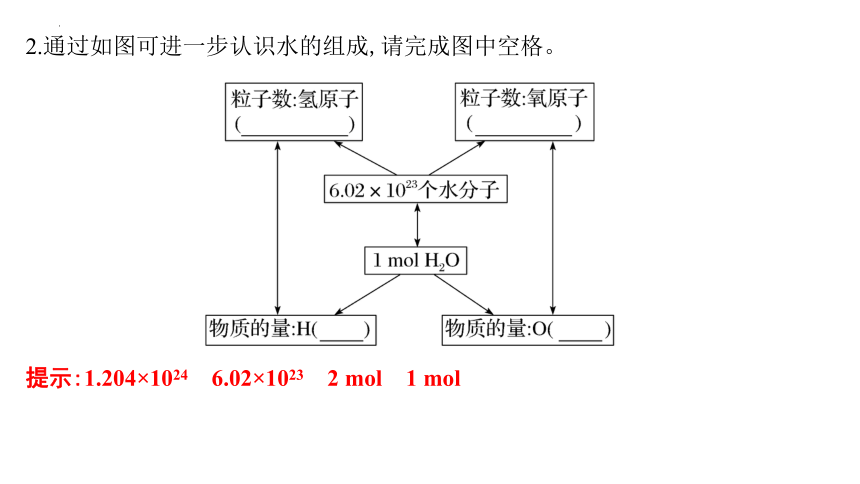
2.通过如图可进一步认识水的组成,请完成图中空格。
提示:1.204×1024 6.02×1023 2 mol 1 mol
1.物质的量的“四化”
专有化 “物质的量”四个字是一个整体的物理量名词,不能说成“物质量”或“物质的数量”等
微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等及这些粒子的特定组合,如NaCl,不能表示宏观的物质
具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O2”,不能说“1 mol 氧”
集体化 物质的量可以表示多个粒子的特定组合或集合体,如1 mol NaCl、0.5 mol H2SO4
2.使用摩尔时,必须指明粒子的种类。如1 mol H2中含有2 mol H,含1 mol H的H2的物质的量为 0.5 mol。其标准的写法是“数字+mol+化学式”,例如2 mol HCl即表示2 mol的氯化氢分子。
1.下列对于“摩尔”的理解正确的是( )
A.1 mol任何物质所含有的分子数都相同
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.1 mol水分子中含有2 mol氢分子和1 mol氧原子
解析:B 物质可能由分子、原子、离子构成,A错误;物质的量是表示含有一定数目微观粒子的集合体,是将微观粒子数目与宏观物质联系起来的中间桥梁,C错误;H2O中不含H2分子,D错误。
2.下列说法不正确的是( )
A.6.02×1023个钠离子的物质的量约为1 mol
B.1 mol氧约含6.02×1023个氧分子
C.1 mol氯化钙里含3 mol离子
D.1 mol H+中含有的氢离子数为NA
解析:B A项,6.02×1023个钠离子的物质的量n===1 mol,正确;B项,1 mol氧中氧指代不明,因此无法计算所含的氧分子数,错误;C项,1 mol CaCl2中含有1 mol Ca2+和2 mol Cl-,共3 mol离子,正确;D项,1 mol H+中含有的氢离子数N=nNA=NA个,正确。
3.已知0.25 mol甲烷中所含原子数为a,阿伏加德罗常数可表示为( )
A. mol-1 B.4a mol-1
C.a mol-1 D.a mol-1
解析:D 0.25 mol甲烷中含有的分子数为,根据粒子的数目与物质的量成正比可知1 mol甲烷中含有的分子数为a,即阿伏加德罗常数为a mol-1。
分点突破(二) 摩尔质量
1.摩尔质量
(1)摩尔质量的得出
①计算填表
物质 微粒 1个粒子的 实际质量/g 6.02×1023个 粒子的质量/g 相对分子
(或原子)质量
H2O 2.990×10-23 18 18
Al 4.485×10-23 27 27
②结论:6.02×1023个粒子(1摩尔)的质量(以克为单位时),在数值上(近似)等于该粒子的 相对原子质量或相对分子质量 。
18
18
27
27
相对原子质量或相对分子质量
(2)摩尔质量
2.物质的量、质量、粒子数之间的相关计算
N n m
(粒子数) (物质的量) (质量)
名师点拨
(1)“物质的量”是一个专有名词,不能拆解,更不能理解成物质的质量。
(2)表述微观粒子的物质的量时,必须指明微观粒子的种类,如1 mol氧的说法错误,应是1 mol氧原子或1 mol O2。
(3)明确整体和局部的关系,如1 mol H2O分子中含有2 mol氢原子和1 mol氧原子。
(4)阿伏加德罗常数(NA)是一个准确量,是指12 g 12C所含的碳原子数,通常用近似值6.02×1023进行计算。
1.摩尔质量与相对分子质量(或相对原子质量)是否等同
提示:不等同。摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是g·mol-1,后者单位是1,故两者不等同。
2.阴、阳离子的摩尔质量在数值上也等于其相对原子质量,对吗
提示:阴、阳离子摩尔质量以g·mol-1为单位时,数值上等于其相对原子质量。
3.2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍吗 为什么
提示:不是。物质的分子组成确定,其摩尔质量就是个确定的值。
4.计算下列物质的摩尔质量。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
提示:(1) 17 g·mol-1
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
提示:(2)64 g·mol-1
(3)已知一个铜原子的质量为b g,则铜的摩尔质量为 。
提示:(3)bNA g·mol-1
摩尔质量的计算方法
(1)已知任意状态物质的质量时:M=(定义式)。
(2)已知一个分子的质量时:M=m(分子)×NA。
(3)已知一个分子的质量和一个12C原子的质量时:M=×12 g·mol-1。
1.H2O是地球上分布最广泛的物质。H2O的摩尔质量为( )
A.10 B.18
C.10 g·mol-1 D.18 g·mol-1
解析:D H2O的相对分子质量为18,当摩尔质量以g·mol-1为单位时,分子的摩尔质量在数值上与相对分子质量相等。
2.4.4 g CO2的物质的量为( )
A.0.1 mol B.0.2 mol
C.0.3 mol D.0.4 mol
解析:A 已知CO2的质量为4.4 g,故n(CO2)===0.1 mol。
3.某金属氯化物MCl2 40.5 g,含有0.6 mol Cl-,则金属M的摩尔质量为( )
A.135 g·mol-1 B.24 g·mol-1
C.56 g·mol-1 D.64 g·mol-1
解析:D 金属M的摩尔质量为
=64 g·mol-1,D正确。
有关粒子数、物质的量及质量之间的计算(归纳与论证)
回答下列问题。
(1)3.01×1023个SO2分子中含有氧原子的个数为 ,SO2气体的质量为 。
解析:(1)3.01×1023个SO2分子中含有氧原子的个数为×2×6.02×1023 mol-1=6.02×1023,SO2气体的质量为×64 g·mol-1=32 g。
答案:(1)6.02×1023 32 g
(2)常温常压下,92 g NO2气体含有的原子数为 (用NA表示阿伏加德罗常数的值)。
解析:(2)常温常压下,92 g NO2气体含有的原子数为×3×NA mol-1=6NA。
答案:(2)6NA
(3)36.3 g某硝酸盐R(NO3)3 含有0.45 mol硝酸根离子,则金属R的摩尔质量为 。
解析:(3)一个R(NO3)3中含有三个硝酸根离子,36.3 g某硝酸盐中含有0.45 mol硝酸根离子,则该硝酸盐的物质的量为0.15 mol,该硝酸盐的摩尔质量为36.3 g÷0.15 mol=242 g·mol-1,则R的摩尔质量=242 g·mol-1-186 g·mol-1=56 g·mol-1。
答案:(3)56 g·mol-1
(4)1个12C的质量是a kg,1个Na的质量是b kg,Na的摩尔质量是 (用含a、b的表达式表示)。
解析:(4)一个原子的实际质量与12C 质量的 的比值是该原子的相对原子质量,因此钠的相对原子质量是=,而摩尔质量以g·mol-1 为单位时,在数值上等于相对原子质量,故Na 的摩尔质量是 g·mol-1。
答案:(4) g·mol-1
N n m
1.已知1.4 g某气体中所含分子数为3.01×1022,此气体的摩尔质量为( )
A.28 g B.28 g·mol-1
C.2.8 g·mol-1 D.2.8 mol
解析:B 1.4 g某气体中所含的分子数为3.01×1022,则物质的量为=0.05 mol,则此气体的摩尔质量为=28 g·mol-1。
2.用NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.18 g水中含有的氢原子数目为NA
B.1 mol氩气分子所含的原子数目为2NA
C.53 g碳酸钠中含有的钠离子为0.5NA
D.0.5 mol硝酸中含有的氧原子为1.5NA
解析:D 计算确定相关粒子的物质的量:水分子中所含氢原子的物质的量=×2=2 mol,氩气所含原子的物质的量=1 mol×1=1 mol,碳酸钠所含钠离子的物质的量=×2=1 mol,硝酸所含氧原子的物质的量=0.5 mol×3=1.5 mol。
物质的量、摩尔质量
学习目标:
1.了解物质的量、气体摩尔体积及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、物质的粒子数之间的相互关系进行简单计算。
分点突破(一) 物质的量的单位——摩尔
1.物质的量
(1)物质的量
①概念:物质的量是一个物理量,它表示含有一定数目粒子的集合体。
②符号及单位:符号为 n ,单位为摩尔。
n
(2)物质的量的单位——摩尔
2.阿伏加德罗常数
(1)概念:1 mol任何粒子的粒子数叫做阿伏加德罗常数。
(2)符号:符号为NA,通常用 6.02×1023 mol-1 表示。
(3)物质的量、阿伏加德罗常数与粒子数之间的关系:n=。
6.02×1023 mol-1
1.1 mol H、1 mol H+、1 mol H2所表示的含义是否相同
提示:不相同;虽然都是1 mol粒子,但粒子种类不同,它们分别表示1 mol氢原子、1 mol氢离子、1 mol氢分子。
2.通过如图可进一步认识水的组成,请完成图中空格。
提示:1.204×1024 6.02×1023 2 mol 1 mol
1.物质的量的“四化”
专有化 “物质的量”四个字是一个整体的物理量名词,不能说成“物质量”或“物质的数量”等
微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等及这些粒子的特定组合,如NaCl,不能表示宏观的物质
具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O2”,不能说“1 mol 氧”
集体化 物质的量可以表示多个粒子的特定组合或集合体,如1 mol NaCl、0.5 mol H2SO4
2.使用摩尔时,必须指明粒子的种类。如1 mol H2中含有2 mol H,含1 mol H的H2的物质的量为 0.5 mol。其标准的写法是“数字+mol+化学式”,例如2 mol HCl即表示2 mol的氯化氢分子。
1.下列对于“摩尔”的理解正确的是( )
A.1 mol任何物质所含有的分子数都相同
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.1 mol水分子中含有2 mol氢分子和1 mol氧原子
解析:B 物质可能由分子、原子、离子构成,A错误;物质的量是表示含有一定数目微观粒子的集合体,是将微观粒子数目与宏观物质联系起来的中间桥梁,C错误;H2O中不含H2分子,D错误。
2.下列说法不正确的是( )
A.6.02×1023个钠离子的物质的量约为1 mol
B.1 mol氧约含6.02×1023个氧分子
C.1 mol氯化钙里含3 mol离子
D.1 mol H+中含有的氢离子数为NA
解析:B A项,6.02×1023个钠离子的物质的量n===1 mol,正确;B项,1 mol氧中氧指代不明,因此无法计算所含的氧分子数,错误;C项,1 mol CaCl2中含有1 mol Ca2+和2 mol Cl-,共3 mol离子,正确;D项,1 mol H+中含有的氢离子数N=nNA=NA个,正确。
3.已知0.25 mol甲烷中所含原子数为a,阿伏加德罗常数可表示为( )
A. mol-1 B.4a mol-1
C.a mol-1 D.a mol-1
解析:D 0.25 mol甲烷中含有的分子数为,根据粒子的数目与物质的量成正比可知1 mol甲烷中含有的分子数为a,即阿伏加德罗常数为a mol-1。
分点突破(二) 摩尔质量
1.摩尔质量
(1)摩尔质量的得出
①计算填表
物质 微粒 1个粒子的 实际质量/g 6.02×1023个 粒子的质量/g 相对分子
(或原子)质量
H2O 2.990×10-23 18 18
Al 4.485×10-23 27 27
②结论:6.02×1023个粒子(1摩尔)的质量(以克为单位时),在数值上(近似)等于该粒子的 相对原子质量或相对分子质量 。
18
18
27
27
相对原子质量或相对分子质量
(2)摩尔质量
2.物质的量、质量、粒子数之间的相关计算
N n m
(粒子数) (物质的量) (质量)
名师点拨
(1)“物质的量”是一个专有名词,不能拆解,更不能理解成物质的质量。
(2)表述微观粒子的物质的量时,必须指明微观粒子的种类,如1 mol氧的说法错误,应是1 mol氧原子或1 mol O2。
(3)明确整体和局部的关系,如1 mol H2O分子中含有2 mol氢原子和1 mol氧原子。
(4)阿伏加德罗常数(NA)是一个准确量,是指12 g 12C所含的碳原子数,通常用近似值6.02×1023进行计算。
1.摩尔质量与相对分子质量(或相对原子质量)是否等同
提示:不等同。摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是g·mol-1,后者单位是1,故两者不等同。
2.阴、阳离子的摩尔质量在数值上也等于其相对原子质量,对吗
提示:阴、阳离子摩尔质量以g·mol-1为单位时,数值上等于其相对原子质量。
3.2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍吗 为什么
提示:不是。物质的分子组成确定,其摩尔质量就是个确定的值。
4.计算下列物质的摩尔质量。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
提示:(1) 17 g·mol-1
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
提示:(2)64 g·mol-1
(3)已知一个铜原子的质量为b g,则铜的摩尔质量为 。
提示:(3)bNA g·mol-1
摩尔质量的计算方法
(1)已知任意状态物质的质量时:M=(定义式)。
(2)已知一个分子的质量时:M=m(分子)×NA。
(3)已知一个分子的质量和一个12C原子的质量时:M=×12 g·mol-1。
1.H2O是地球上分布最广泛的物质。H2O的摩尔质量为( )
A.10 B.18
C.10 g·mol-1 D.18 g·mol-1
解析:D H2O的相对分子质量为18,当摩尔质量以g·mol-1为单位时,分子的摩尔质量在数值上与相对分子质量相等。
2.4.4 g CO2的物质的量为( )
A.0.1 mol B.0.2 mol
C.0.3 mol D.0.4 mol
解析:A 已知CO2的质量为4.4 g,故n(CO2)===0.1 mol。
3.某金属氯化物MCl2 40.5 g,含有0.6 mol Cl-,则金属M的摩尔质量为( )
A.135 g·mol-1 B.24 g·mol-1
C.56 g·mol-1 D.64 g·mol-1
解析:D 金属M的摩尔质量为
=64 g·mol-1,D正确。
有关粒子数、物质的量及质量之间的计算(归纳与论证)
回答下列问题。
(1)3.01×1023个SO2分子中含有氧原子的个数为 ,SO2气体的质量为 。
解析:(1)3.01×1023个SO2分子中含有氧原子的个数为×2×6.02×1023 mol-1=6.02×1023,SO2气体的质量为×64 g·mol-1=32 g。
答案:(1)6.02×1023 32 g
(2)常温常压下,92 g NO2气体含有的原子数为 (用NA表示阿伏加德罗常数的值)。
解析:(2)常温常压下,92 g NO2气体含有的原子数为×3×NA mol-1=6NA。
答案:(2)6NA
(3)36.3 g某硝酸盐R(NO3)3 含有0.45 mol硝酸根离子,则金属R的摩尔质量为 。
解析:(3)一个R(NO3)3中含有三个硝酸根离子,36.3 g某硝酸盐中含有0.45 mol硝酸根离子,则该硝酸盐的物质的量为0.15 mol,该硝酸盐的摩尔质量为36.3 g÷0.15 mol=242 g·mol-1,则R的摩尔质量=242 g·mol-1-186 g·mol-1=56 g·mol-1。
答案:(3)56 g·mol-1
(4)1个12C的质量是a kg,1个Na的质量是b kg,Na的摩尔质量是 (用含a、b的表达式表示)。
解析:(4)一个原子的实际质量与12C 质量的 的比值是该原子的相对原子质量,因此钠的相对原子质量是=,而摩尔质量以g·mol-1 为单位时,在数值上等于相对原子质量,故Na 的摩尔质量是 g·mol-1。
答案:(4) g·mol-1
N n m
1.已知1.4 g某气体中所含分子数为3.01×1022,此气体的摩尔质量为( )
A.28 g B.28 g·mol-1
C.2.8 g·mol-1 D.2.8 mol
解析:B 1.4 g某气体中所含的分子数为3.01×1022,则物质的量为=0.05 mol,则此气体的摩尔质量为=28 g·mol-1。
2.用NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.18 g水中含有的氢原子数目为NA
B.1 mol氩气分子所含的原子数目为2NA
C.53 g碳酸钠中含有的钠离子为0.5NA
D.0.5 mol硝酸中含有的氧原子为1.5NA
解析:D 计算确定相关粒子的物质的量:水分子中所含氢原子的物质的量=×2=2 mol,氩气所含原子的物质的量=1 mol×1=1 mol,碳酸钠所含钠离子的物质的量=×2=1 mol,硝酸所含氧原子的物质的量=0.5 mol×3=1.5 mol。
