1.3.3氧化还原反应的配平及计算 课件(共27张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.3氧化还原反应的配平及计算 课件(共27张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1006.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 10:29:51 | ||
图片预览



文档简介
(共27张PPT)
氧化还原反应的配平及计算
学习目标
1.依据氧化还原反应规律,建立有关氧化还原反应方程式的书写与配平的模型,并能利用模型解决实际问题。
2.依据氧化还原反应原理,能进行氧化还原反应的简单计算。
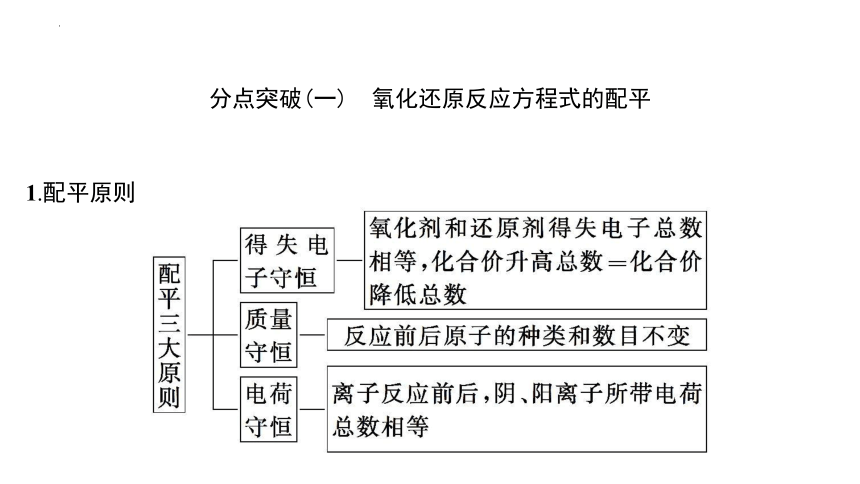
分点突破(一) 氧化还原反应方程式的配平
1.配平原则
2.配平步骤(建构模型)
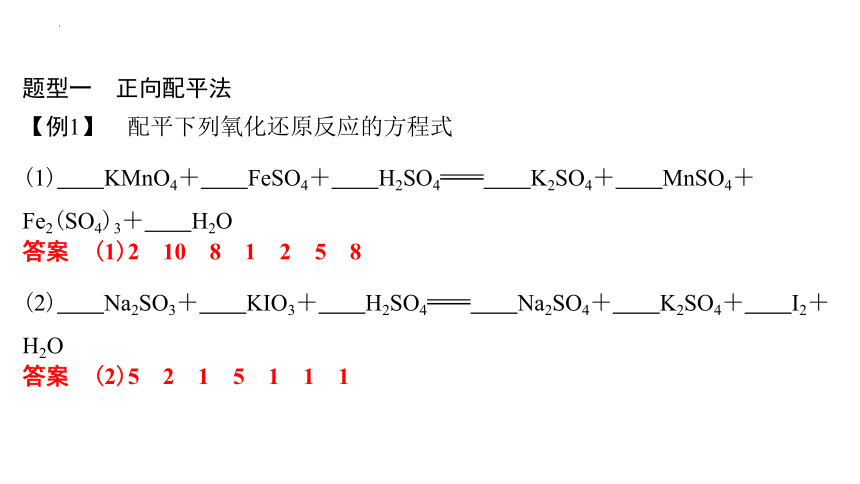
题型一 正向配平法
【例1】 配平下列氧化还原反应的方程式
(1) KMnO4+ FeSO4+ H2SO4 K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
答案 (1)2 10 8 1 2 5 8
(2) Na2SO3+ KIO3+ H2SO4 Na2SO4+ K2SO4+ I2+ H2O
答案 (2)5 2 1 5 1 1 1
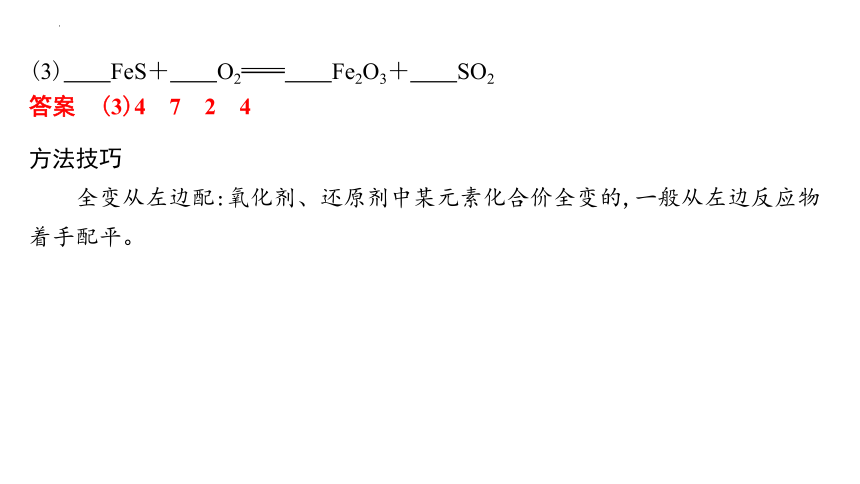
方法技巧
全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
(3) FeS+ O2 Fe2O3+ SO2
答案 (3)4 7 2 4
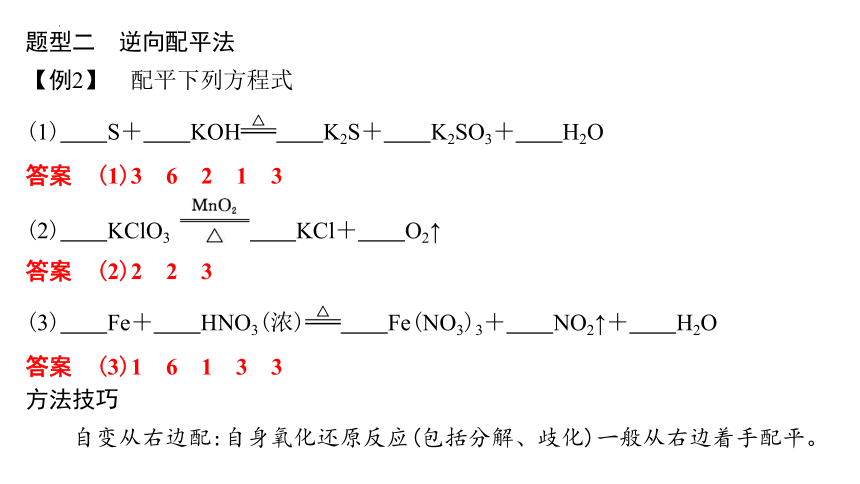
题型二 逆向配平法
【例2】 配平下列方程式
(1) S+ KOH K2S+ K2SO3+ H2O
答案 (1)3 6 2 1 3
(2) KClO3 KCl+ O2↑
答案 (2)2 2 3
(3) Fe+ HNO3(浓) Fe(NO3)3+ NO2↑+ H2O
答案 (3)1 6 1 3 3
方法技巧
自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
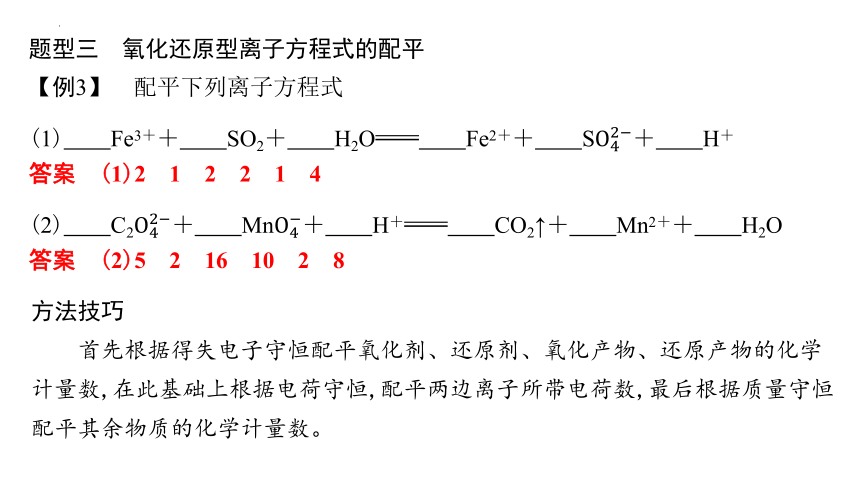
题型三 氧化还原型离子方程式的配平
【例3】 配平下列离子方程式
(1) Fe3++ SO2+ H2O Fe2++ S+ H+
答案 (1)2 1 2 2 1 4
(2) C2+ Mn+ H+ CO2↑+ Mn2++ H2O
答案 (2)5 2 16 10 2 8
方法技巧
首先根据得失电子守恒配平氧化剂、还原剂、氧化产物、还原产物的化学计量数,在此基础上根据电荷守恒,配平两边离子所带电荷数,最后根据质量守恒配平其余物质的化学计量数。
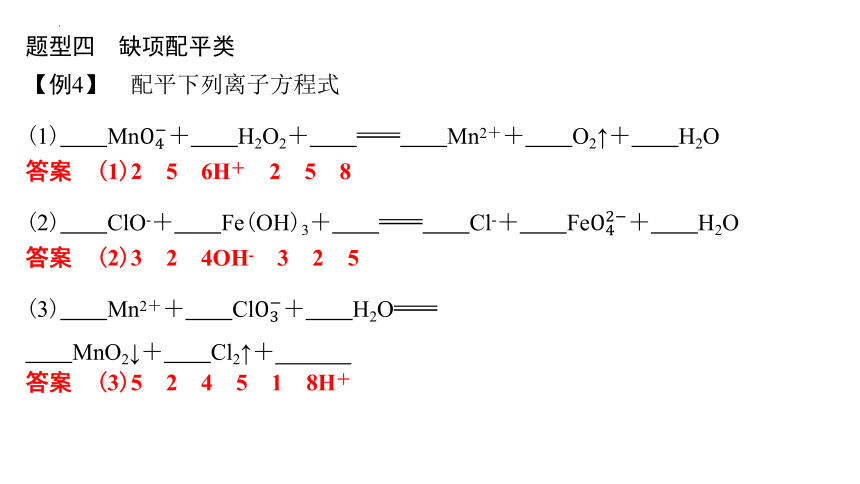
题型四 缺项配平类
【例4】 配平下列离子方程式
(1) Mn+ H2O2+ Mn2++ O2↑+ H2O
答案 (1)2 5 6H+ 2 5 8
(2) ClO-+ Fe(OH)3+ Cl-+ Fe+ H2O
答案 (2)3 2 4OH- 3 2 5
(3) Mn2++ Cl+ H2O
MnO2↓+ Cl2↑+
答案 (3)5 2 4 5 1 8H+
方法技巧
缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]
(1)先将得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加H+,生成物一边加水;若反应物这边缺负电荷,一般加OH-,生成物一边加水,然后进行两边电荷数配平。
(2)当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
题型五 信息型氧化还原方程式的书写及配平
【例5】 (1)某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方程式: 。
答案 (1)K2Cr2O7+14HCl3Cl2↑+2KCl+2CrCl3+7H2O
(2)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2还原成Cr3+,该反应的离子方程式为 。
答案 (2)Cr2+3HS+5H+2Cr3++3S+4H2O
方法技巧
信息型氧化还原方程式的书写步骤
(1)一判:据题给信息,联想所学知识,判断主要的反应物、生成物。
若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
(2)二平:据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
(3)三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
1.若(NH4)2SO4在加强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1∶4 B.1∶2 C.2∶1 D.4∶1
解析:B 配平该反应:3(NH4)2SO4 3SO2↑+4NH3↑+N2↑+6H2O,从而推断出化合价变化和未变化的N原子个数之比为1∶2。
2.(1)银首饰在空气中容易发黄变黑,原因是与空气中的H2S和O2反应生成黑色的Ag2S,请写出该反应的化学方程式: 。
解析:(1)根据题中信息,反应中H2S中的H元素和S元素的化合价均未发生改变,Ag→Ag2S,Ag化合价由0价升高到+1价,而O2中氧元素只能由0价降低为-2价生成水,可以写出Ag+H2S+O2Ag2S+H2O,根据化合价升高和降低总数相等配平得到4Ag+2H2S+O22Ag2S+2H2O。
答案:(1)4Ag+2H2S+O22Ag2S+2H2O
(2)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。可以用NaClO3、H2O2和H2SO4反应制备ClO2。写出该制备反应的化学方程式: 。
解析:(2)根据题目信息,反应中:NaO3 O2,Cl元素化合价降低,则必有H2O2被氧化H2,O元素化合价升高,根据化合价升高和降低总数相等、原子守恒可以写出:2NaClO3+H2O2+H2SO42ClO2↑+Na2SO4+O2↑+2H2O。
答案:(2)2NaClO3+H2O2+H2SO42ClO2↑+Na2SO4+O2↑+2H2O
(3)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,而自身被还原为+2价氧化物,试写出该反应的离子方程式: 。
解析:(3)NaNO2中N化合价为+3价,根据题意反应后生成NO,N化合价降低为+2价,根据化合价变化先配平为Fe2++NFe3++NO,根据电荷守恒在左边加上H+得Fe2++N+2H+Fe3++NO,最后根据质量守恒得到Fe2++N+2H+Fe3++NO↑+H2O。
答案:(3)Fe2++N+2H+Fe3++NO↑+H2O
分点突破(二) 氧化还原反应的计算
计算依据:①守恒规律即得失电子守恒、电荷守恒、质量守恒。
②化学方程式中计量系数之比等于物质个数之比。
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A.6∶5∶6 B.1∶3∶5 C.15∶5∶3 D.1∶6∶10
解析:A 根据各反应中元素的化合价变化可知:反应①中生成1个氯气转移2个电子;反应②中生成1个氯气转移 个电子;反应③中生成1个氯气转移2个电子;则要制得相同质量的氯气,转移电子数目之比为2∶∶2=6∶5∶6。
2.已知Cl2在热的NaOH溶液中能自身发生氧化还原反应,完全反应后测得溶液中含氯元素成分为NaCl、NaClO、NaClO3,其中NaClO与NaClO3的个数之比为4∶1,则溶液中NaCl与NaClO3的个数之比为( )
A.9∶1 B.5∶4 C.9∶4 D.11∶2
解析:A 根据题意,Cl2+NaOHNaCl+NaClO+NaClO3+H2O,其中NaClO与NaClO3的个数之比为4∶1,氯气中0价的氯失1个电子变成NaClO,失去5个电子变成NaClO3,失电子总数为 1×4+5=9;氯气中0价的氯得1个电子变成NaCl,由得失电子守恒,共生成9个NaCl,则溶液中NaCl与NaClO3的个数之比为9∶1。
1.汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞时发生反应为10NaN3+2KNO3K2O+5Na2O+16N2↑。下列判断正确的是( )
A.该反应中N2既是氧化剂又是还原剂
B.还原产物与氧化产物质量之比为1∶15
C.每生成16个N2分子转移30个电子
D.NaN3中N元素被还原
解析:B 只有N元素的化合价变化,则N2既是氧化产物又是还原产物,A错误;根据化合价分析可知,每生成16个N2分子,有15个N2是氧化产物,有1个N2是还原产物,故还原产物与氧化产物质量之比为1∶15,B正确;由反应可知,2个KNO3参加反应转移电子数为2×(5-0)=10,即每生成16个N2转移10个电子,C错误;NaN3中N元素化合价升高,失去电子被氧化,D错误。
2.关于反应Na2S2O3+H2SO4Na2SO4+S↓+SO2↑+H2O,下列说法正确的是( )
A.H2SO4 发生还原反应
B.Na2S2O3 既是氧化剂又是还原剂
C.氧化产物与还原产物的分子个数之比为2∶1
D.1分子Na2S2O3 发生反应,转移4个电子
解析:B Na2S2O3+H2SO4Na2SO4+S ↓+SO2↑+H2O,Na2S2O3中的S的平均化合价为+2价,其分别转化为S(0价)和SO2(+4价),故其既是氧化剂又是还原剂,1分子 Na2S2O3发生反应,要转移2 个电子,B正确,D错误;H2SO4所含元素的化合价均未发生变化,故其没有发生还原反应,A错误;该反应的氧化产物是SO2,还原产物为S,氧化产物与还原产物的分子个数之比为1∶1,C错误。
3.NaBH4(NaBH4 中H为-1价)在工业生产中扮演十分重要的角色,能溶于水并和水反应,有如下反应NaBH4+2H2ONaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A.NaBH4 是氧化剂,H2O 是还原剂
B.硼元素被氧化,氢元素被还原
C.被氧化的元素与被还原的元素质量比为1∶1
D.每生成4个H2,转移电子数为8个
解析:C NaBH4 中H为-1价,Na为+1价,B为+3价,由反应可知反应前后NaBH4 中-1价H变为0价,NaBH4 作还原剂,H2O中+1价H变为0价,H2O作氧化剂,两者反应生成氢气,被氧化的H与被还原的H的个数相等,质量比为1∶1,反应前后B元素的化合价没有发生变化,B元素既不被氧化也不被还原,A、B错误,C正确;每生成4个H2,转移电子数为4个,D错误。
4.氧化还原反应是中学化学的重要内容。回答下列问题:
(1)野外,一般用铝热反应来焊接铁轨,其化学方程式为Fe2O3+2AlAl2O3+2Fe,该反应中氧化剂为 。
解析:(1)该反应中铁的化合价由+3价变为0价,化合价降低,故Fe2O3是氧化剂。
答案:(1)Fe2O3
(2)有反应:KClO3+6HCl(浓)KCl+3Cl2↑+3H2O,该方程式改写成离子方程式为 ;被氧化和被还原的氯原子的个数之比为 。
解析:(2)在该反应所涉及的物质中,氯气是单质、水是弱电解质,不能拆,其他的物质都可以拆,故离子方程式为Cl+6H++5Cl-3Cl2 ↑+3H2O;在该反应中,6个HCl中的5个HCl被氧化,KClO3中的氯化合价降低,被还原,故被氧化和被还原的氯原子的个数之比为5∶1。
答案:(2)Cl+6H++5Cl-3Cl2 ↑+3H2O 5∶1
(3)高铁酸钠是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下,配平该离子方程式: ClO-+ Fe3++ OH- Fe+ Cl-+ H2O
解析:(3)Fe元素化合价由+3价升高为+6价,Cl元素化合价由+1价降低为-1价,根据得失电子守恒、电荷守恒、质量守恒,配平离子方程式为3ClO-+2Fe3++10OH-2Fe+3Cl-+5H2O。
答案:(3)3 2 10 2 3 5
氧化还原反应的配平及计算
学习目标
1.依据氧化还原反应规律,建立有关氧化还原反应方程式的书写与配平的模型,并能利用模型解决实际问题。
2.依据氧化还原反应原理,能进行氧化还原反应的简单计算。
分点突破(一) 氧化还原反应方程式的配平
1.配平原则
2.配平步骤(建构模型)
题型一 正向配平法
【例1】 配平下列氧化还原反应的方程式
(1) KMnO4+ FeSO4+ H2SO4 K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
答案 (1)2 10 8 1 2 5 8
(2) Na2SO3+ KIO3+ H2SO4 Na2SO4+ K2SO4+ I2+ H2O
答案 (2)5 2 1 5 1 1 1
方法技巧
全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
(3) FeS+ O2 Fe2O3+ SO2
答案 (3)4 7 2 4
题型二 逆向配平法
【例2】 配平下列方程式
(1) S+ KOH K2S+ K2SO3+ H2O
答案 (1)3 6 2 1 3
(2) KClO3 KCl+ O2↑
答案 (2)2 2 3
(3) Fe+ HNO3(浓) Fe(NO3)3+ NO2↑+ H2O
答案 (3)1 6 1 3 3
方法技巧
自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
题型三 氧化还原型离子方程式的配平
【例3】 配平下列离子方程式
(1) Fe3++ SO2+ H2O Fe2++ S+ H+
答案 (1)2 1 2 2 1 4
(2) C2+ Mn+ H+ CO2↑+ Mn2++ H2O
答案 (2)5 2 16 10 2 8
方法技巧
首先根据得失电子守恒配平氧化剂、还原剂、氧化产物、还原产物的化学计量数,在此基础上根据电荷守恒,配平两边离子所带电荷数,最后根据质量守恒配平其余物质的化学计量数。
题型四 缺项配平类
【例4】 配平下列离子方程式
(1) Mn+ H2O2+ Mn2++ O2↑+ H2O
答案 (1)2 5 6H+ 2 5 8
(2) ClO-+ Fe(OH)3+ Cl-+ Fe+ H2O
答案 (2)3 2 4OH- 3 2 5
(3) Mn2++ Cl+ H2O
MnO2↓+ Cl2↑+
答案 (3)5 2 4 5 1 8H+
方法技巧
缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]
(1)先将得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加H+,生成物一边加水;若反应物这边缺负电荷,一般加OH-,生成物一边加水,然后进行两边电荷数配平。
(2)当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
题型五 信息型氧化还原方程式的书写及配平
【例5】 (1)某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方程式: 。
答案 (1)K2Cr2O7+14HCl3Cl2↑+2KCl+2CrCl3+7H2O
(2)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2还原成Cr3+,该反应的离子方程式为 。
答案 (2)Cr2+3HS+5H+2Cr3++3S+4H2O
方法技巧
信息型氧化还原方程式的书写步骤
(1)一判:据题给信息,联想所学知识,判断主要的反应物、生成物。
若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
(2)二平:据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
(3)三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
1.若(NH4)2SO4在加强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1∶4 B.1∶2 C.2∶1 D.4∶1
解析:B 配平该反应:3(NH4)2SO4 3SO2↑+4NH3↑+N2↑+6H2O,从而推断出化合价变化和未变化的N原子个数之比为1∶2。
2.(1)银首饰在空气中容易发黄变黑,原因是与空气中的H2S和O2反应生成黑色的Ag2S,请写出该反应的化学方程式: 。
解析:(1)根据题中信息,反应中H2S中的H元素和S元素的化合价均未发生改变,Ag→Ag2S,Ag化合价由0价升高到+1价,而O2中氧元素只能由0价降低为-2价生成水,可以写出Ag+H2S+O2Ag2S+H2O,根据化合价升高和降低总数相等配平得到4Ag+2H2S+O22Ag2S+2H2O。
答案:(1)4Ag+2H2S+O22Ag2S+2H2O
(2)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。可以用NaClO3、H2O2和H2SO4反应制备ClO2。写出该制备反应的化学方程式: 。
解析:(2)根据题目信息,反应中:NaO3 O2,Cl元素化合价降低,则必有H2O2被氧化H2,O元素化合价升高,根据化合价升高和降低总数相等、原子守恒可以写出:2NaClO3+H2O2+H2SO42ClO2↑+Na2SO4+O2↑+2H2O。
答案:(2)2NaClO3+H2O2+H2SO42ClO2↑+Na2SO4+O2↑+2H2O
(3)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,而自身被还原为+2价氧化物,试写出该反应的离子方程式: 。
解析:(3)NaNO2中N化合价为+3价,根据题意反应后生成NO,N化合价降低为+2价,根据化合价变化先配平为Fe2++NFe3++NO,根据电荷守恒在左边加上H+得Fe2++N+2H+Fe3++NO,最后根据质量守恒得到Fe2++N+2H+Fe3++NO↑+H2O。
答案:(3)Fe2++N+2H+Fe3++NO↑+H2O
分点突破(二) 氧化还原反应的计算
计算依据:①守恒规律即得失电子守恒、电荷守恒、质量守恒。
②化学方程式中计量系数之比等于物质个数之比。
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A.6∶5∶6 B.1∶3∶5 C.15∶5∶3 D.1∶6∶10
解析:A 根据各反应中元素的化合价变化可知:反应①中生成1个氯气转移2个电子;反应②中生成1个氯气转移 个电子;反应③中生成1个氯气转移2个电子;则要制得相同质量的氯气,转移电子数目之比为2∶∶2=6∶5∶6。
2.已知Cl2在热的NaOH溶液中能自身发生氧化还原反应,完全反应后测得溶液中含氯元素成分为NaCl、NaClO、NaClO3,其中NaClO与NaClO3的个数之比为4∶1,则溶液中NaCl与NaClO3的个数之比为( )
A.9∶1 B.5∶4 C.9∶4 D.11∶2
解析:A 根据题意,Cl2+NaOHNaCl+NaClO+NaClO3+H2O,其中NaClO与NaClO3的个数之比为4∶1,氯气中0价的氯失1个电子变成NaClO,失去5个电子变成NaClO3,失电子总数为 1×4+5=9;氯气中0价的氯得1个电子变成NaCl,由得失电子守恒,共生成9个NaCl,则溶液中NaCl与NaClO3的个数之比为9∶1。
1.汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞时发生反应为10NaN3+2KNO3K2O+5Na2O+16N2↑。下列判断正确的是( )
A.该反应中N2既是氧化剂又是还原剂
B.还原产物与氧化产物质量之比为1∶15
C.每生成16个N2分子转移30个电子
D.NaN3中N元素被还原
解析:B 只有N元素的化合价变化,则N2既是氧化产物又是还原产物,A错误;根据化合价分析可知,每生成16个N2分子,有15个N2是氧化产物,有1个N2是还原产物,故还原产物与氧化产物质量之比为1∶15,B正确;由反应可知,2个KNO3参加反应转移电子数为2×(5-0)=10,即每生成16个N2转移10个电子,C错误;NaN3中N元素化合价升高,失去电子被氧化,D错误。
2.关于反应Na2S2O3+H2SO4Na2SO4+S↓+SO2↑+H2O,下列说法正确的是( )
A.H2SO4 发生还原反应
B.Na2S2O3 既是氧化剂又是还原剂
C.氧化产物与还原产物的分子个数之比为2∶1
D.1分子Na2S2O3 发生反应,转移4个电子
解析:B Na2S2O3+H2SO4Na2SO4+S ↓+SO2↑+H2O,Na2S2O3中的S的平均化合价为+2价,其分别转化为S(0价)和SO2(+4价),故其既是氧化剂又是还原剂,1分子 Na2S2O3发生反应,要转移2 个电子,B正确,D错误;H2SO4所含元素的化合价均未发生变化,故其没有发生还原反应,A错误;该反应的氧化产物是SO2,还原产物为S,氧化产物与还原产物的分子个数之比为1∶1,C错误。
3.NaBH4(NaBH4 中H为-1价)在工业生产中扮演十分重要的角色,能溶于水并和水反应,有如下反应NaBH4+2H2ONaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A.NaBH4 是氧化剂,H2O 是还原剂
B.硼元素被氧化,氢元素被还原
C.被氧化的元素与被还原的元素质量比为1∶1
D.每生成4个H2,转移电子数为8个
解析:C NaBH4 中H为-1价,Na为+1价,B为+3价,由反应可知反应前后NaBH4 中-1价H变为0价,NaBH4 作还原剂,H2O中+1价H变为0价,H2O作氧化剂,两者反应生成氢气,被氧化的H与被还原的H的个数相等,质量比为1∶1,反应前后B元素的化合价没有发生变化,B元素既不被氧化也不被还原,A、B错误,C正确;每生成4个H2,转移电子数为4个,D错误。
4.氧化还原反应是中学化学的重要内容。回答下列问题:
(1)野外,一般用铝热反应来焊接铁轨,其化学方程式为Fe2O3+2AlAl2O3+2Fe,该反应中氧化剂为 。
解析:(1)该反应中铁的化合价由+3价变为0价,化合价降低,故Fe2O3是氧化剂。
答案:(1)Fe2O3
(2)有反应:KClO3+6HCl(浓)KCl+3Cl2↑+3H2O,该方程式改写成离子方程式为 ;被氧化和被还原的氯原子的个数之比为 。
解析:(2)在该反应所涉及的物质中,氯气是单质、水是弱电解质,不能拆,其他的物质都可以拆,故离子方程式为Cl+6H++5Cl-3Cl2 ↑+3H2O;在该反应中,6个HCl中的5个HCl被氧化,KClO3中的氯化合价降低,被还原,故被氧化和被还原的氯原子的个数之比为5∶1。
答案:(2)Cl+6H++5Cl-3Cl2 ↑+3H2O 5∶1
(3)高铁酸钠是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下,配平该离子方程式: ClO-+ Fe3++ OH- Fe+ Cl-+ H2O
解析:(3)Fe元素化合价由+3价升高为+6价,Cl元素化合价由+1价降低为-1价,根据得失电子守恒、电荷守恒、质量守恒,配平离子方程式为3ClO-+2Fe3++10OH-2Fe+3Cl-+5H2O。
答案:(3)3 2 10 2 3 5
