1.2.1电解质的电离 课件(共39张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离 课件(共39张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 591.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 10:31:19 | ||
图片预览








文档简介
(共39张PPT)
电解质的电离
学习目标:
1.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
2.能用电离方程式表示某些酸、碱、盐的电离。
分点突破(一) 电解质与非电解质
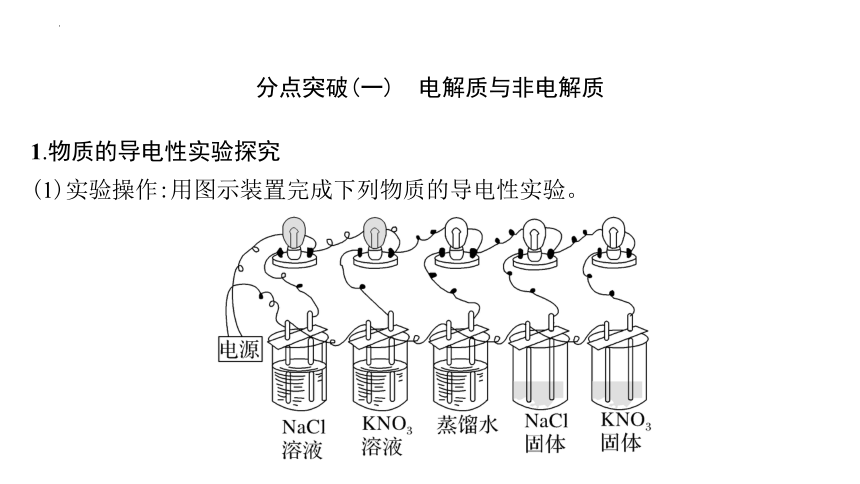
1.物质的导电性实验探究
(1)实验操作:用图示装置完成下列物质的导电性实验。
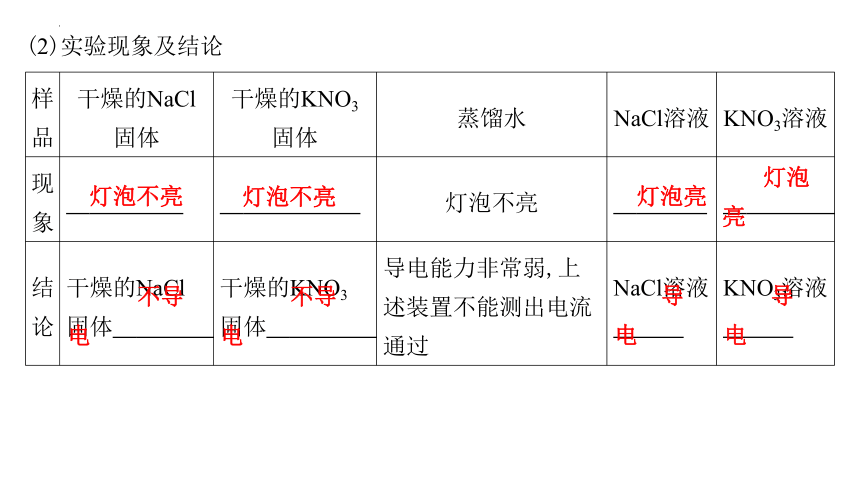
(2)实验现象及结论
样品 干燥的NaCl固体 干燥的KNO3固体 蒸馏水 NaCl溶液 KNO3溶液
现象 灯泡不亮 灯泡不亮 灯泡不亮 灯泡亮 灯泡亮
结论 干燥的NaCl固体 不导电 干燥的KNO3固体 不导电 导电能力非常弱,上述装置不能测出电流通过 NaCl溶液 导电 KNO3溶液 导电
灯泡不亮
灯泡不亮
灯泡亮
灯泡
亮
不导
电
不导
电
导
电
导
电
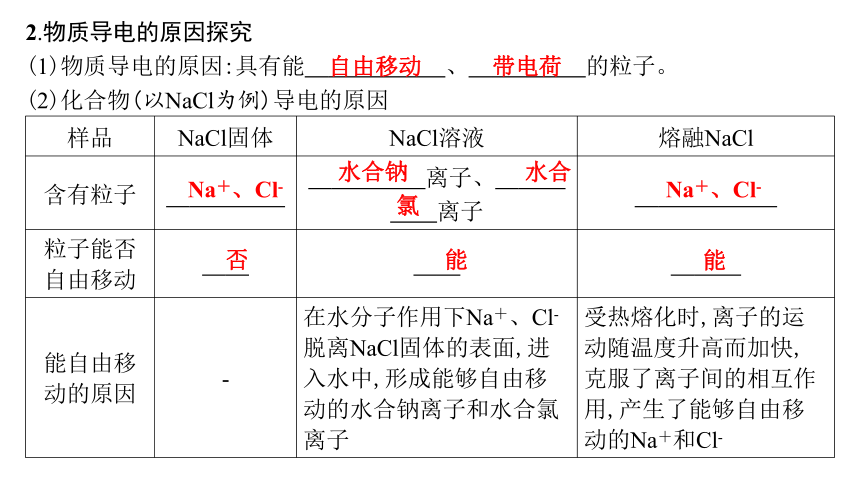
2.物质导电的原因探究
(1)物质导电的原因:具有能 自由移动 、 带电荷 的粒子。
(2)化合物(以NaCl为例)导电的原因
样品 NaCl固体 NaCl溶液 熔融NaCl
含有粒子 Na+、Cl- 水合钠 离子、 水合氯 离子 Na+、Cl-
粒子能否 自由移动 否 能 能
能自由移 动的原因 - 在水分子作用下Na+、Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子 受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-
自由移动
带电荷
Na+、Cl-
水合钠
水合
氯
Na+、Cl-
否
能
能
结论:化合物能导电的状态为 水溶液 或 熔融状态 。
(3)带电荷粒子在导电时的移动方向
当在NaCl溶液中插入电极并接通电源时,带 正 电荷的水合 钠 离子向与电源负极相连的电极移动。在熔融的NaCl中,带 负 电荷的水合 氯 离子向与电源正极相连的电极移动。
水溶液
熔融状态
正
钠
负
氯
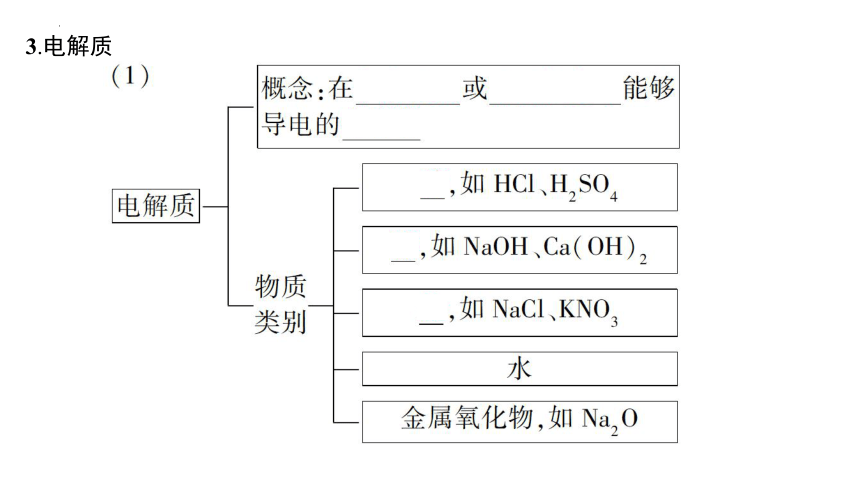
3.电解质
现有下列物质:①蔗糖 ②熔融NaCl ③HCl的水溶液 ④Fe ⑤NaOH固体 ⑥SO2的水溶液 ⑦NH3 ⑧SO3 ⑨氨水 ⑩液态H2SO4
回答下列问题:
(1)上述状态下可导电的是 (填序号,下同)。
提示:(1)②③④⑥⑨
(2)属于电解质的是 。
提示:(2)②⑤⑩
(3)属于非电解质的是 。
提示:(3)①⑦⑧
(4)上述状态下的电解质不能导电的是 。
提示:(4)⑤⑩
(5)若SO2的水溶液导电能说明SO2是电解质吗 为什么
提示:(5)不能,因为SO2不是电解质,SO2溶于水生成了H2SO3,H2SO3电离使水溶液导电而非SO2自身电离。
1.电解质、非电解质均必须是化合物,混合物(溶液)、单质既不是电解质也不是非电解质。
2.电解质与导电性的关系
(1)有些电解质溶于水能导电,在熔融状态下不能导电,如HCl、H2SO4等。
(2)有些电解质只在熔融状态下能导电,如BaSO4、CaCO3等。
(3)能导电的物质不一定是电解质,如金属、石墨、盐酸等,电解质本身也不一定能导电,如NaCl固体、HCl气体等。
(4)溶于水能导电的化合物不一定是电解质,如SO2、NH3等。
3.电解质与溶解性的关系
电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
1.下列物质属于电解质的是( )
A.Cu B.CO2
C.盐酸 D.熔融氯化钠
解析:D 铜是单质,不是化合物,A错误;二氧化碳与水反应生成碳酸能导电,其本身不能导电,B错误;盐酸是氯化氢的水溶液,是混合物,C错误;熔融氯化钠可以导电,D正确。
2.电解质是指在水溶液中或熔融状态下能够导电的化合物。几位同学对此定义中关键词发表了以下理解或看法,你认为不正确的是( )
A.“或”字意味着水溶液中、熔融状态下这两个条件只需具备其中之一就行了
B.“能够导电”是指该物质本身能够导电,而不是它发生反应后的生成物能导电
C.“化合物”指明了该物质不能是单质,更不能是混合物
D.像硫酸钡、碳酸钙这样难溶的化合物就不可能是电解质
解析:D 硫酸钡、碳酸钙在熔融状态下能够导电,能否导电与溶解性无关。
3.下列叙述中正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl和NaCl均是非电解质
B.NH3、SO3的水溶液均能导电,所以NH3、SO3均是电解质
C.铜丝、石墨均能导电,所以它们是电解质
D.蔗糖、乙醇在水溶液里和熔融状态下均不导电,所以它们是非电解质
解析:D 在水溶液里或熔融状态下能导电的化合物是电解质,在上述情况下都不能导电的化合物即为非电解质,A项错误,D项正确;NH3、SO3的水溶液能导电,是因为它们溶于水后生成的NH3·H2O、H2SO3能电离出自由移动的离子,而NH3、SO3本身不能电离出离子,所以NH3·H2O、H2SO3是电解质,NH3、SO3是非电解质,B项错误;单质既不是电解质也不是非电解质,C项错误。
分点突破(二) 电解质的电离
1.电解质的电离
(1)概念:电解质 溶于水 或 受热熔化 时,形成自由移动的 离子 的过程叫做电离。
(2)表示方法——电离方程式
电解质的电离可以用电离方程式表示,为简便起见,一般仍用 离子符号 表示水合离子。
溶于水
受热熔化
离子
离子符号
②NaOHNa++OH-;
③MgCl2M+2Cl-。
(3)实例
分别写出H2SO4、NaOH、MgCl2的电离方程式。
①H2SO42H++S;
2.从电离的角度认识酸、碱、盐的本质
NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为
。
提示:(1)NaHSO4Na++H++S
(2)NaHSO4在熔融状态下的电离方程式为
。
提示:(2)NaHSO4(熔融)Na++HS
(3)下列说法正确的是 (填字母)。
a.NaHSO4属于酸
b.NaHSO4属于盐
c.NaHSO4属于电解质
d.NaHSO4溶液能与Zn反应生成氢气
提示:(3)bcd
1.酸式盐的电离方程式
(1)强酸的酸式盐在水溶液中完全电离,如在水溶液中NaHSO4的电离方程式为NaHSO4Na++H++S,熔融状态下NaHSO4的电离方程式为NaHSO4Na++HS。
(2)弱酸的酸式盐在水溶液中电离生成酸式酸根阴离子和阳离子,如NaHCO3Na++HC。
2.电离方程式的书写注意事项
(1)符合客观事实,不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
(2)质量守恒,即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
(3)电荷守恒,即电离方程式左右两侧的正、负电荷数相等,溶液呈电中性。
1.在以下各种情形下,下列电离方程式书写正确的是( )
A.熔融状态下NaHSO4的电离:NaHSO4Na++H++S
B.水溶液中Ba(OH)2的电离:Ba(OH)2Ba2++OH-
C.水溶液中NaHCO3的电离:NaHCO3Na++HC
D.水溶液中Al2(SO4)3的电离:Al2(SO4)33Al3++3S
解析:C 熔融状态下的NaHSO4电离方程式为NaHSO4Na++HS,A错误;水溶液中的 Ba(OH)2电离方程式为Ba(OH)2Ba2++2OH-,B错误;水溶液中的Al2(SO4)3电离方程式为Al2(SO4)32Al3++3S,D错误。
2.下列关于酸、碱、盐的说法中,正确的是( )
A.在水溶液中能电离产生氢氧根离子的化合物一定是碱
B.能与碱发生反应生成水的化合物是酸
C.电离时有金属阳离子产生的化合物一定是盐
D.酸不可能电离产生金属阳离子
解析:D 在水溶液中能电离产生氢氧根离子的化合物不一定是碱(如碱式盐);能与碱反应生成水的化合物不一定是酸(如硫酸氢钠);盐和碱电离时,都可能产生金属阳离子。
3.物质M在水中发生如下电离:MX2++2Y-,则下列判断不正确的是( )
A.M一定不是酸 B.X2+一定是金属离子
C.Y-可能是OH- D.M一定属于盐
解析:D 酸中含有的阳离子是氢离子,氢离子带一个单位的正电荷,M一定不是酸,A正确;M不是酸,则M可能是盐或碱,故X2+一定是金属离子,B正确;若M为Ba(OH)2,则Y-是OH-,若M为氯化钙,能电离产生2个氯离子和1个钙离子,C正确;M不一定属于盐,如氢氧化钙能电离产生1个钙离子和2个氢氧根离子,D错误。
电解质溶液导电能力的实验(探究与创新)
已知溶液的导电性强弱由溶液中离子的浓度大小及离子所带电荷数决定。离子浓度越大,电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:
(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质A可以是 (填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体
③蔗糖晶体 ④酒精 ⑤氯化钠溶液
⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
解析:(1)干燥的氯化钠晶体、氢氧化钠晶体虽由离子构成,但离子不能自由移动,所以不能导电,两者溶于水后,在水分子的作用下,电离成自由移动的阴、阳离子(实为水合离子),所以二者的水溶液能导电;蔗糖由分子构成,不能导电,酒精也不能导电。
答案:(1)⑤⑥⑦⑧
(2)在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液或通入一种气体时,则灯泡由亮变暗至熄灭后又逐渐变亮的是 (填字母)。
A.稀盐酸中逐滴加入食盐溶液
B.稀硫酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.稀硝酸中逐滴加入氢氧化钡溶液
解析:(2)溶液能否导电,取决于溶液中是否有离子存在;导电性强弱则由离子浓度大小等因素决定。C项中饱和石灰水中通入CO2,先生成碳酸钙沉淀和水,当二者恰好完全反应生成碳酸钙时,此时离子浓度几乎为0,灯泡熄灭,继续通入CO2后,CO2和碳酸钙、水反应生成可溶性的碳酸氢钙,溶液中离子浓度增大,灯泡变亮,故选C。
答案:(2)C
电解质溶液的导电能力
(1)电解质溶液的导电能力与单位体积内电解质电离的离子数目及相应离子所带电荷多少有关,单位体积内电解质电离的离子数目越多,相应离子所带电荷越多,导电能力越强。
(2)判断电解质是否导电,关键要看电解质是否发生电离产生了自由移动的离子,还要看单位体积内电解质电离的离子数目的多少,如CaCO3在水中的溶解度很小,故认为其水溶液导电能力很弱。
1.2 g NaOH固体分别加入下列100 mL液体中,溶液导电能力变化不大的是( )
A.自来水
B.含2.45 g H2SO4的硫酸溶液
C.含2.925 g NaCl的溶液
D.含4.25 g NaNO3的溶液
解析:B 溶液导电能力大小看其中的离子浓度和离子所带电荷数。依题意,A项,投入后自来水中离子浓度大幅增大,溶液导电能力变化大,不选;C项,投入后直接增加溶液中离子浓度,溶液导电能力变化大,不选;D项,投入后直接增加溶液中离子浓度,溶液导电能力变化大,不选。
2.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中不正确的是( )
A.AB段溶液的导电能力不断减弱, 说明生成的BaSO4不是电解质
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和,反应的化学方程式为 Ba(OH)2+H2SO4BaSO4↓+2H2O
D.BC段溶液的导电能力不断增大,主要是由于过量的硫酸电离出的离子导电
解析:A BaSO4虽然难溶于水,但溶于水的部分能够电离或熔融状态能够导电,属于电解质,A不正确;B处溶质是硫酸钡,在水溶液电离出的离子浓度极小,导电能力约为0,说明溶液中几乎没有自由移动的离子,B正确;a时刻Ba(OH)2和稀硫酸恰好完全反应生成硫酸钡和水,C正确;BC段溶液的导电能力不断增大,主要是由于过量的硫酸电离出的离子导电,D正确。
1.下列物质属于电解质且能导电的是( )
A.金属铜 B.碳酸钠晶体
C.硝酸钠溶液 D.熔融的硫酸氢钠
解析:D 金属铜能导电,但属于金属单质,既不是电解质也不是非电解质;碳酸钠晶体不能电离出自由移动的离子,不能导电,其水溶液能导电,属于电解质;硝酸钠溶液能导电,但属于混合物,既不是电解质也不是非电解质;熔融的硫酸氢钠能电离出自由移动的离子,能导电,属于电解质。
2.下列各组关于电解质、非电解质的归类,完全正确的是( )
选项 A B C D
电解质 Fe NaCl溶液 CaCO3 HNO3
非电解质 C12H22O11 (蔗糖) BaSO4 SO2 H2O
解析:C A项,Fe是单质,既不是电解质,也不是非电解质;B项,NaCl溶液是混合物,既不是电解质,也不是非电解质,BaSO4虽难溶于水,但BaSO4是盐,属于电解质;D项,H2O是电解质。
3.医院里医生给病人做心电图时,在仪器与皮肤接触部位擦的一种电解质溶液是( )
A.氯化钠溶液 B.医用酒精
C.葡萄糖溶液 D.碘酒
解析:A 氯化钠是电解质,溶于水可以导电;乙醇、葡萄糖为非电解质,碘酒是混合物,既不是电解质也不是非电解质,所以医用酒精、葡萄糖溶液和碘酒均不导电,做心电图时在仪器与皮肤接触部位擦的一种电解质溶液是氯化钠溶液。
4.下列说法或者有关化学用语的描述正确的是( )
A.NaCl溶于水在电流作用下电离成Na+和Cl-
B.NH4NO3电离时产生了N和N,无金属离子,所以NH4NO3不是盐
C.HCl、H2SO4液态时都不导电,但它们都是电解质
D.Ba(OH)2在水中的电离方程式为Ba(OH)2Ba2++OH-
解析:C NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+和Cl-,而不是电流的作用,A错误;N的性质与金属离子相似,NH4NO3是铵盐,B错误;HCl、H2SO4液态时虽不导电,但在溶液中能导电,所以HCl和H2SO4都是电解质,C正确;Ba(OH)2在水中的电离方程式为Ba(OH)2Ba2++2OH-,D错误。
5.(1)下列物质的电离方程式如下:
HClO4H++Cl;Ba(OH)2Ba2++2OH-;Fe2(SO4)32Fe3++3S;KHSO4K++H++S。
属于酸的物质是 (写化学式,下同);属于碱的物质是 ;属于盐的物质是 。
解析:(1)根据酸、碱、盐的概念判断。
答案:(1)HClO4 Ba(OH)2 Fe2(SO4)3、KHSO4
①从物质的分类角度看,不恰当的一种物质是 。
②写出纯碱的电离方程式: 。
解析:(2)纯碱的化学式为Na2CO3,属于盐,不是碱;Na2CO3是电解质,电离方程式为Na2CO32Na++C。
答案:(2)①纯碱 ②Na2CO32Na++C
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
电解质的电离
学习目标:
1.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
2.能用电离方程式表示某些酸、碱、盐的电离。
分点突破(一) 电解质与非电解质
1.物质的导电性实验探究
(1)实验操作:用图示装置完成下列物质的导电性实验。
(2)实验现象及结论
样品 干燥的NaCl固体 干燥的KNO3固体 蒸馏水 NaCl溶液 KNO3溶液
现象 灯泡不亮 灯泡不亮 灯泡不亮 灯泡亮 灯泡亮
结论 干燥的NaCl固体 不导电 干燥的KNO3固体 不导电 导电能力非常弱,上述装置不能测出电流通过 NaCl溶液 导电 KNO3溶液 导电
灯泡不亮
灯泡不亮
灯泡亮
灯泡
亮
不导
电
不导
电
导
电
导
电
2.物质导电的原因探究
(1)物质导电的原因:具有能 自由移动 、 带电荷 的粒子。
(2)化合物(以NaCl为例)导电的原因
样品 NaCl固体 NaCl溶液 熔融NaCl
含有粒子 Na+、Cl- 水合钠 离子、 水合氯 离子 Na+、Cl-
粒子能否 自由移动 否 能 能
能自由移 动的原因 - 在水分子作用下Na+、Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子 受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-
自由移动
带电荷
Na+、Cl-
水合钠
水合
氯
Na+、Cl-
否
能
能
结论:化合物能导电的状态为 水溶液 或 熔融状态 。
(3)带电荷粒子在导电时的移动方向
当在NaCl溶液中插入电极并接通电源时,带 正 电荷的水合 钠 离子向与电源负极相连的电极移动。在熔融的NaCl中,带 负 电荷的水合 氯 离子向与电源正极相连的电极移动。
水溶液
熔融状态
正
钠
负
氯
3.电解质
现有下列物质:①蔗糖 ②熔融NaCl ③HCl的水溶液 ④Fe ⑤NaOH固体 ⑥SO2的水溶液 ⑦NH3 ⑧SO3 ⑨氨水 ⑩液态H2SO4
回答下列问题:
(1)上述状态下可导电的是 (填序号,下同)。
提示:(1)②③④⑥⑨
(2)属于电解质的是 。
提示:(2)②⑤⑩
(3)属于非电解质的是 。
提示:(3)①⑦⑧
(4)上述状态下的电解质不能导电的是 。
提示:(4)⑤⑩
(5)若SO2的水溶液导电能说明SO2是电解质吗 为什么
提示:(5)不能,因为SO2不是电解质,SO2溶于水生成了H2SO3,H2SO3电离使水溶液导电而非SO2自身电离。
1.电解质、非电解质均必须是化合物,混合物(溶液)、单质既不是电解质也不是非电解质。
2.电解质与导电性的关系
(1)有些电解质溶于水能导电,在熔融状态下不能导电,如HCl、H2SO4等。
(2)有些电解质只在熔融状态下能导电,如BaSO4、CaCO3等。
(3)能导电的物质不一定是电解质,如金属、石墨、盐酸等,电解质本身也不一定能导电,如NaCl固体、HCl气体等。
(4)溶于水能导电的化合物不一定是电解质,如SO2、NH3等。
3.电解质与溶解性的关系
电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
1.下列物质属于电解质的是( )
A.Cu B.CO2
C.盐酸 D.熔融氯化钠
解析:D 铜是单质,不是化合物,A错误;二氧化碳与水反应生成碳酸能导电,其本身不能导电,B错误;盐酸是氯化氢的水溶液,是混合物,C错误;熔融氯化钠可以导电,D正确。
2.电解质是指在水溶液中或熔融状态下能够导电的化合物。几位同学对此定义中关键词发表了以下理解或看法,你认为不正确的是( )
A.“或”字意味着水溶液中、熔融状态下这两个条件只需具备其中之一就行了
B.“能够导电”是指该物质本身能够导电,而不是它发生反应后的生成物能导电
C.“化合物”指明了该物质不能是单质,更不能是混合物
D.像硫酸钡、碳酸钙这样难溶的化合物就不可能是电解质
解析:D 硫酸钡、碳酸钙在熔融状态下能够导电,能否导电与溶解性无关。
3.下列叙述中正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl和NaCl均是非电解质
B.NH3、SO3的水溶液均能导电,所以NH3、SO3均是电解质
C.铜丝、石墨均能导电,所以它们是电解质
D.蔗糖、乙醇在水溶液里和熔融状态下均不导电,所以它们是非电解质
解析:D 在水溶液里或熔融状态下能导电的化合物是电解质,在上述情况下都不能导电的化合物即为非电解质,A项错误,D项正确;NH3、SO3的水溶液能导电,是因为它们溶于水后生成的NH3·H2O、H2SO3能电离出自由移动的离子,而NH3、SO3本身不能电离出离子,所以NH3·H2O、H2SO3是电解质,NH3、SO3是非电解质,B项错误;单质既不是电解质也不是非电解质,C项错误。
分点突破(二) 电解质的电离
1.电解质的电离
(1)概念:电解质 溶于水 或 受热熔化 时,形成自由移动的 离子 的过程叫做电离。
(2)表示方法——电离方程式
电解质的电离可以用电离方程式表示,为简便起见,一般仍用 离子符号 表示水合离子。
溶于水
受热熔化
离子
离子符号
②NaOHNa++OH-;
③MgCl2M+2Cl-。
(3)实例
分别写出H2SO4、NaOH、MgCl2的电离方程式。
①H2SO42H++S;
2.从电离的角度认识酸、碱、盐的本质
NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为
。
提示:(1)NaHSO4Na++H++S
(2)NaHSO4在熔融状态下的电离方程式为
。
提示:(2)NaHSO4(熔融)Na++HS
(3)下列说法正确的是 (填字母)。
a.NaHSO4属于酸
b.NaHSO4属于盐
c.NaHSO4属于电解质
d.NaHSO4溶液能与Zn反应生成氢气
提示:(3)bcd
1.酸式盐的电离方程式
(1)强酸的酸式盐在水溶液中完全电离,如在水溶液中NaHSO4的电离方程式为NaHSO4Na++H++S,熔融状态下NaHSO4的电离方程式为NaHSO4Na++HS。
(2)弱酸的酸式盐在水溶液中电离生成酸式酸根阴离子和阳离子,如NaHCO3Na++HC。
2.电离方程式的书写注意事项
(1)符合客观事实,不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
(2)质量守恒,即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
(3)电荷守恒,即电离方程式左右两侧的正、负电荷数相等,溶液呈电中性。
1.在以下各种情形下,下列电离方程式书写正确的是( )
A.熔融状态下NaHSO4的电离:NaHSO4Na++H++S
B.水溶液中Ba(OH)2的电离:Ba(OH)2Ba2++OH-
C.水溶液中NaHCO3的电离:NaHCO3Na++HC
D.水溶液中Al2(SO4)3的电离:Al2(SO4)33Al3++3S
解析:C 熔融状态下的NaHSO4电离方程式为NaHSO4Na++HS,A错误;水溶液中的 Ba(OH)2电离方程式为Ba(OH)2Ba2++2OH-,B错误;水溶液中的Al2(SO4)3电离方程式为Al2(SO4)32Al3++3S,D错误。
2.下列关于酸、碱、盐的说法中,正确的是( )
A.在水溶液中能电离产生氢氧根离子的化合物一定是碱
B.能与碱发生反应生成水的化合物是酸
C.电离时有金属阳离子产生的化合物一定是盐
D.酸不可能电离产生金属阳离子
解析:D 在水溶液中能电离产生氢氧根离子的化合物不一定是碱(如碱式盐);能与碱反应生成水的化合物不一定是酸(如硫酸氢钠);盐和碱电离时,都可能产生金属阳离子。
3.物质M在水中发生如下电离:MX2++2Y-,则下列判断不正确的是( )
A.M一定不是酸 B.X2+一定是金属离子
C.Y-可能是OH- D.M一定属于盐
解析:D 酸中含有的阳离子是氢离子,氢离子带一个单位的正电荷,M一定不是酸,A正确;M不是酸,则M可能是盐或碱,故X2+一定是金属离子,B正确;若M为Ba(OH)2,则Y-是OH-,若M为氯化钙,能电离产生2个氯离子和1个钙离子,C正确;M不一定属于盐,如氢氧化钙能电离产生1个钙离子和2个氢氧根离子,D错误。
电解质溶液导电能力的实验(探究与创新)
已知溶液的导电性强弱由溶液中离子的浓度大小及离子所带电荷数决定。离子浓度越大,电荷数越多,则溶液导电性越强。某兴趣小组同学做了以下实验:
(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质A可以是 (填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体
③蔗糖晶体 ④酒精 ⑤氯化钠溶液
⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
解析:(1)干燥的氯化钠晶体、氢氧化钠晶体虽由离子构成,但离子不能自由移动,所以不能导电,两者溶于水后,在水分子的作用下,电离成自由移动的阴、阳离子(实为水合离子),所以二者的水溶液能导电;蔗糖由分子构成,不能导电,酒精也不能导电。
答案:(1)⑤⑥⑦⑧
(2)在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液或通入一种气体时,则灯泡由亮变暗至熄灭后又逐渐变亮的是 (填字母)。
A.稀盐酸中逐滴加入食盐溶液
B.稀硫酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.稀硝酸中逐滴加入氢氧化钡溶液
解析:(2)溶液能否导电,取决于溶液中是否有离子存在;导电性强弱则由离子浓度大小等因素决定。C项中饱和石灰水中通入CO2,先生成碳酸钙沉淀和水,当二者恰好完全反应生成碳酸钙时,此时离子浓度几乎为0,灯泡熄灭,继续通入CO2后,CO2和碳酸钙、水反应生成可溶性的碳酸氢钙,溶液中离子浓度增大,灯泡变亮,故选C。
答案:(2)C
电解质溶液的导电能力
(1)电解质溶液的导电能力与单位体积内电解质电离的离子数目及相应离子所带电荷多少有关,单位体积内电解质电离的离子数目越多,相应离子所带电荷越多,导电能力越强。
(2)判断电解质是否导电,关键要看电解质是否发生电离产生了自由移动的离子,还要看单位体积内电解质电离的离子数目的多少,如CaCO3在水中的溶解度很小,故认为其水溶液导电能力很弱。
1.2 g NaOH固体分别加入下列100 mL液体中,溶液导电能力变化不大的是( )
A.自来水
B.含2.45 g H2SO4的硫酸溶液
C.含2.925 g NaCl的溶液
D.含4.25 g NaNO3的溶液
解析:B 溶液导电能力大小看其中的离子浓度和离子所带电荷数。依题意,A项,投入后自来水中离子浓度大幅增大,溶液导电能力变化大,不选;C项,投入后直接增加溶液中离子浓度,溶液导电能力变化大,不选;D项,投入后直接增加溶液中离子浓度,溶液导电能力变化大,不选。
2.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中不正确的是( )
A.AB段溶液的导电能力不断减弱, 说明生成的BaSO4不是电解质
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和,反应的化学方程式为 Ba(OH)2+H2SO4BaSO4↓+2H2O
D.BC段溶液的导电能力不断增大,主要是由于过量的硫酸电离出的离子导电
解析:A BaSO4虽然难溶于水,但溶于水的部分能够电离或熔融状态能够导电,属于电解质,A不正确;B处溶质是硫酸钡,在水溶液电离出的离子浓度极小,导电能力约为0,说明溶液中几乎没有自由移动的离子,B正确;a时刻Ba(OH)2和稀硫酸恰好完全反应生成硫酸钡和水,C正确;BC段溶液的导电能力不断增大,主要是由于过量的硫酸电离出的离子导电,D正确。
1.下列物质属于电解质且能导电的是( )
A.金属铜 B.碳酸钠晶体
C.硝酸钠溶液 D.熔融的硫酸氢钠
解析:D 金属铜能导电,但属于金属单质,既不是电解质也不是非电解质;碳酸钠晶体不能电离出自由移动的离子,不能导电,其水溶液能导电,属于电解质;硝酸钠溶液能导电,但属于混合物,既不是电解质也不是非电解质;熔融的硫酸氢钠能电离出自由移动的离子,能导电,属于电解质。
2.下列各组关于电解质、非电解质的归类,完全正确的是( )
选项 A B C D
电解质 Fe NaCl溶液 CaCO3 HNO3
非电解质 C12H22O11 (蔗糖) BaSO4 SO2 H2O
解析:C A项,Fe是单质,既不是电解质,也不是非电解质;B项,NaCl溶液是混合物,既不是电解质,也不是非电解质,BaSO4虽难溶于水,但BaSO4是盐,属于电解质;D项,H2O是电解质。
3.医院里医生给病人做心电图时,在仪器与皮肤接触部位擦的一种电解质溶液是( )
A.氯化钠溶液 B.医用酒精
C.葡萄糖溶液 D.碘酒
解析:A 氯化钠是电解质,溶于水可以导电;乙醇、葡萄糖为非电解质,碘酒是混合物,既不是电解质也不是非电解质,所以医用酒精、葡萄糖溶液和碘酒均不导电,做心电图时在仪器与皮肤接触部位擦的一种电解质溶液是氯化钠溶液。
4.下列说法或者有关化学用语的描述正确的是( )
A.NaCl溶于水在电流作用下电离成Na+和Cl-
B.NH4NO3电离时产生了N和N,无金属离子,所以NH4NO3不是盐
C.HCl、H2SO4液态时都不导电,但它们都是电解质
D.Ba(OH)2在水中的电离方程式为Ba(OH)2Ba2++OH-
解析:C NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+和Cl-,而不是电流的作用,A错误;N的性质与金属离子相似,NH4NO3是铵盐,B错误;HCl、H2SO4液态时虽不导电,但在溶液中能导电,所以HCl和H2SO4都是电解质,C正确;Ba(OH)2在水中的电离方程式为Ba(OH)2Ba2++2OH-,D错误。
5.(1)下列物质的电离方程式如下:
HClO4H++Cl;Ba(OH)2Ba2++2OH-;Fe2(SO4)32Fe3++3S;KHSO4K++H++S。
属于酸的物质是 (写化学式,下同);属于碱的物质是 ;属于盐的物质是 。
解析:(1)根据酸、碱、盐的概念判断。
答案:(1)HClO4 Ba(OH)2 Fe2(SO4)3、KHSO4
①从物质的分类角度看,不恰当的一种物质是 。
②写出纯碱的电离方程式: 。
解析:(2)纯碱的化学式为Na2CO3,属于盐,不是碱;Na2CO3是电解质,电离方程式为Na2CO32Na++C。
答案:(2)①纯碱 ②Na2CO32Na++C
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
