1.3.1氧化还原反应 课件(共30张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.1氧化还原反应 课件(共30张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 932.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 10:31:56 | ||
图片预览






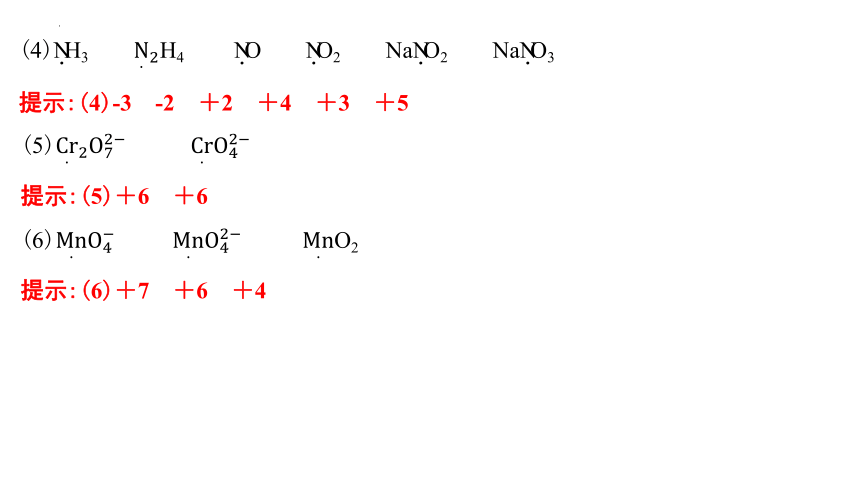


文档简介
(共30张PPT)
氧化还原反应
学习目标:
1.认识有化合价变化的反应是氧化还原反应。
2.了解氧化还原反应的本质是电子转移。
1.从得失氧的角度认识氧化还原反应
(1)从得失氧的角度分析以下反应。
2CuO+C 2Cu+CO2↑;
Fe2O3+3CO 2Fe+3CO2
分点突破(一) 氧化还原反应的基本概念
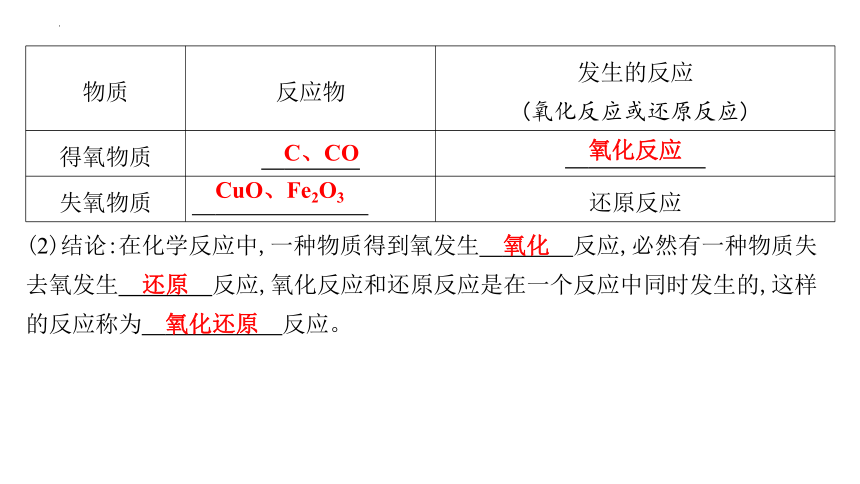
(2)结论:在化学反应中,一种物质得到氧发生 氧化 反应,必然有一种物质失去氧发生 还原 反应,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为 氧化还原 反应。
物质 反应物 发生的反应
(氧化反应或还原反应)
得氧物质 C、CO 氧化反应
失氧物质 CuO、Fe2O3 还原反应
C、CO
氧化反应
CuO、Fe2O3
氧化
还原
氧化还原
2.从元素化合价升降的角度认识氧化还原反应
(1)有氧元素参加的反应:2CuO+C 2Cu+CO2↑。
①铜元素化合价 降低 ,发生 还原 反应。
②碳元素化合价 升高 ,发生 氧化 反应。
降低
还原
升高
氧化
(2)没有氧元素参加的反应:Fe+CuSO4FeSO4+Cu。
①铜元素化合价 降低 ,发生 还原 反应。
②铁元素化合价 升高 ,发生 氧化 反应。
降低
还原
升高
氧化
(3)结论:凡是有元素化合价 升降 的反应,都是氧化还原反应。所含元素化合价升高的物质,发生 氧化 反应;所含元素化合价降低的物质,发生 还原 反应。
升降
氧化
还原
3.从电子转移角度认识氧化还原反应
化学反应
氧化反应 Na→NaCl H2→HCl
Na原子 失去 电子 共用电子对偏离 H原子
还原反应 Cl2→NaCl Cl2→HCl
Cl原子 得到 电子 共用电子对偏向 Cl原子
结论 凡是有电子转移(得失或偏移)的化学反应都是氧化还原反应。失去电子(或电子对偏离)发生 氧化 反应;得到电子(或电子对偏向)发生 还原 反应
失去
H原子
得到
Cl原子
氧化
还原
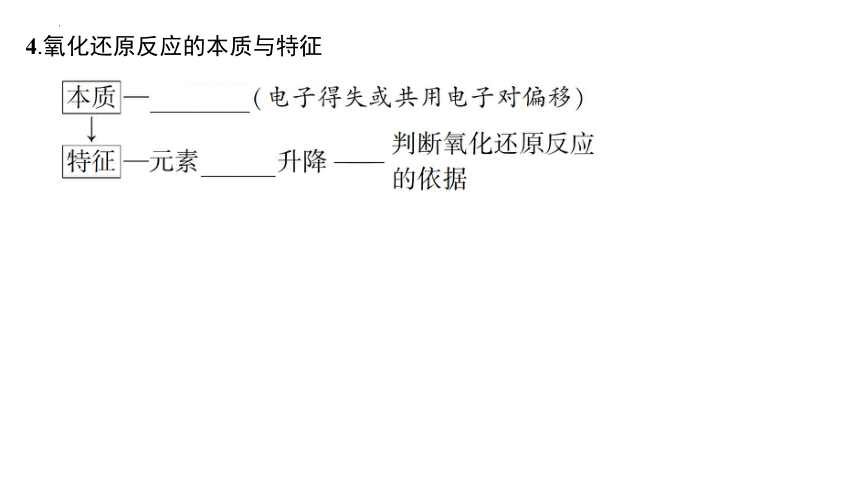
4.氧化还原反应的本质与特征
1.标出下列加点元素的化合价。
(1)O NaH.
提示:(1)+1 -1
(2)CuO. H2
提示:(2)-2 -1
(3)K2S. S.O2 Na2S.O3 NaHS.O3 H2S.O4
提示:(3)-2 +4 +4 +4 +6
(4)N.H3 H4 N.O N.O2 NaN.O2 NaN.O3
提示:(4)-3 -2 +2 +4 +3 +5
(5)
提示:(5)+6 +6
(6) O2
提示:(6)+7 +6 +4
2.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可以分为氧化还原反应和非氧化还原反应。回答下列问题:
①CO2+C2CO
②2Fe+3Cl22FeCl3
③C+H2O(g)CO+H2
④2H2O 2H2↑+O2↑
⑤Na2SO4+BaCl22NaCl+BaSO4↓
⑥H2O2+H2SS↓+2H2O
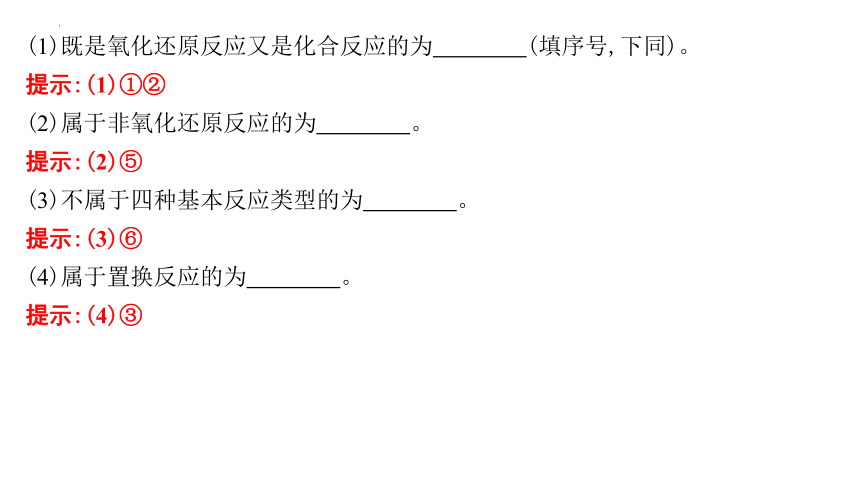
(1)既是氧化还原反应又是化合反应的为 (填序号,下同)。
提示:(1)①②
(2)属于非氧化还原反应的为 。
提示:(2)⑤
(3)不属于四种基本反应类型的为 。
提示:(3)⑥
(4)属于置换反应的为 。
提示:(4)③
1.氧化还原反应中易错点
(1)在氧化还原反应中,并不是所有元素的化合价都发生改变,故不一定所有的元素都发生氧化还原反应。如反应Fe+CuSO4Cu+FeSO4中,Fe、Cu元素的化合价变化,S、O元素的化合价不变。
(2)在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原。如反应Cl2+H2OHCl+HClO中,被氧化和被还原的元素都是氯元素。
(3)元素由化合态(化合物)转变为游离态(单质)可能被氧化,也可能被还原。如反应2H2O 2H2↑+O2↑中,H元素被还原,O元素被氧化。
2.氧化还原反应与四种基本反应类型的关系
1.下列变化中,未涉及氧化还原反应的是( )
A.钟乳石的形成 B.氢气的燃烧
C.菜刀生锈 D.高锰酸钾制氧气
解析:A 钟乳石的形成过程中为碳酸钙和二氧化碳、水的反应,在物质变化过程中元素化合价不发生变化,因此不涉及氧化还原反应,A符合题意。
2.下列有关氧化还原反应的叙述正确的是( )
A.有单质参加或生成的化学反应一定是氧化还原反应
B.有单质生成的分解反应属于氧化还原反应,因为组成该单质的元素的化合价必然发生变化
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子对偏离
D.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
解析:B 有电子转移的反应是氧化还原反应,有单质参加或生成的化学反应不一定是氧化还原反应,如同素异形体之间的转化就不是氧化还原反应,A错误;有单质生成的分解反应,元素的化合价发生了变化,因此一定属于氧化还原反应,B正确;被氧化的物质失去电子或电子对偏离,被还原的物质得到电子或电子对偏向,C错误;氧化还原反应中一种元素被氧化的同时,该元素可能也被还原,D错误。
3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于氧化还原反应但不包含在1、2、3、4范围内的是( )
A.Cl2+2KII2+2KCl
B.NH4HCO3NH3↑+CO2↑+H2O
C.2FeCl2+Cl22FeCl3
D.3NO2+H2O2HNO3+NO
解析:D A项,属于置换反应,也属于氧化还原反应;B项,属于分解反应,不属于氧化还原反应;C项,属于化合反应,属于氧化还原反应;D项,属于氧化还原反应但不包含在1、2、3、4范围内。
4.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
A. SO2 +2NaOHNa2SO3+H2O
B.2 CuO +C 2Cu+CO2↑
C.2FeCl3+ Fe 3FeCl2
D.Zn+2 HCl ZnCl2+H2↑
解析:C 该反应不是氧化还原反应,A错误;铜元素由+2价降到0价,发生还原反应,B错误;FeFeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;氢元素由+1价降到0价,发生还原反应,D错误。
SO2
CuO
Fe
HCl
分点突破(二) 电子转移的表示方法及氧化还原反应与反应类型的关系
1.双线桥法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
基本步骤
2.单线桥法
表示反应过程中不同元素原子间的电子转移情况。
基本步骤
使用双线桥法和单线桥法的注意事项
1.双线桥法
(1)箭头、箭尾必须对应化合价变化的同种元素;
(2)必须注明“得”“失”;
(3)氧化剂和还原剂得、失电子要守恒。
2.单线桥法
(1)不需要标明“得到”或“失去”,只标明电子转移数目;
(2)要用箭头标明电子转移的方向;
(3)箭头由反应物中失电子元素原子指向得电子元素原子。
1.下列反应中,电子转移的方向和数目正确的是( )
A.
C.
B.
解析:B Fe元素失去电子,氯元素得到电子,箭头从氯化亚铁中Fe元素指向氯气,A项错误;过氧化氢分解时,部分氧元素失去电子化合价升高被氧化为氧气,部分氧元素得到电子化合价降低被还原为H2O,反应中转移2e-,电子转移方向和数目表示正确,B项正确;碳元素失去4e-化合价升高,氧元素得到4e-化合价降低,得失标注及电子数目均错误,C项错误;钠元素失去电子,氯元素得到电子,箭头从金属钠指向氯气,D项错误。
2.标出变价元素的化合价,用双线桥法标出电子转移情况。
(1)4P+5O2 2P2O5
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)Cl2+2NaOHNaCl+NaClO+H2O
答案:(1)
1.古诗词是古人为我们留下的宝贵精神财富,是中华民族传统文化精髓。下列古诗词或古文记载中涉及化学变化但不属于氧化还原反应的是( )
A.熬胆矾铁釜,久之亦化为铜
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.千淘万漉虽辛苦,吹尽狂沙始到金
D.粉身碎骨浑不怕,要留清白在人间
解析:D A项,该过程中铁置换出铜是氧化还原反应;B项,石蜡燃烧属于氧化还原反应;C项,利用金密度大的特点进行淘金,没有发生化学变化,是物理变化;D项,石灰石煅烧分解得到氧化钙和二氧化碳,属于化学反应,元素化合价不发生变化,不属于氧化还原反应。
2.下列过程中硫元素被还原的是( )
A.Na2S→H2S B.H2S→S
C.S→SO2 D.H2SO4→SO2
解析:D Na2S→H2S中硫元素始终为-2价,A不符合;H2S→S,硫元素化合价从-2价升高到0价,被氧化,B不符合;S→SO2,硫元素化合价从0价升高到+4价,被氧化,C不符合;H2SO4→SO2,硫元素化合价从+6价降低到+4价,被还原,D符合。
3.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4FeSO4+Cu
B.3CO+Fe2O3 2Fe+3CO2
C.AgNO3+NaClAgCl↓+NaNO3
D.2KMnO4K2MnO4+MnO2+O2↑
解析:B 反应3CO+Fe2O3 2Fe+3CO2不属于任何一种基本反应类型,但由于在反应过程中有元素化合价发生了变化,因此反应属于氧化还原反应,B符合题意。
4.油画修复涉及的反应之一为PbS+4H2O2PbSO4+4H2O。下列关于该反应的说法正确的是( )
A.PbS被还原
B.H2O2为氧化剂
C.属于复分解反应
D.PbSO4中S元素的化合价为+4价
解析:B PbS中S元素化合价从-2价升高到+6价,失去电子,被氧化,A、D错误;H2O2中氧元素化合价从-1价降低到-2价,得到电子,为氧化剂,B正确;该反应是氧化还原反应,不属于复分解反应,C错误。
5.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是 ,被还原的元素是 ,发生氧化反应的物质是 ,发生还原反应的物质是 。
(2)用双线桥法表示反应电子得、失的方向和数目:
。
(3)用单线桥法表示反应电子得、失的方向和数目:
。
解析:由化学方程式可知铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,HNO3发生还原反应。
答案:(1)Cu N Cu HNO3
氧化还原反应
学习目标:
1.认识有化合价变化的反应是氧化还原反应。
2.了解氧化还原反应的本质是电子转移。
1.从得失氧的角度认识氧化还原反应
(1)从得失氧的角度分析以下反应。
2CuO+C 2Cu+CO2↑;
Fe2O3+3CO 2Fe+3CO2
分点突破(一) 氧化还原反应的基本概念
(2)结论:在化学反应中,一种物质得到氧发生 氧化 反应,必然有一种物质失去氧发生 还原 反应,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为 氧化还原 反应。
物质 反应物 发生的反应
(氧化反应或还原反应)
得氧物质 C、CO 氧化反应
失氧物质 CuO、Fe2O3 还原反应
C、CO
氧化反应
CuO、Fe2O3
氧化
还原
氧化还原
2.从元素化合价升降的角度认识氧化还原反应
(1)有氧元素参加的反应:2CuO+C 2Cu+CO2↑。
①铜元素化合价 降低 ,发生 还原 反应。
②碳元素化合价 升高 ,发生 氧化 反应。
降低
还原
升高
氧化
(2)没有氧元素参加的反应:Fe+CuSO4FeSO4+Cu。
①铜元素化合价 降低 ,发生 还原 反应。
②铁元素化合价 升高 ,发生 氧化 反应。
降低
还原
升高
氧化
(3)结论:凡是有元素化合价 升降 的反应,都是氧化还原反应。所含元素化合价升高的物质,发生 氧化 反应;所含元素化合价降低的物质,发生 还原 反应。
升降
氧化
还原
3.从电子转移角度认识氧化还原反应
化学反应
氧化反应 Na→NaCl H2→HCl
Na原子 失去 电子 共用电子对偏离 H原子
还原反应 Cl2→NaCl Cl2→HCl
Cl原子 得到 电子 共用电子对偏向 Cl原子
结论 凡是有电子转移(得失或偏移)的化学反应都是氧化还原反应。失去电子(或电子对偏离)发生 氧化 反应;得到电子(或电子对偏向)发生 还原 反应
失去
H原子
得到
Cl原子
氧化
还原
4.氧化还原反应的本质与特征
1.标出下列加点元素的化合价。
(1)O NaH.
提示:(1)+1 -1
(2)CuO. H2
提示:(2)-2 -1
(3)K2S. S.O2 Na2S.O3 NaHS.O3 H2S.O4
提示:(3)-2 +4 +4 +4 +6
(4)N.H3 H4 N.O N.O2 NaN.O2 NaN.O3
提示:(4)-3 -2 +2 +4 +3 +5
(5)
提示:(5)+6 +6
(6) O2
提示:(6)+7 +6 +4
2.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可以分为氧化还原反应和非氧化还原反应。回答下列问题:
①CO2+C2CO
②2Fe+3Cl22FeCl3
③C+H2O(g)CO+H2
④2H2O 2H2↑+O2↑
⑤Na2SO4+BaCl22NaCl+BaSO4↓
⑥H2O2+H2SS↓+2H2O
(1)既是氧化还原反应又是化合反应的为 (填序号,下同)。
提示:(1)①②
(2)属于非氧化还原反应的为 。
提示:(2)⑤
(3)不属于四种基本反应类型的为 。
提示:(3)⑥
(4)属于置换反应的为 。
提示:(4)③
1.氧化还原反应中易错点
(1)在氧化还原反应中,并不是所有元素的化合价都发生改变,故不一定所有的元素都发生氧化还原反应。如反应Fe+CuSO4Cu+FeSO4中,Fe、Cu元素的化合价变化,S、O元素的化合价不变。
(2)在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原。如反应Cl2+H2OHCl+HClO中,被氧化和被还原的元素都是氯元素。
(3)元素由化合态(化合物)转变为游离态(单质)可能被氧化,也可能被还原。如反应2H2O 2H2↑+O2↑中,H元素被还原,O元素被氧化。
2.氧化还原反应与四种基本反应类型的关系
1.下列变化中,未涉及氧化还原反应的是( )
A.钟乳石的形成 B.氢气的燃烧
C.菜刀生锈 D.高锰酸钾制氧气
解析:A 钟乳石的形成过程中为碳酸钙和二氧化碳、水的反应,在物质变化过程中元素化合价不发生变化,因此不涉及氧化还原反应,A符合题意。
2.下列有关氧化还原反应的叙述正确的是( )
A.有单质参加或生成的化学反应一定是氧化还原反应
B.有单质生成的分解反应属于氧化还原反应,因为组成该单质的元素的化合价必然发生变化
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子对偏离
D.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
解析:B 有电子转移的反应是氧化还原反应,有单质参加或生成的化学反应不一定是氧化还原反应,如同素异形体之间的转化就不是氧化还原反应,A错误;有单质生成的分解反应,元素的化合价发生了变化,因此一定属于氧化还原反应,B正确;被氧化的物质失去电子或电子对偏离,被还原的物质得到电子或电子对偏向,C错误;氧化还原反应中一种元素被氧化的同时,该元素可能也被还原,D错误。
3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于氧化还原反应但不包含在1、2、3、4范围内的是( )
A.Cl2+2KII2+2KCl
B.NH4HCO3NH3↑+CO2↑+H2O
C.2FeCl2+Cl22FeCl3
D.3NO2+H2O2HNO3+NO
解析:D A项,属于置换反应,也属于氧化还原反应;B项,属于分解反应,不属于氧化还原反应;C项,属于化合反应,属于氧化还原反应;D项,属于氧化还原反应但不包含在1、2、3、4范围内。
4.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
A. SO2 +2NaOHNa2SO3+H2O
B.2 CuO +C 2Cu+CO2↑
C.2FeCl3+ Fe 3FeCl2
D.Zn+2 HCl ZnCl2+H2↑
解析:C 该反应不是氧化还原反应,A错误;铜元素由+2价降到0价,发生还原反应,B错误;FeFeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;氢元素由+1价降到0价,发生还原反应,D错误。
SO2
CuO
Fe
HCl
分点突破(二) 电子转移的表示方法及氧化还原反应与反应类型的关系
1.双线桥法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
基本步骤
2.单线桥法
表示反应过程中不同元素原子间的电子转移情况。
基本步骤
使用双线桥法和单线桥法的注意事项
1.双线桥法
(1)箭头、箭尾必须对应化合价变化的同种元素;
(2)必须注明“得”“失”;
(3)氧化剂和还原剂得、失电子要守恒。
2.单线桥法
(1)不需要标明“得到”或“失去”,只标明电子转移数目;
(2)要用箭头标明电子转移的方向;
(3)箭头由反应物中失电子元素原子指向得电子元素原子。
1.下列反应中,电子转移的方向和数目正确的是( )
A.
C.
B.
解析:B Fe元素失去电子,氯元素得到电子,箭头从氯化亚铁中Fe元素指向氯气,A项错误;过氧化氢分解时,部分氧元素失去电子化合价升高被氧化为氧气,部分氧元素得到电子化合价降低被还原为H2O,反应中转移2e-,电子转移方向和数目表示正确,B项正确;碳元素失去4e-化合价升高,氧元素得到4e-化合价降低,得失标注及电子数目均错误,C项错误;钠元素失去电子,氯元素得到电子,箭头从金属钠指向氯气,D项错误。
2.标出变价元素的化合价,用双线桥法标出电子转移情况。
(1)4P+5O2 2P2O5
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)Cl2+2NaOHNaCl+NaClO+H2O
答案:(1)
1.古诗词是古人为我们留下的宝贵精神财富,是中华民族传统文化精髓。下列古诗词或古文记载中涉及化学变化但不属于氧化还原反应的是( )
A.熬胆矾铁釜,久之亦化为铜
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.千淘万漉虽辛苦,吹尽狂沙始到金
D.粉身碎骨浑不怕,要留清白在人间
解析:D A项,该过程中铁置换出铜是氧化还原反应;B项,石蜡燃烧属于氧化还原反应;C项,利用金密度大的特点进行淘金,没有发生化学变化,是物理变化;D项,石灰石煅烧分解得到氧化钙和二氧化碳,属于化学反应,元素化合价不发生变化,不属于氧化还原反应。
2.下列过程中硫元素被还原的是( )
A.Na2S→H2S B.H2S→S
C.S→SO2 D.H2SO4→SO2
解析:D Na2S→H2S中硫元素始终为-2价,A不符合;H2S→S,硫元素化合价从-2价升高到0价,被氧化,B不符合;S→SO2,硫元素化合价从0价升高到+4价,被氧化,C不符合;H2SO4→SO2,硫元素化合价从+6价降低到+4价,被还原,D符合。
3.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4FeSO4+Cu
B.3CO+Fe2O3 2Fe+3CO2
C.AgNO3+NaClAgCl↓+NaNO3
D.2KMnO4K2MnO4+MnO2+O2↑
解析:B 反应3CO+Fe2O3 2Fe+3CO2不属于任何一种基本反应类型,但由于在反应过程中有元素化合价发生了变化,因此反应属于氧化还原反应,B符合题意。
4.油画修复涉及的反应之一为PbS+4H2O2PbSO4+4H2O。下列关于该反应的说法正确的是( )
A.PbS被还原
B.H2O2为氧化剂
C.属于复分解反应
D.PbSO4中S元素的化合价为+4价
解析:B PbS中S元素化合价从-2价升高到+6价,失去电子,被氧化,A、D错误;H2O2中氧元素化合价从-1价降低到-2价,得到电子,为氧化剂,B正确;该反应是氧化还原反应,不属于复分解反应,C错误。
5.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是 ,被还原的元素是 ,发生氧化反应的物质是 ,发生还原反应的物质是 。
(2)用双线桥法表示反应电子得、失的方向和数目:
。
(3)用单线桥法表示反应电子得、失的方向和数目:
。
解析:由化学方程式可知铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,HNO3发生还原反应。
答案:(1)Cu N Cu HNO3
