苏教版(2019) 高中化学选择性必修3 1.2.2有机化合物组成的研究同步练习(含解析)
文档属性
| 名称 | 苏教版(2019) 高中化学选择性必修3 1.2.2有机化合物组成的研究同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1007.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
1.2.2有机化合物组成的研究同步练习-苏教版高中化学选择性必修3
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.常用燃烧法测定有机物的组成。现取3.2克某有机物在足量的氧气中充分燃烧,生成4.4克CO2和3.6克H2O,则该有机物中
A.一定含有C、H两种元素,可能含有O元素 B.一定含有C、H、O三种元素
C.一定含有C、O两种元素,可能含有H元素 D.只含有C、H两种元素,不含O元素
2.下列关于组成表示为CxHy的烷、烯、炔烃的说法不正确的是
A.当 x≤4时,常温常压下均为气体
B.y一定是偶数
C.分别完全燃烧1mol,耗 O2为 (x+y/4)mol
D.在密闭容器中完全燃烧,120℃时测得的压强一定比燃烧前大
3.由乙炔、苯和乙醛组成的混合蒸气,经测定其中碳元素的质量分数为60%,则混合气体中氧元素的质量分数为
A.31.11% B.33.00% C.26.67% D.14.22%
4.X的相对分子质量为100,将10.0gX在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。该有机物X的分子式为
A.C6H12O B.C5H8O2 C.C7H16 D.CaCO3
5.常温常压下,20 mL某气态烃和100 mL氧气混合,完全燃烧后恢复到原来的温度和压强,体积变为70 mL,则该烃可能为
A.CH4 B.C2H6 C.C4H6 D.C6H6
6.探究甲烷的还原性并检验产物的实验设计如图。下列说法错误的是
A.D中可用无水硫酸铜
B.先通足量的甲烷气体,后点燃C处酒精灯
C.若D中盛装碱石灰,根据其质量变化可以推断甲烷组成
D.CH4与CuO的反应为:4CuO+CH44Cu+CO2+2H2O
7.某无色气体可能含有甲烷、一氧化碳、氢气中的一种或几种,依次进行下列实验(假设每步反应或吸收均完全):①无色气体在足量氧气中燃烧;②燃烧生成的气体通过盛有浓硫酸的洗气瓶,装置增重3.6克;③再将剩余气体通过盛有氢氧化钠溶液的洗气瓶,装置增重4. 4克。下列推断正确的是
A.该气体可能只含有一氧化碳、氢气
B.该气体可能只含有甲烷、一氧化碳
C.该气体一定只含有甲烷
D.该气体一定只含有甲烷、氢气
8.1831年李比希提出了确定有机物中氢和碳的质量分数的方法,其基本原理是在高温下氧化有机物,其生成物质主要是
A.CO和H2O B.CO和H2 C.CO2和H2O D.CO2和H2
9.0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是
A.该化合物的相对分子质量是62
B.该化合物的化学式为C2H6O2
C.1 mol该化合物能与2 mol O2发生催化氧化反应
D.1 mol该有机物最多能与2 mol Na反应
10.下列表示正确的是
A.乙炔的结构式:CHCH
B.异戊烷,又称为2-甲基戊烷,其键线式为:
C.葡萄糖的结构简式可能为:
D.NCl3分子的球棍模型
二、填空题
11.已知A为烃,B为烃的含氧衍生物,由等物质的量的A、B组成的混合物0.05mol在0.125mol的氧气中恰好完全燃烧,生成0.1mol的CO2和0.1molH2O,且A与B具有相同的碳原子数。
(1)A、B可能的分子组成(任写两种组合) 、 。
(2)请写出简要的推断过程 。
12.回答下列问题:
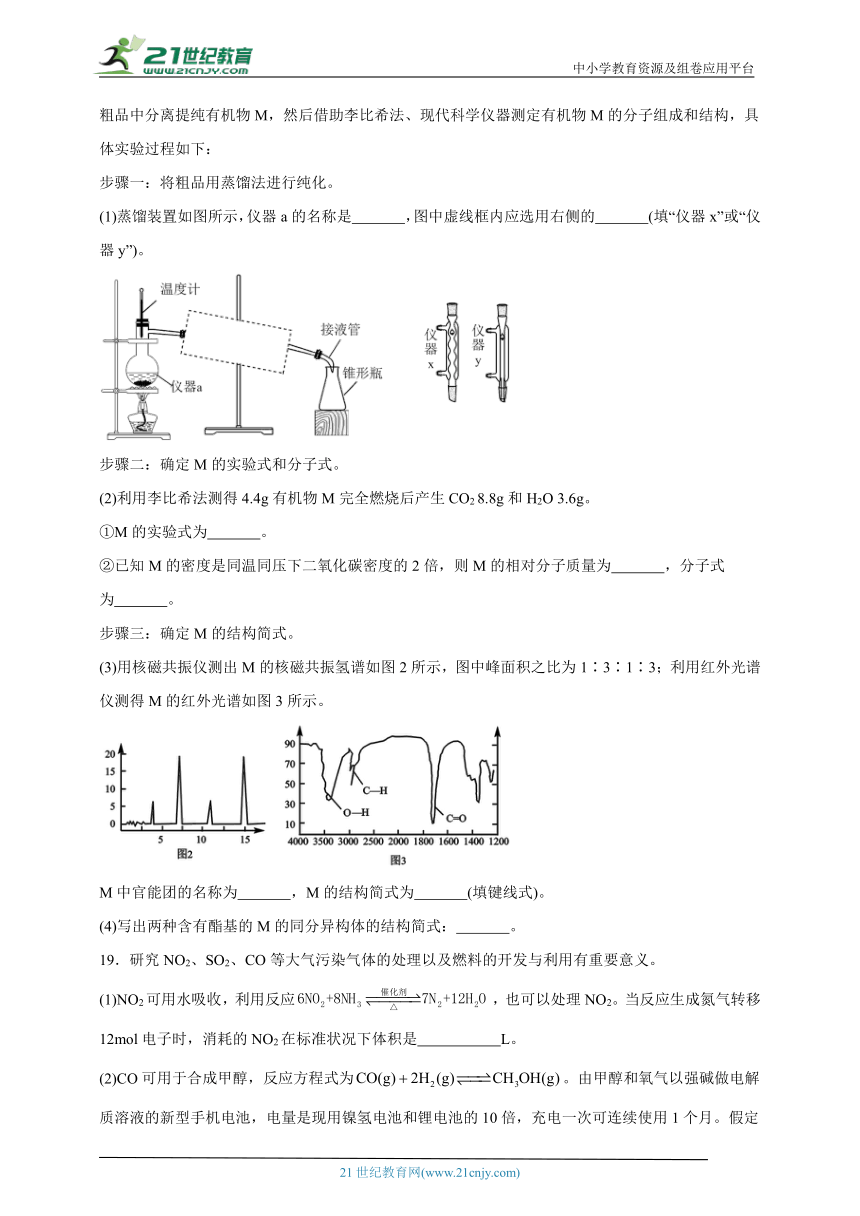
(1)有机物A的质谱图和红外光谱图分别如下:
①A的结构简式为 。
②写出属于醇类,与A互为同分异构体的结构简式: 。
(2)相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成和。经分析,其含氧元素的质量分数为37.21%。经核磁共振仪检测发现B的氢谱如下:
B的结构简式为 。
13.苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒.降脂等药效,主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=35.82%,w(H)=4.48%;②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出33.6 L H2(气体体积均已折算为标准状况);③该分子中存在四种化学环境不同的碳原子,氢原子处于五种不同的化学环境。回答下列问题:
⑴苹果酸的分子式为 ,分子中有 个羧基。
⑵写出苹果酸的结构简式 。
⑶苹果酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式): 、 。
14.已知A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05 mol在0.125 mol的氧气中恰好完全燃烧,生成0.1 mol的CO2和0.1 mol H2O。另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定。则:
(1)若耗氧量一定,则A和B的分子式分别为:A ;B 。
(2)若生成的CO2和H2O的物质的量一定,则A和B的分子式为:A ;B 。
15.1.
(1)有两种气态烷烃的混合物,在标准状况下密度为1.16g·L-1,则下列关于此混合物组成中一定含有的烃是的化学式是 。该烃和氯气在光照下反应生成的有机物共有 种,其中 (填写化学式)在常温下呈气态。
(2)燃烧法是测定有机化合物分子式的一种重要方法。完全燃烧0.1mol某烃后,将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0g,再将剩余气体通过澄清石灰水,生成沉淀40g。据此求烃的分子式 ,并写出该烃可能的结构简式 。
16.在标准状况下,1.68L仅由C、H两种元素组成的某气体质量为1.2g,在25℃和101kPa下完全燃烧生成(g)和(l)时,放出66.77kJ的热量。
(1)该气体的分子式为 。
(2)表示该气体燃烧热的热化学方程式为 。
17.将含有C、H、O三种元素的有机物3.24g装入元素分析装置,通入足量的O2使其完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B,测得A管质量增加了2.16g,B管质量增加了9.24g,已知该有机物的相对分子质量为108,试计算:
(1)该化合物3.24g消耗氧气的质量是 。
(2)通过计算写出该化合物的分子式 。
(3)该化合物的能与烧碱反应,且苯环上的一溴代物只有二种。试写出该有机物的结构简式 。
18.有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)蒸馏装置如图所示,仪器a的名称是 ,图中虚线框内应选用右侧的 (填“仪器x”或“仪器y”)。
步骤二:确定M的实验式和分子式。
(2)利用李比希法测得4.4g有机物M完全燃烧后产生CO2 8.8g和H2O 3.6g。
①M的实验式为 。
②已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为 ,分子式为 。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。
M中官能团的名称为 ,M的结构简式为 (填键线式)。
(4)写出两种含有酯基的M的同分异构体的结构简式: 。
19.研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应,也可以处理NO2。当反应生成氮气转移12mol电子时,消耗的NO2在标准状况下体积是 L。
(2)CO可用于合成甲醇,反应方程式为。由甲醇和氧气以强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,充电一次可连续使用1个月。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成。
①该电池反应的总离子方程式为 。
②甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填降低或上升、不变)。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体(水为气体)混合物通过足量的碱石灰,碱石灰增重4.08g。又知生成CO2和H2O的物质的量之比为3:4,则M中碳、氢、氧原子个数之比为 。
20.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJ mol-1·····①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少? (设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格c(H2) ,v(正) v(逆)。
容器编号 c(H2O)/mol·L-1 c(CO)/mol·L-1 c(H2)/mol·L-1 v正、v逆比较
I 0.06 0.60 0.10 v正=v逆
II 0.12 0.20 ________ v正=v逆
III 0.10 0.20 0.40 v正____v逆
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
三、实验题
21.下图是丁烷裂解的实验流程:(提示:丁烷在一定条件下裂解的可能方程式为:
C4H10C2H6+C2H4, C4H10 CH4+C3H6)
连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…‥
(1)这三步操作的先后顺序依次是 ;
(2)简要说明排空气的方法 。
(3)写出甲烷与氧化铜反应的化学方程式
(4)若对E装置中的混合物(溴水足量),再按以下流程实验:
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ Ⅱ ,Na2SO3溶液的作用是(用离子方程式表示) .
②已知B的碳原子数大于A的碳原子数请写出B的结构简式 .
(5)假定丁烷完全裂解当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) = (假定流经D、G装置中的气体能完全反应)
22.实验室可以采用下列实验装置来测定某种氨基酸的分子式:
取7.5 g该种氨基酸样品,放在纯氧中充分燃烧,生成CO2、H2O和N2,请回答有关问题:
(1)E装置的作用是
(2)需要加热的装置是 (填字母代号)。
(3)装置D的作用是 。
(4)F处读数时应该注意: 、 。
(5)若B装置增重4.5g,C装置增重8.8g,产生的N2在标准状况下的体积为1.12L,则该氨基酸的分子式为
23.2017年1月9日,中国中医科学院青蒿家专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青蒿中提取青蒿素,并设计实验测定青蒿素的分子结构。
(1)青蒿素的提取
从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
已知:乙醚沸点为35℃。
①操作I的名称为 。
②操作III的主要过程可能是 。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如下:
①产生的氧气按以左到右流向,所选装置各导管的连接顺序是g→c→ →盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是 。
③E装置中CuO的作用是 。
④称取28.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66g,C装置质量增加19.8g,则该有机物的最简式为 。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会 (填“偏大”。“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要调定的物理量为 。
⑦将青蒿素加入滴有酚酞NaOH溶液中,溶液颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与 (填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
参考答案:
1.B
【详解】4.4gCO2中C原子的质量为,3.6gH2O中H原子的质量为,所以C和H的总质量为1.2g+0.4g=1.6g,故一定还含有O元素。
故选B。
2.D
【详解】A.常温下,碳原子数≤4的烃呈气态,A项正确;
B.烷烃的通式是、烯烃的通式是、炔烃的通式是,所以CxHy的烷烃、烯烃、炔烃,y一定为偶数,B项正确;
C.烃燃烧的通式是,燃烧1mol CxHy时,消耗氧气(x+)mol,C项正确;
D.在密闭容器中完全燃烧,120℃时测定压强,若y>4,燃烧后压强增大;若y=4,燃烧前后压强不变,若y<4,燃烧后压强减小,D项错误;
答案选D。
3.A
【详解】由乙炔、苯的最简式均为CH,乙醛可写成C2H2 H2O,故出了H2O之外,最简式均为CH,故出H2O之外碳、氢的质量比为12:1,故经测定其中碳元素的质量分数为60%,则H%为5%,故H2O的百分含量为100%-60%-5%=35%,由H2O中H和O的质量比为1:8,故混合气体中氧元素的质量分数为31.11%,故答案为:A。
4.B
【详解】无水CaCl2增重的7.2g是水的质量,10.0gX中氢元素的物质的量为=0.8 mol, KOH浓溶液增重的22.0g是二氧化碳的质量,10.0gX中碳元素的物质的量为=0.5mol,根据质量守恒,氧元素的质量为10.0g-0.8 mol ×1 g/ mol-0.5 mol ×12 g/ mol=3.2 g.则氧元素的物质的量为=0.2 mol,则该分子中碳、氢、氧原子的个数之比为0.5 mol : 0.8 mol: 0.2 mol=5 : 8 : 2,结合X的相对分子质量可知,有机物X的分子式为C5H8O2;
故选B。
5.B
【详解】假设烃的分子式为CxHy,则根据差量法可知:,当O2过量时,则有,解得y=6,且x+0.25y小于5,即x小于3.5,则该烃为C2H6,当氧气不足时,将生成CO2和CO的混合气体,则无法计算,故答案为:B。
6.C
【分析】由题给装置图可知,探究甲烷的还原性并检验产物时应先通足量的甲烷气体排尽装置中的空气,然后点燃C除的酒精灯,D中盛有的无水硫酸铜用于检验水的生成,装置E中澄清石灰水用于测量二氧化碳的质量,装置F为处理未反应甲烷的尾气处理装置。
【详解】A.由分析可知,D中盛有的无水硫酸铜用于检验水的生成,故A正确;
B.甲烷是可燃性气体,为防止甲烷与空气混合受热发生爆炸,实验前应先通足量的甲烷气体排尽装置中的空气,故B正确;
C.若D中盛装碱石灰,碱石灰会吸收反应生成的二氧化碳和水,无法测定反应生成二氧化碳和水的质量,不能根据其质量变化可以推断甲烷组成,故C错误;
D.由题给装置图可知,甲烷在加热条件下与氧化铜反应生成铜、二氧化碳和水,反应的化学方程式为4CuO+CH44Cu+CO2+2H2O,故D正确;
故选C。
7.A
【详解】生成的气体通过浓硫酸,装置质量增加3.6g,由此可判断燃烧生成了3.6g水,说明混合气体中含氢元素,且氢元素质量=;气体通过氢氧化钠溶液,装置质量增加4.4g,可判断燃烧生成了4.4g二氧化碳,说明混合气体中含碳元素,且碳元素质量=;甲烷气体中C、H元素质量比=,则混合气体中C、H元素质量比=1.2g:0.4g=3:1,由此可判断混合气体可能只有甲烷,也可能只含有CO和H2,也可能是甲烷、氢气、一氧化碳同时存在,不可能含有甲烷和另外任何一种气体,所以A正确,BCD错误,故选A。
8.C
【详解】李比希法是将有机物充分燃烧,通过测定生成的CO2和H2O的质量来确定有机物中的碳氢的质量分数。答案选C。
9.C
【详解】有机物燃烧生成水10.8g,物质的量为:10.8g÷18g/mol=0.6mol,设有机物燃烧生成的CO为x,则:CuO+COCu+CO2 固体减少△m
28g 16g
x 3.2g
所以x==5.6g,CO的物质的量为:5.6g÷28g/mol=0.2mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g,有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为:8.8g÷44g/mol=0.2mol,根据碳元素守恒可知,1mol有机物含有碳原子物质的量为2mol,根据氢元素守恒可知,1mol有机物含有氢原子物质的量为:=6mol,根据氧元素守恒可知,1mol有机物含有氧原子物质的量为:=2mol,所以有机物的分子式为C2H6O2,0.1mol该有机物恰好与4.6g金属钠完全反应,4.6gNa的物质的量=4.6g÷23g/mol=0.2mol,有机物与Na按物质的量之比1:2反应,有机物分子中含有羟2个-OH,该有机物的结构简式为:HOCH2CH2OH。
A.有机物的分子式为C2H6O2,相对分子质量为62,A正确;
B.由上述分析可知,有机物的分子式为C2H6O2,B正确;
C.该有机物的结构简式为:HOCH2CH2OH,1 mol该化合物能与1 mol O2发生催化氧化反应,C错误;
D.0.1mol该有机物恰好与4.6g金属钠完全反应,4.6gNa的物质的量=4.6g÷23g/mol=0.2mol,有机物与Na按物质的量之比1:2反应,即1 mol该有机物最多能与2 mol Na反应,D正确,
答案选C。
10.C
【详解】A.乙炔的结构式为H—C≡C—H,选项A错误;
B.异戊烷分子中最长碳链含有4个碳原子,侧链为甲基,又称为2—甲基丁烷,选项B错误;
C.葡萄糖的结构简式为HOCH2 (CHOH)4CHO,分子中的HOCH2—能与—CHO发生加成反应转化为,选项C正确;
D.Cl原子的半径大于N原子半径,NCl3分子的球棍模型是 ,选项D正确;
答案选C。
11.(1) C2H2和C2H6O2 C2H4和C2H4O2(或C2H6和C2H2O2)
(2)依据题中燃烧反应数据可知:1mol混合物+2.5molO2→2molCO2+2molH2O,从质量守恒的角度可知混合物平均分子式为C2H4O,而A、B等物质的量,A为烃、B为烃的含氧衍生物,A、B具有相同碳原子数,则A、B各含两个碳原子,A、B的组合可以为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2
【分析】依据题中燃烧反应数据可知:1mol混合物+2.5molO2→2molCO2+2molH2O,从质量守恒的角度可知混合物平均分子式为C2H4O,由于A为烃、B为烃的含氧衍生物,A和B等物质的量,且A与B具有相同的碳原子数,则A和B的碳原子数均为2,A、B的组合可以为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2。
(1)
由分析可知,A、B可能的分子组成为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2。
(2)
依据题中燃烧反应数据可知:1mol混合物+2.5molO2→2molCO2+2molH2O,从质量守恒的角度可知混合物平均分子式为C2H4O,而A、B等物质的量,A为烃、B为烃的含氧衍生物,A、B具有相同碳原子数,则A、B各含两个碳原子,A、B的组合可以为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2。
12.(1) 、、、
(2)
【详解】(1)①质谱图中,质荷比的最大值表示样品的相对分子质量,故A的相对分子质量为74,由红外光谱图能够推断出A中含有对称的与和醚键,所以A为;
②由于有4种结构,故A属于醇类的同分异构体有4种;
(2)B能与金属钠反应产生无色气体,也能与碳酸钠反应产生无色气体,说明B中至少含有一个羧基,同时还可能含有羟基等。B中含氧元素的质量分数为37.21%,若每个B分子中含有2个氧原子,则B的相对分子质量为86;若每个B分子中含有3个氧原子,则B的相对分子质量为129,大于100,不符合要求,所以每个B分子中只含有一个羧基。又因为B可以使溴的四氯化碳溶液褪色,所以B还含有碳碳不饱和键,再结合核磁共振氢谱图显示B中含有三种等效氢原子且个数比为1:2:3,可以推断其结构简式为。
13. C4H6O5 2
【分析】苹果酸分子中w(C)=35.82%,w(H)=4.48%,则O的质量分数为1-35.82%-4.48%=59.7%,相对分子质量不超过150,则O原子最大数目==5.6,1 mol苹果酸与足量的NaHCO3反应放出44.8 L CO2,二氧化碳物质的量为2 mol,说明分子中含有2个羧基,与足量的Na反应放出33.6 L H2,生成氢气为1.5 mol,含有2 mol羧基只能生成1 mol氢气,故分子中还含有1个羟基,综上所述苹果酸分子含有5个O原子,则苹果酸的相对分子质量==134,则分子中C原子数目==4,H原子数目==6,则分子式为C4H6O5;分子式为C4H6O5且分子中含有2个羧基、1个羟基的结构简式可能为:、、;据此分析解答。
【详解】(1)通过分析可知,苹果酸的分子式为C4H6O5;该分子中含有2个羧基。
(2)苹果酸分子式为C4H6O5,该分子中存在四种化学环境不同的碳原子,氢原子处于五种不同的化学环境,则苹果酸的结构简式为:;
(3)通过分析,苹果酸的同分异构体中,符合上述①、②两个条件,即分子式为C4H6O5且分子中含有2个羧基、1个羟基的结构简式有:、。
14.(1) C2H2 C2H6O2
(2) C2H4 C2H4O2
【分析】(1)
已知A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05 mol在0.125 mol的氧气中恰好完全燃烧,生成 0.1 mol的CO2和0.1 mol H2O,则平均组成为 C2H4O,因为A为烃,B为烃的含氧衍生物,则B中必含2个O原子,将其以任意物质的量比混合,且物质的量之和一定时,两者碳原子数均为2,应为C2H2和C2H6O2,因此,本题正确答案是:C2H2;C2H6O2;
(2)
若生成的CO2和H2O的物质的量一定,则两种物质中含有的C和H原子数相同,应为CH2=CH2和CH3COOH,因此,本题正确答案是:C2H4;CH3COOH。
15.(1) CH4 4 CH3Cl
(2) C4H10 CH3CH2CH2CH3和CH3CH(CH3)2
【详解】(1)有两种气态烷烃的混合物,在标准状况下密度为1.16g L﹣1,该混合烃的平均摩尔质量为1.16g/L×22.4L/mol=26g/mol,即平均相对分子质量为26,相对分子质量小于26的烷烃是甲烷,其相对分子质量为16,其它烷烃相对分子质量都大于26,所以混合物中一定有甲烷,化学式为CH4,该烃和氯气在光照下反应生成的有机物一氯甲烷、二氯甲烷、三氯甲烷以及四氯化碳共4种,其中CH3Cl为气体;
故答案为:CH4;4;CH3Cl;
(2)将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0g,为水的质量,且n(H2O)= =0.5mol,n(H)=1mol,再将剩余气体通过澄清石灰水,生成沉淀40g,生成沉淀为碳酸钙,可知n(CO2)=n(CaCO3)= =0.4mol,可知1mol有机物含有4molC、10molH,则分子式为C4H10,为丁烷,可能的结构简式为CH3CH2CH2CH3和CH3CH(CH3)2;
故答案为:烃的分子式为C4H10;可能的结构简式为 CH3CH2CH2CH3和CH3CH(CH3)2。
16.(1)CH4
(2)
【解析】(1)
在标准状况下,1.68L气体的物质的量是,质量为1.2g,则其摩尔质量是,其相对分子质量为16,仅由C、H两种元素组成,则其分子式为CH4;
(2)
根据题意结合第(1)题的分析,得知0.075mol的CH4在25℃和101kPa下完全燃烧生成(g)和(l)时,放出66.77kJ的热量,则1molCH4在25℃和101kPa下完全燃烧生成(g)和(l)时,放出的的热量,故表示该气体燃烧热的热化学方程式为: 。
17.(1)8.16g
(2)C7H8O
(3)
【详解】(1)A管质量增加了2.16g为生成水的质量,B管增加了9.24g为生成二氧化碳的质量,根据质量守恒可知,消耗氧气的质量为2.16g+9.24g-3.24g=8.16g;
(2)2.16g水的物质的量为:=0.12mol,n(H)=0.24mol,
9.24g二氧化碳的物质的量==0.21mol,n(C)=0.21mol,
8.16g氧气的物质的量为:=0.255mol,
3.24g有机物中n(O)=0.21mol×2+0.12mol-0.255mol×2=0.03mol,
3.24g有机物中C、H、O原子物质的量之比=0.21mol:0.24mol:0.03mol=7:8:1,
故该有机物最简式为C7H8O,有机物的相对分子质量为108,而最简式C7H8O的式量=12×7+8+16=108,故最简式即为分子式,即有机物分子式为:C7H8O;
(3)该化合物的分子式为C7H8O,能与烧碱反应,表明分子中含有羧基或酚羟基,苯环上的一溴代物只有二种,则该有机物可能的结构简式为。
18.(1) 蒸馏烧瓶 仪器y
(2) C2H4O 88 C4H8O2
(3) 羟基、羰基
(4)HCOOCH(CH3)2、HCOOCH2CH2CH3、CH3COOCH2CH3、CH3CH2COOCH3任选两个;
【详解】(1)蒸馏装置中,仪器a的名称是蒸馏烧瓶,图中虚线框内的仪器是斜放的冷凝管,为了防止液体残留,便于冷凝导气,应选用右侧的仪器y,故答案是蒸馏烧瓶;仪器y;
(2)①由题目可知,8.8g CO2 含碳元素的质量是2.4g,3.6g H2O中含氢元素质量是0.4g,根据反应中元素守恒,4.4g有机物M含碳元素的质量是2.4g,含氢元素质量是0.4g,含氧元素的质量是1.6g,则有机物M中分子C、H、O原子个数比为,则有机物M的实验式是C2H4O,故答案是C2H4O;
②由pV=nRT得,同温同压下气体密度与气体的摩尔质量成正比。已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为2×44=88,则由实验式计算,(C2H4O)n的相对原子质量是88,则n=2,则有机物M的分子式是C4H8O2,故答案是88;C4H8O2;
(3)由图3的红外光谱仪判断有机物M中含有的官能团是羟基、羧基;由峰面积之比是1∶3∶1∶3可知,M中具有两个甲基,则M的结构简式是CH3CHOHCOCH3,则其键线式是;故答案是羟基、羰基;;
(4)已知题目要求是含有酯基的M的同分异构体,则结构可如下:HCOOCH(CH3)2、HCOOCH2CH2CH3、CH3COOCH2CH3、CH3CH2COOCH3,故答案是HCOOCH(CH3)2、HCOOCH2CH2CH3、CH3COOCH2CH3、CH3CH2COOCH3任选两个;
19. 67.2 2CH3OH+3O2+4OH-=2+6H2O 负 降低 3:8:3
【详解】(1)在反应中,NO2中氮元素的化合价从+4价降低到N2中的0价,1molNO2得到4mol电子,即转移4mol电子,可以处理1molNO2。当反应转移12mol电子时,消耗的NO2的物质的量为3mol,在标准状况下体积是3mol×22.4L/mol=67.2L。
(2)①甲醇和氧气以强碱做电解质溶液的电池,总反应是甲醇和氧气反应,生成碳酸盐和水,离子方程式为:2CH3OH+3O2+4OH-=2+6H2O。
②甲醇失去电子,在负极发生氧化反应。根据总反应式可知,电池在放电过程中消耗OH-,溶液的pH将降低。
(3) 生成CO2和H2O的物质的量之比为3:4,碱石灰增重4.08g即生成的CO2和H2O的总质量是4.08g,设CO2的物质的量为3x,则H2O的物质的量为4x,根据总质量为4.08g,有44×3x+18×4x=4.08,解得x=0.02,则CO2为0.06mol,H2O为0.08mol。0.06molCO2中C的物质的量为0.06mol,质量为0.72g;0.08molH2O中H为0.16mol,质量为0.16g,所以有机物中有氧1.84g-0.72g-0.16g=0.96g,物质的量为0.06mol,所以M中碳、氢、氧原子个数之比为0.06:0.16:0.06=3:8:3。
20.(1)3:5
(2) 0.60 >
(3) C8H10 C8H18 19.875吨
【分析】(1)根据同问同压下气体体积之比等于个数之比,等于物质的量之比计算;
(2)一定温度下,三个容器中均进行着上述反应①,因此三个容器中的平衡常数相等,据此计算;
(3)根据苯的同系物和烷烃的通式计算X,Y的分子式,由O原子守恒可知n(H2O)=n(CO),令X、Y的物质的量分别为xmol、ymol,根据碳原子守恒、H原子守恒列方程,再根据m=nM计算.
【详解】(1)反应①C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJ mol-1②C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1,观察可知反应①×3可得3C(s)+3H2O(g)3CO(g)+3H2(g)△H=+393.9kJ mol-1,为保持生产的连续性,则应保证碳完全燃烧放出的热大于等于生成水煤气吸收的热,即反应①与②按3:1进行反应,即参加反应的n(H2O):n(O2)=3:1,所以体积之比为V(H2O):V(O2)=3:1,若空气中氧气的体积占1/5,则V(H2O):V(空气)=3:5;
(2)容器I中v(正)=v(逆),所以容器I处于化学平衡状态,则平衡常数为K=,相同温度下,容器Ⅱ中v(正)=v(逆),即K=1=,解得c(H2)=0.6;相同温度下,容器Ⅲ中Q=<K=1,则证明反应正向进行,即v(正)>v(逆);
(3)苯的同系物的通式为CnH2n-6,烷烃的通式为CnH2n+2,且X、Y都是有8个碳原子的烃,则X的分子式为C8H10,Y的分子式为C8H18;
50t92%乙醇溶液中含乙醇为50×106g×92%÷46g/mol==1.0×l06mol,根据C原子守恒,得到CO总物质的量n总(CO)=1.0×l06mol×2=2.0×l06mol,按a式得到氢气物质的量=1.0×l06mol×50%×4=2.0×l06mol,按b式反应得到氢气物质的量=1.0×l06mol×50%×3=1.5×l06mol,故n总(H2)=3.5×106mol;合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O,由O原子守恒可知n(H2O)=n(CO),令C8H10、C8H18的物质的量分别为xmol、ymol,根据碳原子守恒,有:8(x+y)=2.0×l06,;根据H原子守恒,有:10x+18y=3.5×106×2-2×2.0×l06,联立方程,解得x=1.875×l05、y=6.25×l04,故X(C8H10)的质量=1.875×l05mol×106g/mol=19.875×l06g=19.875t。
21.(1)②③①
(2)打开K,使丁烷气依次流经各装置
(3)
(4) 分液 蒸馏 CH3CHBrCH2Br
(5)1:1
【分析】打开K,气体通过B,B装置是根据气泡控制气体流速,C装置干燥丁烷,在氧化铝作催化剂条件下丁烷发生裂解反应生成烯烃和烷烃,E中溴水吸收烯烃,F干燥烷烃,G中烷烃和Cu在加热条件下发生氧化还原反应生成Cu。
【详解】(1)先检查气密性,再赶出装置内气体,再给D、G装置加热,故答案是②③①。
(2)打开K,使丁烷气依次流经各装置,从而将空气排出,故答案是:打开K,使丁烷气依次流经各装置。
(3)氧化铝作催化剂,加热条件下,甲烷和氧化铜反应生成二氧化碳、水和铜,反应方程式为。
(4)混合物中含有溴、水、溴代烃,加入亚硫酸钠,亚硫酸钠被溴氧化生成硫酸钠,同时生成NaBr,从而除去溴,然后采用分液方法分离,将有机层进行分馏得到有机物A、有机物B,向有机物中加入NaOH溶液,得到有机物C,C能发生氧化反应,则B发生水解反应生成C为醇,C被催化氧化得到醛D;
①通过以上分析知,分离操作Ⅰ和Ⅱ的名称分别是:分液;蒸馏,亚硫酸钠具有还原性,能和强氧化性物质溴反应而除去溴,离子方程式为,故答案是:分液;蒸馏;;
②已知B的碳原子数大于A的碳原子数,说明B中碳原子个数是3、A中碳原子个数是2,B为1,2—二溴丙烷,B的结构简式,故答案是:。
(5)丁烷的裂解中生成的乙烯和乙烷的物质的量相等,生成的甲烷和丙烯的物质的量相等,E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,设X为C2H4的物质的量,y为C3H6的物质的量,则乙烷和甲烷的物质的量分别是x、y,得28x+42y = 0.7g,乙烷和甲烷和氧化铜反应需要的氧原子的物质的量为
,计算得出:x=y = 0.07mol,故答案为:1: 1。
22.(1)用来排水,以测定氮气的体积
(2)A、D
(3)吸收未反应的氧气
(4) 量筒内的液面与广口瓶内的液面相平 视线与凹液面最低处相切
(5)C2H5O2N
【分析】首先明确该实验的原理,氨基酸的燃烧产物为CO2、H2O和N2,通过浓硫酸吸收生成的水,测出生成水的质量;通过碱石灰吸收CO2并测其质量;过量的O2被Cu网吸收后剩余N2,用排水法测得生成N2的体积。根据,,和m(氨基酸)可求出氨基酸的实验式,再由其相对分子质量可求出其分子式。
(1)
E装置中的水排入F中,可以测定气体的体积,故E装置的作用是:用来排水,以测定氮气的体积;
(2)
氨基酸和氧气反应以及铜与氧气反应都需要加热;在加热时应先点燃D出的酒精灯,吸收为反应的氧气,保证最终收集到的气体为氮气,故答案为:A、D;
(3)
由原理可知,气体进入装置E之前应将氧气除去,所以铜网的作用是吸收为反应完的氧气,以保证最终收集的气体为氮气,故答案为:吸收未反应的氧气;
(4)
装置E和F共同结合在一起来测量气体的体积,读数时必须保证装置内外压强相等,以及装置内的温度应冷却至室温,所以注意事项为:量筒内的液面与广口瓶内的液面相平;视线与凹液面最低处相切;
(5)
根据7.5g样品。测定到其中含水0.25mol,即含氢原子0.5g,0.2mol二氧化碳即含碳为2.4g;氮原子为0.1mol,1.4g,则推算到含有氧原子共3.2g,即0.2mol氧原子;故CHON四种原子的物质的量之比为:2:5:2:1.从而得到分子式为:C2H5O2N。
23. 过滤 B dhifeab(或ba) 除去氧气中的水蒸气 将可能生成的CO氧化为CO2 C15H22O5 偏小 该有机物的相对分子质量 D
【详解】分析:本题考查的是物质的分离、提纯及物质的量有关计算,侧重学生的分析,注意把握物质的性质及分离混合物的实验操作。
详解:(1)①操作I是用于分离固体和液体,则可以用过滤的方法。②依据题干信息分析可知,青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶解,熔点为156~157℃,热稳定性差,乙醚的沸点为35℃,便于除去,A.青蒿素不溶于水,故错误;B. B.加95%的乙醇,浓缩、结晶、过滤可以得到较纯的青蒿素,故正确;C.加入乙醚进行萃取分液得到的还是混合物,故错误。故选B。(2)实验原理是测定一定质量的有机物完全燃烧时生成的二氧化碳和水的质量,来确定是否含氧及碳氢氧的个数比,求出最简式,因此生成氧气后必须除杂,明确各装置的作用是解题的前提。A是用来吸收二氧化碳,测定生成二氧化碳的质量,B用于干燥通入E中的氧气,C用来吸收水,测定生成水的质量,D用来制取反应所需的氧气,E是在电炉中加热时用纯氧气氧化管内样品,根据一氧化碳和氧化铜反应,可被氧化生成二氧化碳的性质可知氧化铜的作用是把有机物不完全燃烧产生的一氧化碳转化为二氧化碳。 ①D中生成的氧气含有水蒸气,应先通过B中的氯化钙吸收,在E中电炉加热时用纯氧气氧化管内样品,生成二氧化碳和水,如果有一氧化碳,则E中的氧化铜可以与一氧化碳进一步反应生成二氧化碳,然后分别通入装有浓硫酸的洗气瓶吸收水,通过装有氢氧化钠溶液的U形管吸收二氧化碳,根据产物的质量推断有机物的组成,所以仪器的接口顺序为dhifeab(或ba);②B装置的作用除去氧气中的水蒸气;③氧化铜将可能生成的CO氧化为CO2;④A管质量增加66克,可得碳元素的质量为=18g,C装置质量增加19.8g,可得氢元素的质量为=2.2g,从而推出含氧元素的质量为28.2-18-2.2=8g,设最简式为CxHyOz,则有x:y:z==15:22:5,最简式为C15H22O5;⑤若把盛有碱石灰的干燥管的装置去掉,则空气中的水和二氧化碳可能进入装置A中,使二氧化碳的质量增加,则氧元素的质量减少,测定氧的质量分数偏小;⑥测定了最简式之后,还需要该有机物的相对分子质量才能确定其分子式;⑦由于酯不溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠,结合题意可知青蒿素中含有酯基,而油脂中也含有酯基,故选D。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
1.2.2有机化合物组成的研究同步练习-苏教版高中化学选择性必修3
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.常用燃烧法测定有机物的组成。现取3.2克某有机物在足量的氧气中充分燃烧,生成4.4克CO2和3.6克H2O,则该有机物中
A.一定含有C、H两种元素,可能含有O元素 B.一定含有C、H、O三种元素
C.一定含有C、O两种元素,可能含有H元素 D.只含有C、H两种元素,不含O元素
2.下列关于组成表示为CxHy的烷、烯、炔烃的说法不正确的是
A.当 x≤4时,常温常压下均为气体
B.y一定是偶数
C.分别完全燃烧1mol,耗 O2为 (x+y/4)mol
D.在密闭容器中完全燃烧,120℃时测得的压强一定比燃烧前大
3.由乙炔、苯和乙醛组成的混合蒸气,经测定其中碳元素的质量分数为60%,则混合气体中氧元素的质量分数为
A.31.11% B.33.00% C.26.67% D.14.22%
4.X的相对分子质量为100,将10.0gX在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。该有机物X的分子式为
A.C6H12O B.C5H8O2 C.C7H16 D.CaCO3
5.常温常压下,20 mL某气态烃和100 mL氧气混合,完全燃烧后恢复到原来的温度和压强,体积变为70 mL,则该烃可能为
A.CH4 B.C2H6 C.C4H6 D.C6H6
6.探究甲烷的还原性并检验产物的实验设计如图。下列说法错误的是
A.D中可用无水硫酸铜
B.先通足量的甲烷气体,后点燃C处酒精灯
C.若D中盛装碱石灰,根据其质量变化可以推断甲烷组成
D.CH4与CuO的反应为:4CuO+CH44Cu+CO2+2H2O
7.某无色气体可能含有甲烷、一氧化碳、氢气中的一种或几种,依次进行下列实验(假设每步反应或吸收均完全):①无色气体在足量氧气中燃烧;②燃烧生成的气体通过盛有浓硫酸的洗气瓶,装置增重3.6克;③再将剩余气体通过盛有氢氧化钠溶液的洗气瓶,装置增重4. 4克。下列推断正确的是
A.该气体可能只含有一氧化碳、氢气
B.该气体可能只含有甲烷、一氧化碳
C.该气体一定只含有甲烷
D.该气体一定只含有甲烷、氢气
8.1831年李比希提出了确定有机物中氢和碳的质量分数的方法,其基本原理是在高温下氧化有机物,其生成物质主要是
A.CO和H2O B.CO和H2 C.CO2和H2O D.CO2和H2
9.0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是
A.该化合物的相对分子质量是62
B.该化合物的化学式为C2H6O2
C.1 mol该化合物能与2 mol O2发生催化氧化反应
D.1 mol该有机物最多能与2 mol Na反应
10.下列表示正确的是
A.乙炔的结构式:CHCH
B.异戊烷,又称为2-甲基戊烷,其键线式为:
C.葡萄糖的结构简式可能为:
D.NCl3分子的球棍模型
二、填空题
11.已知A为烃,B为烃的含氧衍生物,由等物质的量的A、B组成的混合物0.05mol在0.125mol的氧气中恰好完全燃烧,生成0.1mol的CO2和0.1molH2O,且A与B具有相同的碳原子数。
(1)A、B可能的分子组成(任写两种组合) 、 。
(2)请写出简要的推断过程 。
12.回答下列问题:
(1)有机物A的质谱图和红外光谱图分别如下:
①A的结构简式为 。
②写出属于醇类,与A互为同分异构体的结构简式: 。
(2)相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成和。经分析,其含氧元素的质量分数为37.21%。经核磁共振仪检测发现B的氢谱如下:
B的结构简式为 。
13.苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒.降脂等药效,主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=35.82%,w(H)=4.48%;②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出33.6 L H2(气体体积均已折算为标准状况);③该分子中存在四种化学环境不同的碳原子,氢原子处于五种不同的化学环境。回答下列问题:
⑴苹果酸的分子式为 ,分子中有 个羧基。
⑵写出苹果酸的结构简式 。
⑶苹果酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式): 、 。
14.已知A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05 mol在0.125 mol的氧气中恰好完全燃烧,生成0.1 mol的CO2和0.1 mol H2O。另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定。则:
(1)若耗氧量一定,则A和B的分子式分别为:A ;B 。
(2)若生成的CO2和H2O的物质的量一定,则A和B的分子式为:A ;B 。
15.1.
(1)有两种气态烷烃的混合物,在标准状况下密度为1.16g·L-1,则下列关于此混合物组成中一定含有的烃是的化学式是 。该烃和氯气在光照下反应生成的有机物共有 种,其中 (填写化学式)在常温下呈气态。
(2)燃烧法是测定有机化合物分子式的一种重要方法。完全燃烧0.1mol某烃后,将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0g,再将剩余气体通过澄清石灰水,生成沉淀40g。据此求烃的分子式 ,并写出该烃可能的结构简式 。
16.在标准状况下,1.68L仅由C、H两种元素组成的某气体质量为1.2g,在25℃和101kPa下完全燃烧生成(g)和(l)时,放出66.77kJ的热量。
(1)该气体的分子式为 。
(2)表示该气体燃烧热的热化学方程式为 。
17.将含有C、H、O三种元素的有机物3.24g装入元素分析装置,通入足量的O2使其完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B,测得A管质量增加了2.16g,B管质量增加了9.24g,已知该有机物的相对分子质量为108,试计算:
(1)该化合物3.24g消耗氧气的质量是 。
(2)通过计算写出该化合物的分子式 。
(3)该化合物的能与烧碱反应,且苯环上的一溴代物只有二种。试写出该有机物的结构简式 。
18.有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)蒸馏装置如图所示,仪器a的名称是 ,图中虚线框内应选用右侧的 (填“仪器x”或“仪器y”)。
步骤二:确定M的实验式和分子式。
(2)利用李比希法测得4.4g有机物M完全燃烧后产生CO2 8.8g和H2O 3.6g。
①M的实验式为 。
②已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为 ,分子式为 。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。
M中官能团的名称为 ,M的结构简式为 (填键线式)。
(4)写出两种含有酯基的M的同分异构体的结构简式: 。
19.研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应,也可以处理NO2。当反应生成氮气转移12mol电子时,消耗的NO2在标准状况下体积是 L。
(2)CO可用于合成甲醇,反应方程式为。由甲醇和氧气以强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,充电一次可连续使用1个月。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成。
①该电池反应的总离子方程式为 。
②甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填降低或上升、不变)。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体(水为气体)混合物通过足量的碱石灰,碱石灰增重4.08g。又知生成CO2和H2O的物质的量之比为3:4,则M中碳、氢、氧原子个数之比为 。
20.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJ mol-1·····①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少? (设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格c(H2) ,v(正) v(逆)。
容器编号 c(H2O)/mol·L-1 c(CO)/mol·L-1 c(H2)/mol·L-1 v正、v逆比较
I 0.06 0.60 0.10 v正=v逆
II 0.12 0.20 ________ v正=v逆
III 0.10 0.20 0.40 v正____v逆
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
三、实验题
21.下图是丁烷裂解的实验流程:(提示:丁烷在一定条件下裂解的可能方程式为:
C4H10C2H6+C2H4, C4H10 CH4+C3H6)
连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…‥
(1)这三步操作的先后顺序依次是 ;
(2)简要说明排空气的方法 。
(3)写出甲烷与氧化铜反应的化学方程式
(4)若对E装置中的混合物(溴水足量),再按以下流程实验:
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ Ⅱ ,Na2SO3溶液的作用是(用离子方程式表示) .
②已知B的碳原子数大于A的碳原子数请写出B的结构简式 .
(5)假定丁烷完全裂解当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) = (假定流经D、G装置中的气体能完全反应)
22.实验室可以采用下列实验装置来测定某种氨基酸的分子式:
取7.5 g该种氨基酸样品,放在纯氧中充分燃烧,生成CO2、H2O和N2,请回答有关问题:
(1)E装置的作用是
(2)需要加热的装置是 (填字母代号)。
(3)装置D的作用是 。
(4)F处读数时应该注意: 、 。
(5)若B装置增重4.5g,C装置增重8.8g,产生的N2在标准状况下的体积为1.12L,则该氨基酸的分子式为
23.2017年1月9日,中国中医科学院青蒿家专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青蒿中提取青蒿素,并设计实验测定青蒿素的分子结构。
(1)青蒿素的提取
从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
已知:乙醚沸点为35℃。
①操作I的名称为 。
②操作III的主要过程可能是 。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如下:
①产生的氧气按以左到右流向,所选装置各导管的连接顺序是g→c→ →盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是 。
③E装置中CuO的作用是 。
④称取28.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66g,C装置质量增加19.8g,则该有机物的最简式为 。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会 (填“偏大”。“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要调定的物理量为 。
⑦将青蒿素加入滴有酚酞NaOH溶液中,溶液颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与 (填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
参考答案:
1.B
【详解】4.4gCO2中C原子的质量为,3.6gH2O中H原子的质量为,所以C和H的总质量为1.2g+0.4g=1.6g,故一定还含有O元素。
故选B。
2.D
【详解】A.常温下,碳原子数≤4的烃呈气态,A项正确;
B.烷烃的通式是、烯烃的通式是、炔烃的通式是,所以CxHy的烷烃、烯烃、炔烃,y一定为偶数,B项正确;
C.烃燃烧的通式是,燃烧1mol CxHy时,消耗氧气(x+)mol,C项正确;
D.在密闭容器中完全燃烧,120℃时测定压强,若y>4,燃烧后压强增大;若y=4,燃烧前后压强不变,若y<4,燃烧后压强减小,D项错误;
答案选D。
3.A
【详解】由乙炔、苯的最简式均为CH,乙醛可写成C2H2 H2O,故出了H2O之外,最简式均为CH,故出H2O之外碳、氢的质量比为12:1,故经测定其中碳元素的质量分数为60%,则H%为5%,故H2O的百分含量为100%-60%-5%=35%,由H2O中H和O的质量比为1:8,故混合气体中氧元素的质量分数为31.11%,故答案为:A。
4.B
【详解】无水CaCl2增重的7.2g是水的质量,10.0gX中氢元素的物质的量为=0.8 mol, KOH浓溶液增重的22.0g是二氧化碳的质量,10.0gX中碳元素的物质的量为=0.5mol,根据质量守恒,氧元素的质量为10.0g-0.8 mol ×1 g/ mol-0.5 mol ×12 g/ mol=3.2 g.则氧元素的物质的量为=0.2 mol,则该分子中碳、氢、氧原子的个数之比为0.5 mol : 0.8 mol: 0.2 mol=5 : 8 : 2,结合X的相对分子质量可知,有机物X的分子式为C5H8O2;
故选B。
5.B
【详解】假设烃的分子式为CxHy,则根据差量法可知:,当O2过量时,则有,解得y=6,且x+0.25y小于5,即x小于3.5,则该烃为C2H6,当氧气不足时,将生成CO2和CO的混合气体,则无法计算,故答案为:B。
6.C
【分析】由题给装置图可知,探究甲烷的还原性并检验产物时应先通足量的甲烷气体排尽装置中的空气,然后点燃C除的酒精灯,D中盛有的无水硫酸铜用于检验水的生成,装置E中澄清石灰水用于测量二氧化碳的质量,装置F为处理未反应甲烷的尾气处理装置。
【详解】A.由分析可知,D中盛有的无水硫酸铜用于检验水的生成,故A正确;
B.甲烷是可燃性气体,为防止甲烷与空气混合受热发生爆炸,实验前应先通足量的甲烷气体排尽装置中的空气,故B正确;
C.若D中盛装碱石灰,碱石灰会吸收反应生成的二氧化碳和水,无法测定反应生成二氧化碳和水的质量,不能根据其质量变化可以推断甲烷组成,故C错误;
D.由题给装置图可知,甲烷在加热条件下与氧化铜反应生成铜、二氧化碳和水,反应的化学方程式为4CuO+CH44Cu+CO2+2H2O,故D正确;
故选C。
7.A
【详解】生成的气体通过浓硫酸,装置质量增加3.6g,由此可判断燃烧生成了3.6g水,说明混合气体中含氢元素,且氢元素质量=;气体通过氢氧化钠溶液,装置质量增加4.4g,可判断燃烧生成了4.4g二氧化碳,说明混合气体中含碳元素,且碳元素质量=;甲烷气体中C、H元素质量比=,则混合气体中C、H元素质量比=1.2g:0.4g=3:1,由此可判断混合气体可能只有甲烷,也可能只含有CO和H2,也可能是甲烷、氢气、一氧化碳同时存在,不可能含有甲烷和另外任何一种气体,所以A正确,BCD错误,故选A。
8.C
【详解】李比希法是将有机物充分燃烧,通过测定生成的CO2和H2O的质量来确定有机物中的碳氢的质量分数。答案选C。
9.C
【详解】有机物燃烧生成水10.8g,物质的量为:10.8g÷18g/mol=0.6mol,设有机物燃烧生成的CO为x,则:CuO+COCu+CO2 固体减少△m
28g 16g
x 3.2g
所以x==5.6g,CO的物质的量为:5.6g÷28g/mol=0.2mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g,有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为:8.8g÷44g/mol=0.2mol,根据碳元素守恒可知,1mol有机物含有碳原子物质的量为2mol,根据氢元素守恒可知,1mol有机物含有氢原子物质的量为:=6mol,根据氧元素守恒可知,1mol有机物含有氧原子物质的量为:=2mol,所以有机物的分子式为C2H6O2,0.1mol该有机物恰好与4.6g金属钠完全反应,4.6gNa的物质的量=4.6g÷23g/mol=0.2mol,有机物与Na按物质的量之比1:2反应,有机物分子中含有羟2个-OH,该有机物的结构简式为:HOCH2CH2OH。
A.有机物的分子式为C2H6O2,相对分子质量为62,A正确;
B.由上述分析可知,有机物的分子式为C2H6O2,B正确;
C.该有机物的结构简式为:HOCH2CH2OH,1 mol该化合物能与1 mol O2发生催化氧化反应,C错误;
D.0.1mol该有机物恰好与4.6g金属钠完全反应,4.6gNa的物质的量=4.6g÷23g/mol=0.2mol,有机物与Na按物质的量之比1:2反应,即1 mol该有机物最多能与2 mol Na反应,D正确,
答案选C。
10.C
【详解】A.乙炔的结构式为H—C≡C—H,选项A错误;
B.异戊烷分子中最长碳链含有4个碳原子,侧链为甲基,又称为2—甲基丁烷,选项B错误;
C.葡萄糖的结构简式为HOCH2 (CHOH)4CHO,分子中的HOCH2—能与—CHO发生加成反应转化为,选项C正确;
D.Cl原子的半径大于N原子半径,NCl3分子的球棍模型是 ,选项D正确;
答案选C。
11.(1) C2H2和C2H6O2 C2H4和C2H4O2(或C2H6和C2H2O2)
(2)依据题中燃烧反应数据可知:1mol混合物+2.5molO2→2molCO2+2molH2O,从质量守恒的角度可知混合物平均分子式为C2H4O,而A、B等物质的量,A为烃、B为烃的含氧衍生物,A、B具有相同碳原子数,则A、B各含两个碳原子,A、B的组合可以为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2
【分析】依据题中燃烧反应数据可知:1mol混合物+2.5molO2→2molCO2+2molH2O,从质量守恒的角度可知混合物平均分子式为C2H4O,由于A为烃、B为烃的含氧衍生物,A和B等物质的量,且A与B具有相同的碳原子数,则A和B的碳原子数均为2,A、B的组合可以为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2。
(1)
由分析可知,A、B可能的分子组成为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2。
(2)
依据题中燃烧反应数据可知:1mol混合物+2.5molO2→2molCO2+2molH2O,从质量守恒的角度可知混合物平均分子式为C2H4O,而A、B等物质的量,A为烃、B为烃的含氧衍生物,A、B具有相同碳原子数,则A、B各含两个碳原子,A、B的组合可以为C2H2和C2H6O2,C2H4和C2H4O2,C2H6和C2H2O2。
12.(1) 、、、
(2)
【详解】(1)①质谱图中,质荷比的最大值表示样品的相对分子质量,故A的相对分子质量为74,由红外光谱图能够推断出A中含有对称的与和醚键,所以A为;
②由于有4种结构,故A属于醇类的同分异构体有4种;
(2)B能与金属钠反应产生无色气体,也能与碳酸钠反应产生无色气体,说明B中至少含有一个羧基,同时还可能含有羟基等。B中含氧元素的质量分数为37.21%,若每个B分子中含有2个氧原子,则B的相对分子质量为86;若每个B分子中含有3个氧原子,则B的相对分子质量为129,大于100,不符合要求,所以每个B分子中只含有一个羧基。又因为B可以使溴的四氯化碳溶液褪色,所以B还含有碳碳不饱和键,再结合核磁共振氢谱图显示B中含有三种等效氢原子且个数比为1:2:3,可以推断其结构简式为。
13. C4H6O5 2
【分析】苹果酸分子中w(C)=35.82%,w(H)=4.48%,则O的质量分数为1-35.82%-4.48%=59.7%,相对分子质量不超过150,则O原子最大数目==5.6,1 mol苹果酸与足量的NaHCO3反应放出44.8 L CO2,二氧化碳物质的量为2 mol,说明分子中含有2个羧基,与足量的Na反应放出33.6 L H2,生成氢气为1.5 mol,含有2 mol羧基只能生成1 mol氢气,故分子中还含有1个羟基,综上所述苹果酸分子含有5个O原子,则苹果酸的相对分子质量==134,则分子中C原子数目==4,H原子数目==6,则分子式为C4H6O5;分子式为C4H6O5且分子中含有2个羧基、1个羟基的结构简式可能为:、、;据此分析解答。
【详解】(1)通过分析可知,苹果酸的分子式为C4H6O5;该分子中含有2个羧基。
(2)苹果酸分子式为C4H6O5,该分子中存在四种化学环境不同的碳原子,氢原子处于五种不同的化学环境,则苹果酸的结构简式为:;
(3)通过分析,苹果酸的同分异构体中,符合上述①、②两个条件,即分子式为C4H6O5且分子中含有2个羧基、1个羟基的结构简式有:、。
14.(1) C2H2 C2H6O2
(2) C2H4 C2H4O2
【分析】(1)
已知A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05 mol在0.125 mol的氧气中恰好完全燃烧,生成 0.1 mol的CO2和0.1 mol H2O,则平均组成为 C2H4O,因为A为烃,B为烃的含氧衍生物,则B中必含2个O原子,将其以任意物质的量比混合,且物质的量之和一定时,两者碳原子数均为2,应为C2H2和C2H6O2,因此,本题正确答案是:C2H2;C2H6O2;
(2)
若生成的CO2和H2O的物质的量一定,则两种物质中含有的C和H原子数相同,应为CH2=CH2和CH3COOH,因此,本题正确答案是:C2H4;CH3COOH。
15.(1) CH4 4 CH3Cl
(2) C4H10 CH3CH2CH2CH3和CH3CH(CH3)2
【详解】(1)有两种气态烷烃的混合物,在标准状况下密度为1.16g L﹣1,该混合烃的平均摩尔质量为1.16g/L×22.4L/mol=26g/mol,即平均相对分子质量为26,相对分子质量小于26的烷烃是甲烷,其相对分子质量为16,其它烷烃相对分子质量都大于26,所以混合物中一定有甲烷,化学式为CH4,该烃和氯气在光照下反应生成的有机物一氯甲烷、二氯甲烷、三氯甲烷以及四氯化碳共4种,其中CH3Cl为气体;
故答案为:CH4;4;CH3Cl;
(2)将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0g,为水的质量,且n(H2O)= =0.5mol,n(H)=1mol,再将剩余气体通过澄清石灰水,生成沉淀40g,生成沉淀为碳酸钙,可知n(CO2)=n(CaCO3)= =0.4mol,可知1mol有机物含有4molC、10molH,则分子式为C4H10,为丁烷,可能的结构简式为CH3CH2CH2CH3和CH3CH(CH3)2;
故答案为:烃的分子式为C4H10;可能的结构简式为 CH3CH2CH2CH3和CH3CH(CH3)2。
16.(1)CH4
(2)
【解析】(1)
在标准状况下,1.68L气体的物质的量是,质量为1.2g,则其摩尔质量是,其相对分子质量为16,仅由C、H两种元素组成,则其分子式为CH4;
(2)
根据题意结合第(1)题的分析,得知0.075mol的CH4在25℃和101kPa下完全燃烧生成(g)和(l)时,放出66.77kJ的热量,则1molCH4在25℃和101kPa下完全燃烧生成(g)和(l)时,放出的的热量,故表示该气体燃烧热的热化学方程式为: 。
17.(1)8.16g
(2)C7H8O
(3)
【详解】(1)A管质量增加了2.16g为生成水的质量,B管增加了9.24g为生成二氧化碳的质量,根据质量守恒可知,消耗氧气的质量为2.16g+9.24g-3.24g=8.16g;
(2)2.16g水的物质的量为:=0.12mol,n(H)=0.24mol,
9.24g二氧化碳的物质的量==0.21mol,n(C)=0.21mol,
8.16g氧气的物质的量为:=0.255mol,
3.24g有机物中n(O)=0.21mol×2+0.12mol-0.255mol×2=0.03mol,
3.24g有机物中C、H、O原子物质的量之比=0.21mol:0.24mol:0.03mol=7:8:1,
故该有机物最简式为C7H8O,有机物的相对分子质量为108,而最简式C7H8O的式量=12×7+8+16=108,故最简式即为分子式,即有机物分子式为:C7H8O;
(3)该化合物的分子式为C7H8O,能与烧碱反应,表明分子中含有羧基或酚羟基,苯环上的一溴代物只有二种,则该有机物可能的结构简式为。
18.(1) 蒸馏烧瓶 仪器y
(2) C2H4O 88 C4H8O2
(3) 羟基、羰基
(4)HCOOCH(CH3)2、HCOOCH2CH2CH3、CH3COOCH2CH3、CH3CH2COOCH3任选两个;
【详解】(1)蒸馏装置中,仪器a的名称是蒸馏烧瓶,图中虚线框内的仪器是斜放的冷凝管,为了防止液体残留,便于冷凝导气,应选用右侧的仪器y,故答案是蒸馏烧瓶;仪器y;
(2)①由题目可知,8.8g CO2 含碳元素的质量是2.4g,3.6g H2O中含氢元素质量是0.4g,根据反应中元素守恒,4.4g有机物M含碳元素的质量是2.4g,含氢元素质量是0.4g,含氧元素的质量是1.6g,则有机物M中分子C、H、O原子个数比为,则有机物M的实验式是C2H4O,故答案是C2H4O;
②由pV=nRT得,同温同压下气体密度与气体的摩尔质量成正比。已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为2×44=88,则由实验式计算,(C2H4O)n的相对原子质量是88,则n=2,则有机物M的分子式是C4H8O2,故答案是88;C4H8O2;
(3)由图3的红外光谱仪判断有机物M中含有的官能团是羟基、羧基;由峰面积之比是1∶3∶1∶3可知,M中具有两个甲基,则M的结构简式是CH3CHOHCOCH3,则其键线式是;故答案是羟基、羰基;;
(4)已知题目要求是含有酯基的M的同分异构体,则结构可如下:HCOOCH(CH3)2、HCOOCH2CH2CH3、CH3COOCH2CH3、CH3CH2COOCH3,故答案是HCOOCH(CH3)2、HCOOCH2CH2CH3、CH3COOCH2CH3、CH3CH2COOCH3任选两个;
19. 67.2 2CH3OH+3O2+4OH-=2+6H2O 负 降低 3:8:3
【详解】(1)在反应中,NO2中氮元素的化合价从+4价降低到N2中的0价,1molNO2得到4mol电子,即转移4mol电子,可以处理1molNO2。当反应转移12mol电子时,消耗的NO2的物质的量为3mol,在标准状况下体积是3mol×22.4L/mol=67.2L。
(2)①甲醇和氧气以强碱做电解质溶液的电池,总反应是甲醇和氧气反应,生成碳酸盐和水,离子方程式为:2CH3OH+3O2+4OH-=2+6H2O。
②甲醇失去电子,在负极发生氧化反应。根据总反应式可知,电池在放电过程中消耗OH-,溶液的pH将降低。
(3) 生成CO2和H2O的物质的量之比为3:4,碱石灰增重4.08g即生成的CO2和H2O的总质量是4.08g,设CO2的物质的量为3x,则H2O的物质的量为4x,根据总质量为4.08g,有44×3x+18×4x=4.08,解得x=0.02,则CO2为0.06mol,H2O为0.08mol。0.06molCO2中C的物质的量为0.06mol,质量为0.72g;0.08molH2O中H为0.16mol,质量为0.16g,所以有机物中有氧1.84g-0.72g-0.16g=0.96g,物质的量为0.06mol,所以M中碳、氢、氧原子个数之比为0.06:0.16:0.06=3:8:3。
20.(1)3:5
(2) 0.60 >
(3) C8H10 C8H18 19.875吨
【分析】(1)根据同问同压下气体体积之比等于个数之比,等于物质的量之比计算;
(2)一定温度下,三个容器中均进行着上述反应①,因此三个容器中的平衡常数相等,据此计算;
(3)根据苯的同系物和烷烃的通式计算X,Y的分子式,由O原子守恒可知n(H2O)=n(CO),令X、Y的物质的量分别为xmol、ymol,根据碳原子守恒、H原子守恒列方程,再根据m=nM计算.
【详解】(1)反应①C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJ mol-1②C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1,观察可知反应①×3可得3C(s)+3H2O(g)3CO(g)+3H2(g)△H=+393.9kJ mol-1,为保持生产的连续性,则应保证碳完全燃烧放出的热大于等于生成水煤气吸收的热,即反应①与②按3:1进行反应,即参加反应的n(H2O):n(O2)=3:1,所以体积之比为V(H2O):V(O2)=3:1,若空气中氧气的体积占1/5,则V(H2O):V(空气)=3:5;
(2)容器I中v(正)=v(逆),所以容器I处于化学平衡状态,则平衡常数为K=,相同温度下,容器Ⅱ中v(正)=v(逆),即K=1=,解得c(H2)=0.6;相同温度下,容器Ⅲ中Q=<K=1,则证明反应正向进行,即v(正)>v(逆);
(3)苯的同系物的通式为CnH2n-6,烷烃的通式为CnH2n+2,且X、Y都是有8个碳原子的烃,则X的分子式为C8H10,Y的分子式为C8H18;
50t92%乙醇溶液中含乙醇为50×106g×92%÷46g/mol==1.0×l06mol,根据C原子守恒,得到CO总物质的量n总(CO)=1.0×l06mol×2=2.0×l06mol,按a式得到氢气物质的量=1.0×l06mol×50%×4=2.0×l06mol,按b式反应得到氢气物质的量=1.0×l06mol×50%×3=1.5×l06mol,故n总(H2)=3.5×106mol;合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O,由O原子守恒可知n(H2O)=n(CO),令C8H10、C8H18的物质的量分别为xmol、ymol,根据碳原子守恒,有:8(x+y)=2.0×l06,;根据H原子守恒,有:10x+18y=3.5×106×2-2×2.0×l06,联立方程,解得x=1.875×l05、y=6.25×l04,故X(C8H10)的质量=1.875×l05mol×106g/mol=19.875×l06g=19.875t。
21.(1)②③①
(2)打开K,使丁烷气依次流经各装置
(3)
(4) 分液 蒸馏 CH3CHBrCH2Br
(5)1:1
【分析】打开K,气体通过B,B装置是根据气泡控制气体流速,C装置干燥丁烷,在氧化铝作催化剂条件下丁烷发生裂解反应生成烯烃和烷烃,E中溴水吸收烯烃,F干燥烷烃,G中烷烃和Cu在加热条件下发生氧化还原反应生成Cu。
【详解】(1)先检查气密性,再赶出装置内气体,再给D、G装置加热,故答案是②③①。
(2)打开K,使丁烷气依次流经各装置,从而将空气排出,故答案是:打开K,使丁烷气依次流经各装置。
(3)氧化铝作催化剂,加热条件下,甲烷和氧化铜反应生成二氧化碳、水和铜,反应方程式为。
(4)混合物中含有溴、水、溴代烃,加入亚硫酸钠,亚硫酸钠被溴氧化生成硫酸钠,同时生成NaBr,从而除去溴,然后采用分液方法分离,将有机层进行分馏得到有机物A、有机物B,向有机物中加入NaOH溶液,得到有机物C,C能发生氧化反应,则B发生水解反应生成C为醇,C被催化氧化得到醛D;
①通过以上分析知,分离操作Ⅰ和Ⅱ的名称分别是:分液;蒸馏,亚硫酸钠具有还原性,能和强氧化性物质溴反应而除去溴,离子方程式为,故答案是:分液;蒸馏;;
②已知B的碳原子数大于A的碳原子数,说明B中碳原子个数是3、A中碳原子个数是2,B为1,2—二溴丙烷,B的结构简式,故答案是:。
(5)丁烷的裂解中生成的乙烯和乙烷的物质的量相等,生成的甲烷和丙烯的物质的量相等,E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,设X为C2H4的物质的量,y为C3H6的物质的量,则乙烷和甲烷的物质的量分别是x、y,得28x+42y = 0.7g,乙烷和甲烷和氧化铜反应需要的氧原子的物质的量为
,计算得出:x=y = 0.07mol,故答案为:1: 1。
22.(1)用来排水,以测定氮气的体积
(2)A、D
(3)吸收未反应的氧气
(4) 量筒内的液面与广口瓶内的液面相平 视线与凹液面最低处相切
(5)C2H5O2N
【分析】首先明确该实验的原理,氨基酸的燃烧产物为CO2、H2O和N2,通过浓硫酸吸收生成的水,测出生成水的质量;通过碱石灰吸收CO2并测其质量;过量的O2被Cu网吸收后剩余N2,用排水法测得生成N2的体积。根据,,和m(氨基酸)可求出氨基酸的实验式,再由其相对分子质量可求出其分子式。
(1)
E装置中的水排入F中,可以测定气体的体积,故E装置的作用是:用来排水,以测定氮气的体积;
(2)
氨基酸和氧气反应以及铜与氧气反应都需要加热;在加热时应先点燃D出的酒精灯,吸收为反应的氧气,保证最终收集到的气体为氮气,故答案为:A、D;
(3)
由原理可知,气体进入装置E之前应将氧气除去,所以铜网的作用是吸收为反应完的氧气,以保证最终收集的气体为氮气,故答案为:吸收未反应的氧气;
(4)
装置E和F共同结合在一起来测量气体的体积,读数时必须保证装置内外压强相等,以及装置内的温度应冷却至室温,所以注意事项为:量筒内的液面与广口瓶内的液面相平;视线与凹液面最低处相切;
(5)
根据7.5g样品。测定到其中含水0.25mol,即含氢原子0.5g,0.2mol二氧化碳即含碳为2.4g;氮原子为0.1mol,1.4g,则推算到含有氧原子共3.2g,即0.2mol氧原子;故CHON四种原子的物质的量之比为:2:5:2:1.从而得到分子式为:C2H5O2N。
23. 过滤 B dhifeab(或ba) 除去氧气中的水蒸气 将可能生成的CO氧化为CO2 C15H22O5 偏小 该有机物的相对分子质量 D
【详解】分析:本题考查的是物质的分离、提纯及物质的量有关计算,侧重学生的分析,注意把握物质的性质及分离混合物的实验操作。
详解:(1)①操作I是用于分离固体和液体,则可以用过滤的方法。②依据题干信息分析可知,青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶解,熔点为156~157℃,热稳定性差,乙醚的沸点为35℃,便于除去,A.青蒿素不溶于水,故错误;B. B.加95%的乙醇,浓缩、结晶、过滤可以得到较纯的青蒿素,故正确;C.加入乙醚进行萃取分液得到的还是混合物,故错误。故选B。(2)实验原理是测定一定质量的有机物完全燃烧时生成的二氧化碳和水的质量,来确定是否含氧及碳氢氧的个数比,求出最简式,因此生成氧气后必须除杂,明确各装置的作用是解题的前提。A是用来吸收二氧化碳,测定生成二氧化碳的质量,B用于干燥通入E中的氧气,C用来吸收水,测定生成水的质量,D用来制取反应所需的氧气,E是在电炉中加热时用纯氧气氧化管内样品,根据一氧化碳和氧化铜反应,可被氧化生成二氧化碳的性质可知氧化铜的作用是把有机物不完全燃烧产生的一氧化碳转化为二氧化碳。 ①D中生成的氧气含有水蒸气,应先通过B中的氯化钙吸收,在E中电炉加热时用纯氧气氧化管内样品,生成二氧化碳和水,如果有一氧化碳,则E中的氧化铜可以与一氧化碳进一步反应生成二氧化碳,然后分别通入装有浓硫酸的洗气瓶吸收水,通过装有氢氧化钠溶液的U形管吸收二氧化碳,根据产物的质量推断有机物的组成,所以仪器的接口顺序为dhifeab(或ba);②B装置的作用除去氧气中的水蒸气;③氧化铜将可能生成的CO氧化为CO2;④A管质量增加66克,可得碳元素的质量为=18g,C装置质量增加19.8g,可得氢元素的质量为=2.2g,从而推出含氧元素的质量为28.2-18-2.2=8g,设最简式为CxHyOz,则有x:y:z==15:22:5,最简式为C15H22O5;⑤若把盛有碱石灰的干燥管的装置去掉,则空气中的水和二氧化碳可能进入装置A中,使二氧化碳的质量增加,则氧元素的质量减少,测定氧的质量分数偏小;⑥测定了最简式之后,还需要该有机物的相对分子质量才能确定其分子式;⑦由于酯不溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠,结合题意可知青蒿素中含有酯基,而油脂中也含有酯基,故选D。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
