1.1.2物质的转化课件(共37张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2物质的转化课件(共37张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 11:22:34 | ||
图片预览






文档简介
(共37张PPT)
物质的转化
学习目标:
1.能根据物质的微观结构预测物质在特定条件下可能具有的性质和可能发生的变化,并能解释原因。
2.同类物质具有相似的性质,一定条件下各类物质可以相互转化。
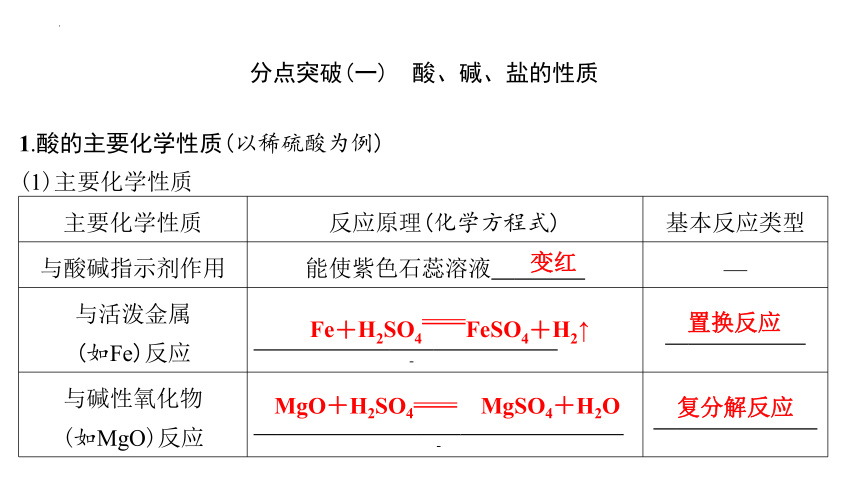
1.酸的主要化学性质(以稀硫酸为例)
(1)主要化学性质
主要化学性质 反应原理(化学方程式) 基本反应类型
与酸碱指示剂作用 能使紫色石蕊溶液 变红 —
与活泼金属 (如Fe)反应 Fe+H2SO4FeSO4+H2↑ 置换反应
与碱性氧化物 (如MgO)反应 MgO+H2SO4 MgSO4+H2O 复分解反应
变红
Fe+H2SO4FeSO4+H2↑
置换反应
MgO+H2SO4 MgSO4+H2O
复分解反应
分点突破(一) 酸、碱、盐的性质
主要化学性质 反应原理(化学方程式) 基本反应类型
与碱(如NaOH)反应 2NaOH+H2SO4 Na2SO4+2H2O 复分解反应
与某些盐(如 Na2CO3)反应 Na2CO3+H2SO4Na2SO4+H2O+CO2↑ 复分解反应
(2)酸具有相似化学性质的原因:从微观角度来看,不同的酸溶液中都含有 H+ 。
2NaOH+H2SO4 Na2SO4
+2H2O
复分解反应
Na2CO3+H2SO4Na2SO4+
H2O+CO2↑
复分解反应
H+
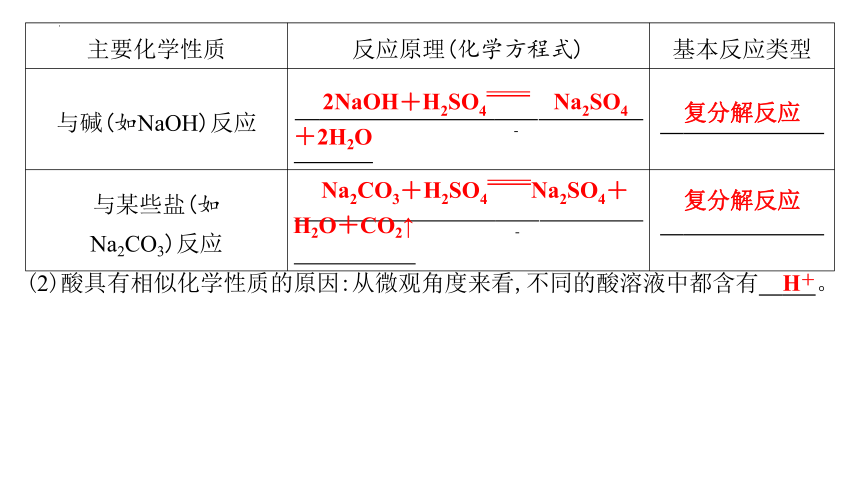
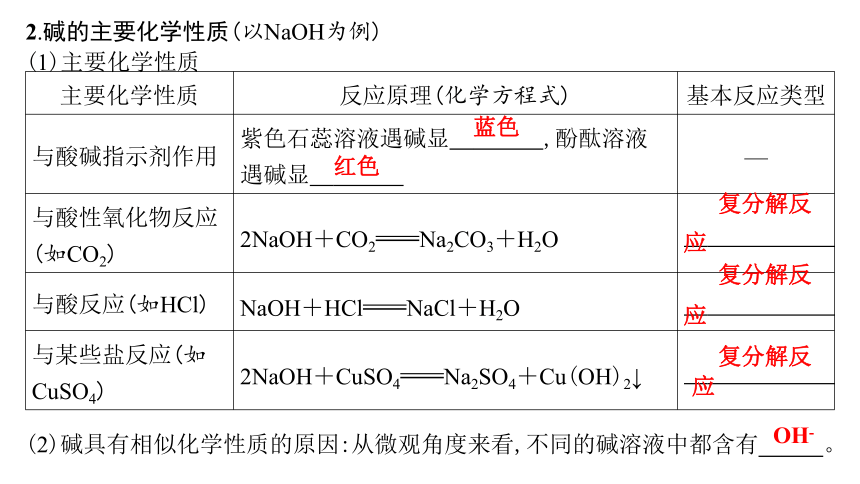
2.碱的主要化学性质(以NaOH为例)
(1)主要化学性质
主要化学性质 反应原理(化学方程式) 基本反应类型
与酸碱指示剂作用 紫色石蕊溶液遇碱显 蓝色 ,酚酞溶液遇碱显 红色 —
与酸性氧化物反应(如CO2) 2NaOH+CO2Na2CO3+H2O 复分解反应
与酸反应(如HCl) NaOH+HClNaCl+H2O 复分解反应
与某些盐反应(如CuSO4) 2NaOH+CuSO4Na2SO4+Cu(OH)2↓ 复分解反应
蓝色
红色
复分解反
应
复分解反
应
复分解反
应
(2)碱具有相似化学性质的原因:从微观角度来看,不同的碱溶液中都含有 OH- 。
OH-
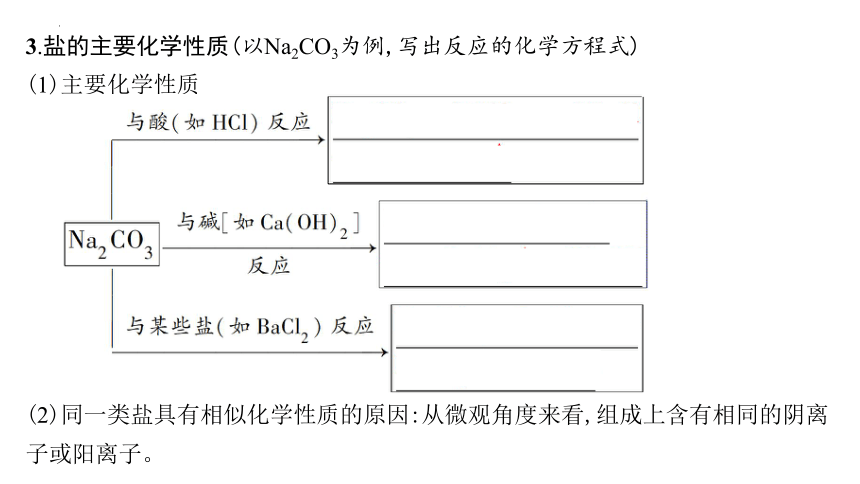
3.盐的主要化学性质(以Na2CO3为例,写出反应的化学方程式)
(1)主要化学性质
(2)同一类盐具有相似化学性质的原因:从微观角度来看,组成上含有相同的阴离子或阳离子。
根据物质类别预测陌生物质的性质,SO2和CO2同为酸性氧化物,试根据CO2的性质推测二氧化硫的性质,用化学方程式表示并指出反应类型。
(1)SO2+H2O , ;
提示:(1)H2SO3 化合反应
(2)SO2+CaO , ;
提示:(2)CaSO3 化合反应
(3)二氧化硫通入足量的澄清石灰水中:
, 。
提示:(3)SO2+Ca(OH)2CaSO3↓+H2O 复分解反应
(1)金属单质+酸盐+H2的反应中,金属是金属活动性顺序中排在H前面的金属。
(2)盐与酸、碱、盐的反应能否发生,需要看生成物是否满足复分解反应发生的条件。
(3)有盐和水生成的反应不一定是中和反应,如酸与碱性氧化物、碱与酸性氧化物的反应均有盐和水生成,但均不是中和反应。
1.酸溶液中都含有H+,因此不同的酸表现出一些共同的性质。下列关于H2SO4 性质的描述不属于酸的共同性质的是( )
A.能使紫色石蕊溶液变红
B.能与氢氧化钠反应生成水
C.能与BaCl2 溶液反应生成BaSO4 沉淀
D.能与Fe2O3 反应生成水
解析:C 与氯化钡反应生成沉淀不是酸的共同性质,C符合题意。
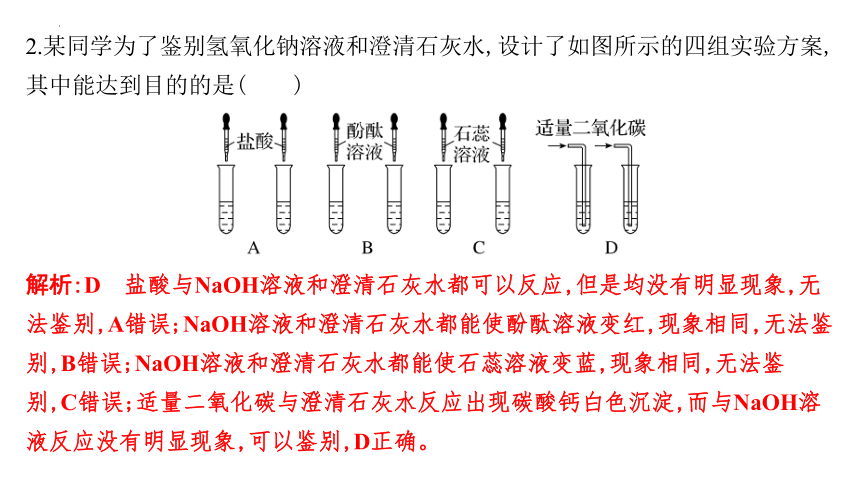
2.某同学为了鉴别氢氧化钠溶液和澄清石灰水,设计了如图所示的四组实验方案,其中能达到目的的是( )
解析:D 盐酸与NaOH溶液和澄清石灰水都可以反应,但是均没有明显现象,无法鉴别,A错误;NaOH溶液和澄清石灰水都能使酚酞溶液变红,现象相同,无法鉴别,B错误;NaOH溶液和澄清石灰水都能使石蕊溶液变蓝,现象相同,无法鉴别,C错误;适量二氧化碳与澄清石灰水反应出现碳酸钙白色沉淀,而与NaOH溶液反应没有明显现象,可以鉴别,D正确。
3.X、Y、Z、W各代表一种物质,若X+YZ+W,则X和Y之间不可能是( )
A.盐和盐的反应 B.碱性氧化物和水的反应
C.酸与碱的反应 D.酸性氧化物和碱的反应
解析:B A、C、D中的反应均有两种物质生成,而B项只生成一种物质——碱。
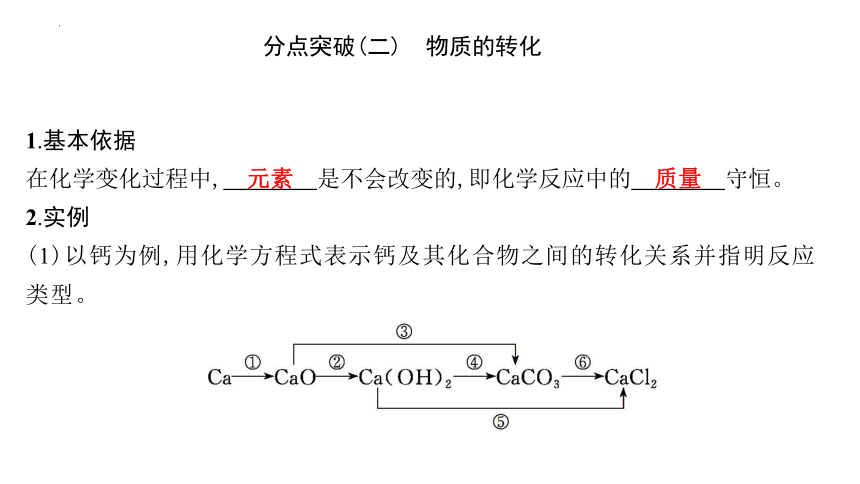
分点突破(二) 物质的转化
1.基本依据
在化学变化过程中, 元素 是不会改变的,即化学反应中的 质量 守恒。
2.实例
(1)以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型。
元素
质量
①2Ca+O22CaO, 化合反应 ;
②CaO+H2OCa(OH)2, 化合反应 ;
③CaO+CO2CaCO3, 化合反应 ;
④Ca(OH)2+Na2CO3CaCO3↓+2NaOH, 复分解反应 ;
⑤Ca(OH)2+2HClCaCl2+2H2O, 复分解反应 ;
⑥CaCO3+2HClCaCl2+CO2↑+H2O, 复分解反应 。
化合反应
化合反应
化合反应
复分解反应
复分解反应
复分解反应
(2)碳及其化合物间的转化关系如图所示:
写出图中序号所示转化所需反应物的化学式:
① O2 ;② H2O ;③ Ca(OH)2 ;④ CaO ;⑤ Ca(OH)2 (答案合理即可)。
O2
H2O
Ca(OH)2
CaO
Ca(OH)2
摩擦剂是牙膏中能够和牙刷共同作用,擦去牙齿表面牙垢,减轻牙渍、牙菌斑、牙结石等外来物质的固体原料成分。某品牌牙膏中的摩擦剂是碳酸钙,可以用大理石[主要成分CaCO3]制备。
某研究小组设计了一种制备高纯碳酸钙的实验方案,流程图如下:
1.写出上述流程中①、②、③的化学方程式,并写出反应类型。
提示:①CaCO3 CaO+CO2↑;分解反应。
②CaO+H2OCa(OH)2;化合反应。
③Ca(OH)2+Na2CO3CaCO3↓+2NaOH;复分解反应。
2.以大理石、纯碱、稀盐酸为原料设计另一种制备碳酸钙的实验方案,并用流程图的形式表示出来,写出各步反应的化学方程式。
提示:大理石 氯化钙 碳酸钙
化学方程式:①CaCO3+2HClCaCl2+H2O+CO2↑,②CaCl2+Na2CO3CaCO3↓+2NaCl。
1.单质到盐的转化
部分金属单质 碱性氧化物 碱 盐
部分非金属单质 酸性氧化物 酸 盐
2.物质的转化的应用——物质制备方法的选择
(1)确定物质制备方法的依据
①物质的组成和性质;②物质之间的转化关系。
(2)工业生产中最适当方法的选择
(3)实例:工业上制取NaOH
①不采用Na2O与H2O反应的原因:Na2O作为原料,来源少、成本高。
②主要采用的方法:电解饱和食盐水。
③过去曾采用的方法:Ca(OH)2+Na2CO3CaCO3↓+2NaOH。
1.利用下列流程制取烧碱,在整个流程中没有涉及的化学反应类型是( )
石灰石 生石灰 熟石灰 烧碱
A.化合反应 B.置换反应
C.复分解反应 D.分解反应
解析:B CaCO3高温煅烧,发生分解反应生成生石灰CaO、CO2;CaO与水发生化合反应生成熟石灰Ca(OH)2;Ca(OH)2与纯碱Na2CO3发生复分解反应生成CaCO3沉淀和烧碱NaOH,在整个流程中没有涉及置换反应,故选B。
2.以下物质间的转化,不能通过一步反应实现的是( )
A.CO2→CaCO3 B.CO→CO2
C.H2O2→O2 D.Cu→Cu(OH)2
解析:D A中:CO2 CaCO3,能一步转化;B中:CO CO2,能一步转化;C中:H2O2 O2,能一步转化;D中:Cu不能一步转化为Cu(OH)2。
3.以Fe、CuO、H2SO4三种物质为原料,用两种方法制取Cu,写出反应的化学方程式,并对比两种方法的优缺点,你认为哪一种方法更好并指明原因。
答案:方法一:Fe+H2SO4FeSO4+H2↑,H2+CuOCu+H2O
方法二:CuO+H2SO4CuSO4+H2O,Fe+CuSO4Cu+FeSO4
第二种方法好,原因是方法一加热易爆炸,消耗能源多且H2很难与CuO充分反应,原料利用率低,产品不纯。
物质转化规律(归纳与论证)
单质、氧化物、酸、碱和盐的相互关系,可以用如图简单表示。选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转化用化学方程式表示(所写化学方程式不得重复)。
①C+O2 CO2;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ 。
解析:属于同一类的物质必定符合同一标准,就会有某一共同的性质,利用一类物质和另一类物质之间的关系,就可以找出物质之间转化的方法,一般有以下化学通性:
非金属 酸性氧化物 ;金属 碱性氧化物 ,该题对各类物质之间的转化限定了8种物质,从这8种物质中选出符合条件的物质进行各类物质间的转化。
答案:②CO2+H2OH2CO3
③CO2+Ca(OH)2CaCO3↓+H2O
④Fe+2HClFeCl2+H2↑
⑤CaO+2HClCaCl2+H2O
⑥Ca(OH)2+2HClCaCl2+2H2O
⑦CaO+H2OCa(OH)2
常见物质的转化规律
(1)以“强制弱”规律
①强酸制弱酸
如Na2CO3+2HCl2NaCl+CO2↑+H2O;
②强碱制弱碱
如FeCl3+3NaOHFe(OH)3↓+3NaCl;
③活泼性强的金属制活泼性弱的金属
如Fe+CuSO4Cu+FeSO4。
(2)易溶制难溶
如Na2SO4溶液与BaCl2溶液反应:Na2SO4+BaCl2BaSO4↓+2NaCl。
1.我国科学家在国际上首次实现了从二氧化碳到淀粉的全合成。通常条件下,下列物质中不能与CO2发生反应的是( )
A.H2SO4 B.CaO
C.H2O D.NaOH
解析:A CO2是酸性氧化物,不能与H2SO4发生反应,可以与碱性氧化物CaO反应生成CaCO3,能够与水反应产生H2CO3,能够与碱NaOH发生反应产生Na2CO3、H2O,选A。
2.下列物质的转化中,不能通过一步反应实现的是( )
A.Mg→MgCl2 B.CuO→Cu(OH)2
C.CaCO3→CaO D.KClO3→KCl
解析:B A项,要一步实现Mg→MgCl2,可由镁与氯气反应;B项,氧化铜不能一步实现CuO→Cu(OH)2;C项,要一步实现CaCO3→CaO,煅烧就可以;D项,要一步实现KClO3→KCl,用MnO2作催化剂,加热就可以。
3.实现下列物质的转化时,只有加入酸才能实现的是( )
A.Fe2O3→Fe2(SO4)3 B.Zn→ZnCl2
C.NaOH→NaCl D.BaCl2→BaSO4
解析:A Zn除了与盐酸反应生成ZnCl2外,还可以与CuCl2反应生成ZnCl2,B项错误;NaOH与HCl、CuCl2等反应均可生成NaCl,C项错误;BaCl2与H2SO4或可溶性硫酸盐反应均可生成BaSO4,D项错误;Fe2O3是难溶性碱性氧化物,只有与酸反应才能转化成盐,A项正确。
1.下列变化属于化学变化的是( )
A.在晒干的咸菜表面出现食盐晶体
B.冰融化
C.炒菜时油锅着火
D.日光灯照明
解析:C 咸菜表面出现食盐晶体、冰融化、日光灯照明的过程中都无新物质生成,属于物理变化,炒菜时油锅着火是油的燃烧,属于化学变化,故选C。
2.钙片的主要成分是CaCO3,下列制取CaCO3的流程不正确的是( )
A.CaO CaCO3
B.Na2CO3 CaCO3
C.CaO Ca(OH)2 CaCO3
D.BaCO3 CaCO3
解析:D A项,CaO、CO2分别为碱性氧化物、酸性氧化物,两者可以反应生成CaCO3,正确;B项,Na2CO3和CaCl2生成CaCO3沉淀和氯化钠,正确;C项,CaO和水生成Ca(OH)2,Ca(OH)2和CO2生成CaCO3沉淀,正确;D项,BaCO3为沉淀,不和氯化钙反应,错误。
3.含碳元素物质间发生转化:C CO CO2 H2CO3 K2CO3,下列有关说法正确的是( )
A.CO、CO2 都是非金属氧化物,故都属于酸性氧化物
B.上述流程中涉及的化学反应类型有化合反应和复分解反应
C.由图可知,C不能一步转化为CO2
D.K2CO3 的水溶液能使酚酞变红,所以K2CO3 是碱
解析:B CO是不成盐氧化物,A错误;①②③是化合反应,④是复分解反应,B正确;氧气充足,C和氧气点燃生成CO2,C错误;K2CO3由钾离子和碳酸根离子构成,K2CO3是盐,D错误。
4.物质X可发生下列所示的两个反应,则X可能是( )
①X+碱盐+水 ②X+金属氧化物盐+水
A.CaO B.H2SO4
C.NaOH D.CO
解析:B 硫酸既能与碱发生中和反应,生成盐和水,又可以与金属氧化物反应,生成盐和水,B正确。
5.单质、氧化物、酸、碱、盐,这些不同类别的物质之间反应时可以生成盐,某同学构建了如图所示的知识网络图。
(1)请任写一种符合图中组合⑥关系的化学方程式(要求组合⑥不能与图中已有组合重复): 。
解析:(1)排除图中已有的组合关系,组合⑥可以是盐+金属,也可以是盐+非金属等其他合理组合,如盐+金属:Fe+CuSO4FeSO4+Cu。
答案:(1)Fe+CuSO4FeSO4+Cu(答案合理即可)
(2)用面粉制作馒头的发酵过程中会产生有机酸,设其化学式为HR,R表示有机酸根成分,若在蒸馒头前加入小苏打,则蒸好的馒头有很多小孔,吃起来松软可口且无酸味。请写出发生反应的化学方程式:
。
该反应所对应的是图中的哪种组合 。(从①~⑩中选序号填入)
解析:(2)碳酸氢钠与HR反应时会生成水、CO2和NaR(R的化合价是-1价),属于盐与酸发生的复分解反应,化学方程式为HR+NaHCO3CO2↑+H2O+NaR,则该反应所对应的是图中的组合①。
答案:(2)HR+NaHCO3CO2↑+H2O+NaR ①
(3)Fe3O4可看成由Fe2O3和FeO组成。请写出Fe3O4与盐酸反应的化学方程式: 。
解析:(3)根据Fe3O4的化学式也可以写成FeO·Fe2O3,所以与盐酸反应的化学方程式为Fe3O4+8HCl2FeCl3+FeCl2+4H2O或FeO·Fe2O3+8HCl2FeCl3+FeCl2+4H2O。
答案:(3)Fe3O4+8HCl2FeCl3+FeCl2+4H2O(或FeO·Fe2O3+8HClFeCl2+2FeCl3+4H2O)
物质的转化
学习目标:
1.能根据物质的微观结构预测物质在特定条件下可能具有的性质和可能发生的变化,并能解释原因。
2.同类物质具有相似的性质,一定条件下各类物质可以相互转化。
1.酸的主要化学性质(以稀硫酸为例)
(1)主要化学性质
主要化学性质 反应原理(化学方程式) 基本反应类型
与酸碱指示剂作用 能使紫色石蕊溶液 变红 —
与活泼金属 (如Fe)反应 Fe+H2SO4FeSO4+H2↑ 置换反应
与碱性氧化物 (如MgO)反应 MgO+H2SO4 MgSO4+H2O 复分解反应
变红
Fe+H2SO4FeSO4+H2↑
置换反应
MgO+H2SO4 MgSO4+H2O
复分解反应
分点突破(一) 酸、碱、盐的性质
主要化学性质 反应原理(化学方程式) 基本反应类型
与碱(如NaOH)反应 2NaOH+H2SO4 Na2SO4+2H2O 复分解反应
与某些盐(如 Na2CO3)反应 Na2CO3+H2SO4Na2SO4+H2O+CO2↑ 复分解反应
(2)酸具有相似化学性质的原因:从微观角度来看,不同的酸溶液中都含有 H+ 。
2NaOH+H2SO4 Na2SO4
+2H2O
复分解反应
Na2CO3+H2SO4Na2SO4+
H2O+CO2↑
复分解反应
H+
2.碱的主要化学性质(以NaOH为例)
(1)主要化学性质
主要化学性质 反应原理(化学方程式) 基本反应类型
与酸碱指示剂作用 紫色石蕊溶液遇碱显 蓝色 ,酚酞溶液遇碱显 红色 —
与酸性氧化物反应(如CO2) 2NaOH+CO2Na2CO3+H2O 复分解反应
与酸反应(如HCl) NaOH+HClNaCl+H2O 复分解反应
与某些盐反应(如CuSO4) 2NaOH+CuSO4Na2SO4+Cu(OH)2↓ 复分解反应
蓝色
红色
复分解反
应
复分解反
应
复分解反
应
(2)碱具有相似化学性质的原因:从微观角度来看,不同的碱溶液中都含有 OH- 。
OH-
3.盐的主要化学性质(以Na2CO3为例,写出反应的化学方程式)
(1)主要化学性质
(2)同一类盐具有相似化学性质的原因:从微观角度来看,组成上含有相同的阴离子或阳离子。
根据物质类别预测陌生物质的性质,SO2和CO2同为酸性氧化物,试根据CO2的性质推测二氧化硫的性质,用化学方程式表示并指出反应类型。
(1)SO2+H2O , ;
提示:(1)H2SO3 化合反应
(2)SO2+CaO , ;
提示:(2)CaSO3 化合反应
(3)二氧化硫通入足量的澄清石灰水中:
, 。
提示:(3)SO2+Ca(OH)2CaSO3↓+H2O 复分解反应
(1)金属单质+酸盐+H2的反应中,金属是金属活动性顺序中排在H前面的金属。
(2)盐与酸、碱、盐的反应能否发生,需要看生成物是否满足复分解反应发生的条件。
(3)有盐和水生成的反应不一定是中和反应,如酸与碱性氧化物、碱与酸性氧化物的反应均有盐和水生成,但均不是中和反应。
1.酸溶液中都含有H+,因此不同的酸表现出一些共同的性质。下列关于H2SO4 性质的描述不属于酸的共同性质的是( )
A.能使紫色石蕊溶液变红
B.能与氢氧化钠反应生成水
C.能与BaCl2 溶液反应生成BaSO4 沉淀
D.能与Fe2O3 反应生成水
解析:C 与氯化钡反应生成沉淀不是酸的共同性质,C符合题意。
2.某同学为了鉴别氢氧化钠溶液和澄清石灰水,设计了如图所示的四组实验方案,其中能达到目的的是( )
解析:D 盐酸与NaOH溶液和澄清石灰水都可以反应,但是均没有明显现象,无法鉴别,A错误;NaOH溶液和澄清石灰水都能使酚酞溶液变红,现象相同,无法鉴别,B错误;NaOH溶液和澄清石灰水都能使石蕊溶液变蓝,现象相同,无法鉴别,C错误;适量二氧化碳与澄清石灰水反应出现碳酸钙白色沉淀,而与NaOH溶液反应没有明显现象,可以鉴别,D正确。
3.X、Y、Z、W各代表一种物质,若X+YZ+W,则X和Y之间不可能是( )
A.盐和盐的反应 B.碱性氧化物和水的反应
C.酸与碱的反应 D.酸性氧化物和碱的反应
解析:B A、C、D中的反应均有两种物质生成,而B项只生成一种物质——碱。
分点突破(二) 物质的转化
1.基本依据
在化学变化过程中, 元素 是不会改变的,即化学反应中的 质量 守恒。
2.实例
(1)以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型。
元素
质量
①2Ca+O22CaO, 化合反应 ;
②CaO+H2OCa(OH)2, 化合反应 ;
③CaO+CO2CaCO3, 化合反应 ;
④Ca(OH)2+Na2CO3CaCO3↓+2NaOH, 复分解反应 ;
⑤Ca(OH)2+2HClCaCl2+2H2O, 复分解反应 ;
⑥CaCO3+2HClCaCl2+CO2↑+H2O, 复分解反应 。
化合反应
化合反应
化合反应
复分解反应
复分解反应
复分解反应
(2)碳及其化合物间的转化关系如图所示:
写出图中序号所示转化所需反应物的化学式:
① O2 ;② H2O ;③ Ca(OH)2 ;④ CaO ;⑤ Ca(OH)2 (答案合理即可)。
O2
H2O
Ca(OH)2
CaO
Ca(OH)2
摩擦剂是牙膏中能够和牙刷共同作用,擦去牙齿表面牙垢,减轻牙渍、牙菌斑、牙结石等外来物质的固体原料成分。某品牌牙膏中的摩擦剂是碳酸钙,可以用大理石[主要成分CaCO3]制备。
某研究小组设计了一种制备高纯碳酸钙的实验方案,流程图如下:
1.写出上述流程中①、②、③的化学方程式,并写出反应类型。
提示:①CaCO3 CaO+CO2↑;分解反应。
②CaO+H2OCa(OH)2;化合反应。
③Ca(OH)2+Na2CO3CaCO3↓+2NaOH;复分解反应。
2.以大理石、纯碱、稀盐酸为原料设计另一种制备碳酸钙的实验方案,并用流程图的形式表示出来,写出各步反应的化学方程式。
提示:大理石 氯化钙 碳酸钙
化学方程式:①CaCO3+2HClCaCl2+H2O+CO2↑,②CaCl2+Na2CO3CaCO3↓+2NaCl。
1.单质到盐的转化
部分金属单质 碱性氧化物 碱 盐
部分非金属单质 酸性氧化物 酸 盐
2.物质的转化的应用——物质制备方法的选择
(1)确定物质制备方法的依据
①物质的组成和性质;②物质之间的转化关系。
(2)工业生产中最适当方法的选择
(3)实例:工业上制取NaOH
①不采用Na2O与H2O反应的原因:Na2O作为原料,来源少、成本高。
②主要采用的方法:电解饱和食盐水。
③过去曾采用的方法:Ca(OH)2+Na2CO3CaCO3↓+2NaOH。
1.利用下列流程制取烧碱,在整个流程中没有涉及的化学反应类型是( )
石灰石 生石灰 熟石灰 烧碱
A.化合反应 B.置换反应
C.复分解反应 D.分解反应
解析:B CaCO3高温煅烧,发生分解反应生成生石灰CaO、CO2;CaO与水发生化合反应生成熟石灰Ca(OH)2;Ca(OH)2与纯碱Na2CO3发生复分解反应生成CaCO3沉淀和烧碱NaOH,在整个流程中没有涉及置换反应,故选B。
2.以下物质间的转化,不能通过一步反应实现的是( )
A.CO2→CaCO3 B.CO→CO2
C.H2O2→O2 D.Cu→Cu(OH)2
解析:D A中:CO2 CaCO3,能一步转化;B中:CO CO2,能一步转化;C中:H2O2 O2,能一步转化;D中:Cu不能一步转化为Cu(OH)2。
3.以Fe、CuO、H2SO4三种物质为原料,用两种方法制取Cu,写出反应的化学方程式,并对比两种方法的优缺点,你认为哪一种方法更好并指明原因。
答案:方法一:Fe+H2SO4FeSO4+H2↑,H2+CuOCu+H2O
方法二:CuO+H2SO4CuSO4+H2O,Fe+CuSO4Cu+FeSO4
第二种方法好,原因是方法一加热易爆炸,消耗能源多且H2很难与CuO充分反应,原料利用率低,产品不纯。
物质转化规律(归纳与论证)
单质、氧化物、酸、碱和盐的相互关系,可以用如图简单表示。选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转化用化学方程式表示(所写化学方程式不得重复)。
①C+O2 CO2;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ 。
解析:属于同一类的物质必定符合同一标准,就会有某一共同的性质,利用一类物质和另一类物质之间的关系,就可以找出物质之间转化的方法,一般有以下化学通性:
非金属 酸性氧化物 ;金属 碱性氧化物 ,该题对各类物质之间的转化限定了8种物质,从这8种物质中选出符合条件的物质进行各类物质间的转化。
答案:②CO2+H2OH2CO3
③CO2+Ca(OH)2CaCO3↓+H2O
④Fe+2HClFeCl2+H2↑
⑤CaO+2HClCaCl2+H2O
⑥Ca(OH)2+2HClCaCl2+2H2O
⑦CaO+H2OCa(OH)2
常见物质的转化规律
(1)以“强制弱”规律
①强酸制弱酸
如Na2CO3+2HCl2NaCl+CO2↑+H2O;
②强碱制弱碱
如FeCl3+3NaOHFe(OH)3↓+3NaCl;
③活泼性强的金属制活泼性弱的金属
如Fe+CuSO4Cu+FeSO4。
(2)易溶制难溶
如Na2SO4溶液与BaCl2溶液反应:Na2SO4+BaCl2BaSO4↓+2NaCl。
1.我国科学家在国际上首次实现了从二氧化碳到淀粉的全合成。通常条件下,下列物质中不能与CO2发生反应的是( )
A.H2SO4 B.CaO
C.H2O D.NaOH
解析:A CO2是酸性氧化物,不能与H2SO4发生反应,可以与碱性氧化物CaO反应生成CaCO3,能够与水反应产生H2CO3,能够与碱NaOH发生反应产生Na2CO3、H2O,选A。
2.下列物质的转化中,不能通过一步反应实现的是( )
A.Mg→MgCl2 B.CuO→Cu(OH)2
C.CaCO3→CaO D.KClO3→KCl
解析:B A项,要一步实现Mg→MgCl2,可由镁与氯气反应;B项,氧化铜不能一步实现CuO→Cu(OH)2;C项,要一步实现CaCO3→CaO,煅烧就可以;D项,要一步实现KClO3→KCl,用MnO2作催化剂,加热就可以。
3.实现下列物质的转化时,只有加入酸才能实现的是( )
A.Fe2O3→Fe2(SO4)3 B.Zn→ZnCl2
C.NaOH→NaCl D.BaCl2→BaSO4
解析:A Zn除了与盐酸反应生成ZnCl2外,还可以与CuCl2反应生成ZnCl2,B项错误;NaOH与HCl、CuCl2等反应均可生成NaCl,C项错误;BaCl2与H2SO4或可溶性硫酸盐反应均可生成BaSO4,D项错误;Fe2O3是难溶性碱性氧化物,只有与酸反应才能转化成盐,A项正确。
1.下列变化属于化学变化的是( )
A.在晒干的咸菜表面出现食盐晶体
B.冰融化
C.炒菜时油锅着火
D.日光灯照明
解析:C 咸菜表面出现食盐晶体、冰融化、日光灯照明的过程中都无新物质生成,属于物理变化,炒菜时油锅着火是油的燃烧,属于化学变化,故选C。
2.钙片的主要成分是CaCO3,下列制取CaCO3的流程不正确的是( )
A.CaO CaCO3
B.Na2CO3 CaCO3
C.CaO Ca(OH)2 CaCO3
D.BaCO3 CaCO3
解析:D A项,CaO、CO2分别为碱性氧化物、酸性氧化物,两者可以反应生成CaCO3,正确;B项,Na2CO3和CaCl2生成CaCO3沉淀和氯化钠,正确;C项,CaO和水生成Ca(OH)2,Ca(OH)2和CO2生成CaCO3沉淀,正确;D项,BaCO3为沉淀,不和氯化钙反应,错误。
3.含碳元素物质间发生转化:C CO CO2 H2CO3 K2CO3,下列有关说法正确的是( )
A.CO、CO2 都是非金属氧化物,故都属于酸性氧化物
B.上述流程中涉及的化学反应类型有化合反应和复分解反应
C.由图可知,C不能一步转化为CO2
D.K2CO3 的水溶液能使酚酞变红,所以K2CO3 是碱
解析:B CO是不成盐氧化物,A错误;①②③是化合反应,④是复分解反应,B正确;氧气充足,C和氧气点燃生成CO2,C错误;K2CO3由钾离子和碳酸根离子构成,K2CO3是盐,D错误。
4.物质X可发生下列所示的两个反应,则X可能是( )
①X+碱盐+水 ②X+金属氧化物盐+水
A.CaO B.H2SO4
C.NaOH D.CO
解析:B 硫酸既能与碱发生中和反应,生成盐和水,又可以与金属氧化物反应,生成盐和水,B正确。
5.单质、氧化物、酸、碱、盐,这些不同类别的物质之间反应时可以生成盐,某同学构建了如图所示的知识网络图。
(1)请任写一种符合图中组合⑥关系的化学方程式(要求组合⑥不能与图中已有组合重复): 。
解析:(1)排除图中已有的组合关系,组合⑥可以是盐+金属,也可以是盐+非金属等其他合理组合,如盐+金属:Fe+CuSO4FeSO4+Cu。
答案:(1)Fe+CuSO4FeSO4+Cu(答案合理即可)
(2)用面粉制作馒头的发酵过程中会产生有机酸,设其化学式为HR,R表示有机酸根成分,若在蒸馒头前加入小苏打,则蒸好的馒头有很多小孔,吃起来松软可口且无酸味。请写出发生反应的化学方程式:
。
该反应所对应的是图中的哪种组合 。(从①~⑩中选序号填入)
解析:(2)碳酸氢钠与HR反应时会生成水、CO2和NaR(R的化合价是-1价),属于盐与酸发生的复分解反应,化学方程式为HR+NaHCO3CO2↑+H2O+NaR,则该反应所对应的是图中的组合①。
答案:(2)HR+NaHCO3CO2↑+H2O+NaR ①
(3)Fe3O4可看成由Fe2O3和FeO组成。请写出Fe3O4与盐酸反应的化学方程式: 。
解析:(3)根据Fe3O4的化学式也可以写成FeO·Fe2O3,所以与盐酸反应的化学方程式为Fe3O4+8HCl2FeCl3+FeCl2+4H2O或FeO·Fe2O3+8HCl2FeCl3+FeCl2+4H2O。
答案:(3)Fe3O4+8HCl2FeCl3+FeCl2+4H2O(或FeO·Fe2O3+8HClFeCl2+2FeCl3+4H2O)
