2.2.1 化学反应中能量变化的本质及转化形式-2023-2024学年高一化学鲁科版必修第二册课件(共16张PPT)
文档属性
| 名称 | 2.2.1 化学反应中能量变化的本质及转化形式-2023-2024学年高一化学鲁科版必修第二册课件(共16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 11:26:48 | ||
图片预览





文档简介
(共16张PPT)
第2节 化学反应与能量转化
第1课时 化学反应中能量变化的本质及
转化形式
第2章
化学键 化学反应规律
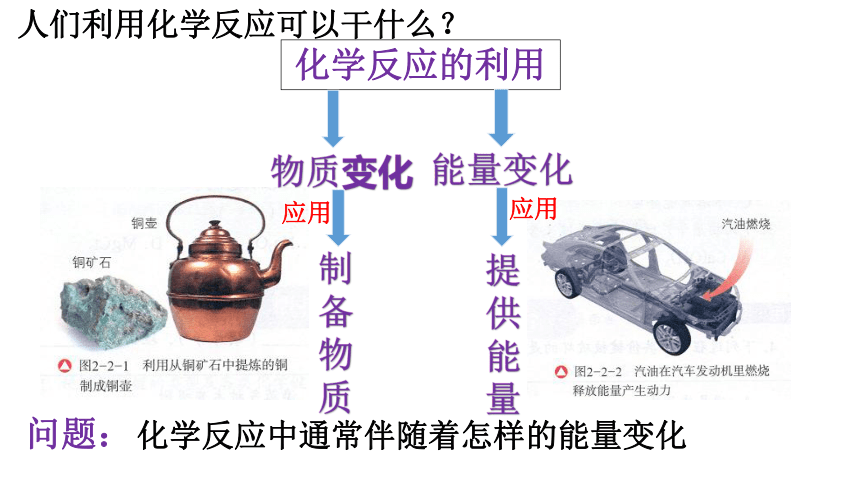
化学反应的利用
物质变化
能量变化
应用
应用
制
备
物
质
提
供
能
量
问题:
化学反应中通常伴随着怎样的能量变化
人们利用化学反应可以干什么?
思考
化学反应中能量变化的本质是什么?
化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
化学能
热能、光能
化学能
电能
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
联想·质疑
一、化学反应中能量变化的本质及转化形式
化学反应的实质是旧化学键的断裂和新化学键的形成。 旧化学键断裂需要吸收能量,新化学键形成释放能量。化学反应中,不仅有物质变化还伴随着能量变化。
活动·探究
结合课本P47页,利用所给用品小组合作设计实验方案并进行实验,感受化学反应中的能量变化。
实验用品
锌粉,铁粉,碳酸氢钠,稀盐酸,柠檬酸,蒸馏水;
试管,烧杯,温度计,胶头滴管,药匙。
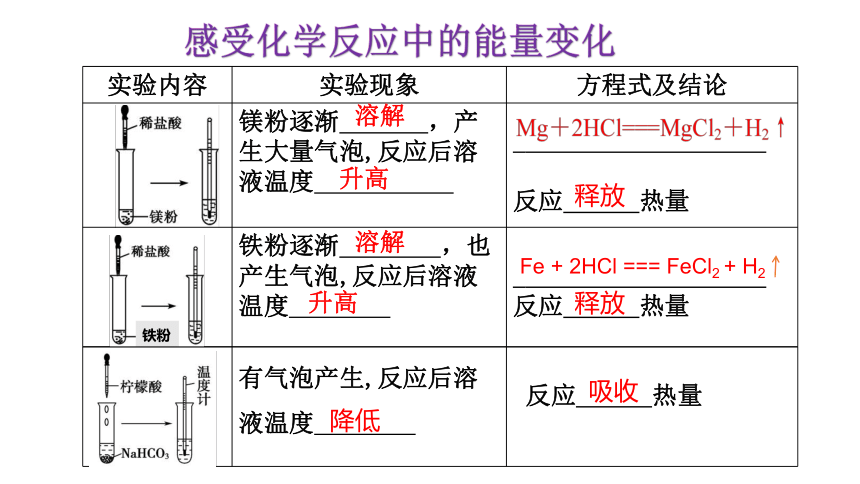
感受化学反应中的能量变化
实验内容 实验现象 方程式及结论
镁粉逐渐 ,产生大量气泡,反应后溶液温度
反应 热量
铁粉逐渐 ,也产生气泡,反应后溶液温度
反应 热量
溶解
升高
释放
铁粉
溶解
升高
Fe + 2HCl === FeCl2 + H2
释放
有气泡产生,反应后溶液温度
反应 热量
降低
吸收
吸热反应:
放热反应:
每一个化学反应都伴随着能量的变化,有的反应吸收热量,有的反应释放热量
最终表现为释放热量的化学反应
结论:
最终表现为吸收热量的化学反应
化学
反应
思考讨论
1.回顾我们学过的化学反应,常见的放热反应有哪些?吸热反应又有哪些?
2.需要加热才能发生的反应一定是吸热反应吗?反应吸热还是放热与反应条件有无关系?
常见的放热反应
①大多数化合反应
②可燃物的燃烧及缓慢氧化
③酸与碱的中和反应
④金属与酸或水的置换反应
⑤铝热反应
归纳总结:1.常见的放热反应与吸热反应
常见的吸热反应
①大多数分解反应
②铵盐与碱的反应
③碳酸氢钠与柠檬酸的反应
④高温下焦炭与水的反应
⑤碳单质与二氧化碳反应
2.需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;反应吸热还是放热与反应条件没有直接关系,吸热反应不一定需要加热。如碳酸氢钠与柠檬酸的反应
请根据下列信息判断氢气燃烧生成水蒸气时是吸收能量还是释放能量。
断键吸收的能量=436kj+249kj=685kj
成键释放的能量=930kj
生成1 molH20释放能量=930kj-685kj=245kj
释放能量>吸收能量,反应过程释放能量
思考:化学反应中为什么会有能量的变化?
反应吸热还是放热是由什么决定的?
交流·研讨(课本p48页)
1.从化学键的角度分析化学反应中能量变化(微观角度)
E1<E2
e1>e2
释放能量
吸收能量
反应物
新键形成释放能量E2
放热反应
吸热反应
旧键断裂吸收能量E1
生成物
化学反应的实质
在化学反应过程中,如果形成新化学键释放的能量大于破坏旧化学键吸收的能量,就会有一定的能量以热能、电能或光能等形式释放出来——放热反应;如果形成新化学键释放的能量小于破坏旧化学键吸收的能量,则需要吸收能量——吸热反应
问题:
不同的物质不仅组成不同、结构不同,其内部所储存的能量(化学能)也不同,是否可以从物质自身储存的化学能的变化来分析化学反应能量变化的原因呢?
结论:
2.从物质内部能量的角度分析化学反应中能量变化(宏观角度)
反应物
生成物
能量E(生)
能量E(反)
E(反) >E(生)
释放能量
E(反) < E(生)
吸收能量
热能、光能、电能
热能、光能、电能
结论:
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程。 一个确定的化学反应发生时是吸收能量还是释放能量,取决于反应物的总能量与生成物的总能量的相对大小。如果反应物的总能量大于生成物的总能量,就会向外界释放能量—放热反应;如果反应物的总能量小于生成物的总能量,就会从外界吸收能量——吸热反应
放热反应
吸热反应
反应物的总能量>生成物的总能量
反应物的总能量<生成物的总能量
化学反应中能量转化的形式
化
学
能
热能
电能
热能
光能
电能
铝热反应焊接钢轨
铝--空气海洋电池
例题 已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.反应物X和Y的总能量一定小于生成物M和N的总能量
答案 D
解析 是吸热反应还是放热反应比较的是反应物的总能量和生成物的总能量,当反应物的总能量小于生成物的总能量时,反应为吸热反应,故A错、D对;反应是吸热还是放热与反应条件无关,故B错;当破坏化学键吸收的总能量大于形成化学键所放出的总能量时为吸热反应,故C错
化学
反应
实质
特征
能量
变化
物质
变化
形式
本质
化学键
物质能量
化学能转化为热能、电能等
能量形式
反应类型
吸热反应
放热反应
(微观角度)
(宏观角度)
断键吸收能量和成键释放能量的相对大小
反应物总能量和生成物总能量相对大小
旧化学键断裂和新化学键形成
课堂小结
第2节 化学反应与能量转化
第1课时 化学反应中能量变化的本质及
转化形式
第2章
化学键 化学反应规律
化学反应的利用
物质变化
能量变化
应用
应用
制
备
物
质
提
供
能
量
问题:
化学反应中通常伴随着怎样的能量变化
人们利用化学反应可以干什么?
思考
化学反应中能量变化的本质是什么?
化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
化学能
热能、光能
化学能
电能
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
联想·质疑
一、化学反应中能量变化的本质及转化形式
化学反应的实质是旧化学键的断裂和新化学键的形成。 旧化学键断裂需要吸收能量,新化学键形成释放能量。化学反应中,不仅有物质变化还伴随着能量变化。
活动·探究
结合课本P47页,利用所给用品小组合作设计实验方案并进行实验,感受化学反应中的能量变化。
实验用品
锌粉,铁粉,碳酸氢钠,稀盐酸,柠檬酸,蒸馏水;
试管,烧杯,温度计,胶头滴管,药匙。
感受化学反应中的能量变化
实验内容 实验现象 方程式及结论
镁粉逐渐 ,产生大量气泡,反应后溶液温度
反应 热量
铁粉逐渐 ,也产生气泡,反应后溶液温度
反应 热量
溶解
升高
释放
铁粉
溶解
升高
Fe + 2HCl === FeCl2 + H2
释放
有气泡产生,反应后溶液温度
反应 热量
降低
吸收
吸热反应:
放热反应:
每一个化学反应都伴随着能量的变化,有的反应吸收热量,有的反应释放热量
最终表现为释放热量的化学反应
结论:
最终表现为吸收热量的化学反应
化学
反应
思考讨论
1.回顾我们学过的化学反应,常见的放热反应有哪些?吸热反应又有哪些?
2.需要加热才能发生的反应一定是吸热反应吗?反应吸热还是放热与反应条件有无关系?
常见的放热反应
①大多数化合反应
②可燃物的燃烧及缓慢氧化
③酸与碱的中和反应
④金属与酸或水的置换反应
⑤铝热反应
归纳总结:1.常见的放热反应与吸热反应
常见的吸热反应
①大多数分解反应
②铵盐与碱的反应
③碳酸氢钠与柠檬酸的反应
④高温下焦炭与水的反应
⑤碳单质与二氧化碳反应
2.需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;反应吸热还是放热与反应条件没有直接关系,吸热反应不一定需要加热。如碳酸氢钠与柠檬酸的反应
请根据下列信息判断氢气燃烧生成水蒸气时是吸收能量还是释放能量。
断键吸收的能量=436kj+249kj=685kj
成键释放的能量=930kj
生成1 molH20释放能量=930kj-685kj=245kj
释放能量>吸收能量,反应过程释放能量
思考:化学反应中为什么会有能量的变化?
反应吸热还是放热是由什么决定的?
交流·研讨(课本p48页)
1.从化学键的角度分析化学反应中能量变化(微观角度)
E1<E2
e1>e2
释放能量
吸收能量
反应物
新键形成释放能量E2
放热反应
吸热反应
旧键断裂吸收能量E1
生成物
化学反应的实质
在化学反应过程中,如果形成新化学键释放的能量大于破坏旧化学键吸收的能量,就会有一定的能量以热能、电能或光能等形式释放出来——放热反应;如果形成新化学键释放的能量小于破坏旧化学键吸收的能量,则需要吸收能量——吸热反应
问题:
不同的物质不仅组成不同、结构不同,其内部所储存的能量(化学能)也不同,是否可以从物质自身储存的化学能的变化来分析化学反应能量变化的原因呢?
结论:
2.从物质内部能量的角度分析化学反应中能量变化(宏观角度)
反应物
生成物
能量E(生)
能量E(反)
E(反) >E(生)
释放能量
E(反) < E(生)
吸收能量
热能、光能、电能
热能、光能、电能
结论:
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程。 一个确定的化学反应发生时是吸收能量还是释放能量,取决于反应物的总能量与生成物的总能量的相对大小。如果反应物的总能量大于生成物的总能量,就会向外界释放能量—放热反应;如果反应物的总能量小于生成物的总能量,就会从外界吸收能量——吸热反应
放热反应
吸热反应
反应物的总能量>生成物的总能量
反应物的总能量<生成物的总能量
化学反应中能量转化的形式
化
学
能
热能
电能
热能
光能
电能
铝热反应焊接钢轨
铝--空气海洋电池
例题 已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.反应物X和Y的总能量一定小于生成物M和N的总能量
答案 D
解析 是吸热反应还是放热反应比较的是反应物的总能量和生成物的总能量,当反应物的总能量小于生成物的总能量时,反应为吸热反应,故A错、D对;反应是吸热还是放热与反应条件无关,故B错;当破坏化学键吸收的总能量大于形成化学键所放出的总能量时为吸热反应,故C错
化学
反应
实质
特征
能量
变化
物质
变化
形式
本质
化学键
物质能量
化学能转化为热能、电能等
能量形式
反应类型
吸热反应
放热反应
(微观角度)
(宏观角度)
断键吸收能量和成键释放能量的相对大小
反应物总能量和生成物总能量相对大小
旧化学键断裂和新化学键形成
课堂小结
