2.3.2 化学反应的限度-2023-2024学年高一化学鲁科版必修第二册课件(共17张PPT)
文档属性
| 名称 | 2.3.2 化学反应的限度-2023-2024学年高一化学鲁科版必修第二册课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 11:29:32 | ||
图片预览






文档简介
(共17张PPT)
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第2课时 化学反应的限度
联想·质疑(课本P56页)
在利用化学反应时,我们除了关注化学反应的物质变化和能量变化外,还应关注哪些方面的问题?
硫酸是一种重要的化工产品。早在公元 7 世纪人们就开始寻找制取硫酸的方法,但是直到 1875 年德国化学家麦塞尔(R.Messel)以铂为催化剂才使硫酸生产有了较大的发展。尔后,硫酸工业生产的每次突破性进展都是因为使用了新型、高效的催化剂而取得的。那么,在硫酸的工业生产中,催化剂发挥了什么作用?在生产过程中,二氧化硫转化为三氧化硫需要氧气,但即使氧气再过量,二氧化硫也不能全部转化为三氧化硫,这是为什么?
反应快慢问题
反应程度问题
观察·思考
认识化学反应存在限度
向2mL 0.01mol L—1 KI溶液中加入1mL 0.01mol L—1 FeCl3溶液,再加入几滴 0.1mol L—1 KSCN 溶液,你认为能观察到什么现象?为什么?
预测实验现象 观察到的实验现象 结论
思考:上述实验,对你认识化学反应有什么新的启示?
2Fe3+ + 2I— 2Fe2+ + I2
溶液呈棕黄色
溶液显红色
KI溶液过量,FeCl3也不会全部转化成FeCl2,即FeCl3与KI的反应不能进行完全
=
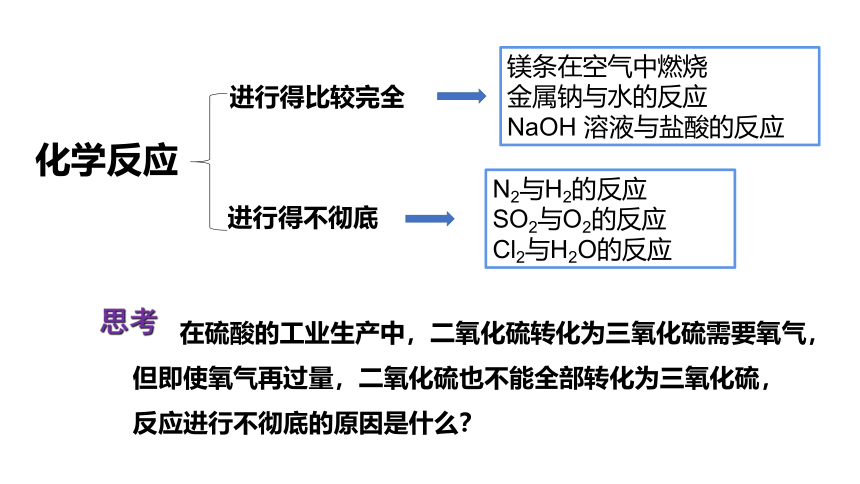
化学反应
进行得比较完全
进行得不彻底
镁条在空气中燃烧
金属钠与水的反应
NaOH 溶液与盐酸的反应
N2与H2的反应
SO2与O2的反应
Cl2与H2O的反应
在硫酸的工业生产中,二氧化硫转化为三氧化硫需要氧气,但即使氧气再过量,二氧化硫也不能全部转化为三氧化硫,反应进行不彻底的原因是什么?
思考
交流·研讨(课本P60页)
信息1:实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
观点1错误
观点2错误
某班同学以二氧化硫与氧气生成三氧化硫的反应为例,分析为什么即使氧气过量二氧化硫也不能全部转化成三氧化硫。他们在讨论过程中形成了以下三种观点,请结合相关资料对他们的观点进行分析论证。
观点 1 :只有部分二氧化硫与氧气发生反应。
观点 2 :二氧化硫全部转化成三氧化硫后,部分三氧化硫分解又生成二氧化硫。
观点 3 :二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫分解生成二氧化硫和氧气。
针对上述三种观点,他们查阅资料获得了以下信息。
Δ
2SO2+O2 2SO3
一、可逆反应
1.概念
在相同条件下同时向正、逆两个方向进行的反应
(1)可逆反应不能进行到底
(2)可逆反应结束时,反应物和生成物共存
3.特点
正反应:反应物→生成物
逆反应:生成物→反应物
2.表示方法
正反应
逆反应
可逆反应的化学方程式中,用 代替
不是可逆反应,二者的反应条件不同
1.反应2H2+O2===2H2O和2H2O===2H2↑+O2↑,是否为可逆反应?
点燃
电解
思考
2. 2SO2 + 18O2 2SO3 ,达到最大限度后,混合物中含18O的粒子有哪些?
S18O3 S18O2 18O2
交流·研讨
①反应开始时:v(正) ,v(逆)为 ,原因是反应物浓度 ,生成物浓度为0.
0
最大
减小
增大
减小
增大
不再改变
最大
②反应过程中:v(正)逐渐 ,v(逆)逐渐 ,
原因是反应物浓度逐渐 ,生成物浓度逐渐 .
③t1时刻及以后:v(正)=v(逆),反应物和生成物的浓度 .
二、化学平衡状态
1.定义
在一定条件下可逆反应进行到一定程度时,反应物和生成物浓度不再随时间的延长而发生变化(即保持不变),正反应速率和逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡
2.特征
逆
等
动
定
条件一定,平衡混合物中各物质的浓度一定(不是相等)
动态平衡,v(正)= v(逆) ≠0
3.化学平衡状态的判断方法
(1)v(正)=v(逆)
①同一物质的正、逆反应速率相等
②不同物质表示的正、逆反应速率之比等于对应化学方程式中各物质的化学计量数之比
(2)浓度保持一定
各组分的浓度、物质的量、质量不随时间的改变而改变
可逆反应达到平衡状态后,平衡状态能否改变呢?
思考
观察·思考(课本P61页)
化学平衡状态的改变
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
思考:根据观察到的实验现象可以得出什么结论?
实验现象 热水中混合气体颜色较常温下的___,冰水中混合气体颜色较常温下的___
实验结论 混合气体受热颜色变___,说明NO2浓度_____,即平衡向_________方向移动,升高温度平衡状态被破坏
混合气体被冷却颜色变___,说明NO2浓度_____,即平衡向_________方向移动,降低温度平衡状态被破坏
深
深
浅
增大
吸热反应
浅
减小
放热反应
归纳总结
三、化学平衡状态的改变
化学平衡是在一定条件下建立起来的,当条件改变时,原平衡状态被破坏,并在新的条件下建立起新的平衡状态
原平衡
(v正=v逆)
条件改变
一定时间后
平衡破坏
(v正′≠v逆′)
新平衡
(v正"=v逆")
化学平衡的移动
说明:化学平衡状态通常会受到浓度、温度、压强等因素影响,具体内容会在选择性必修1中学习
例1 有关 的说法中,不正确的是( )
A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3
B.达到平衡后,反应就停止,故正、逆反应速率均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则v正减小,v逆增大,直至v正=v逆
D.平衡时SO2、O2、SO3的分子数之比不再改变
B
提示 化学平衡是动态平衡,达到化学平衡状态时反应并没停止,只是正、逆反应速率相等
例2 一定温度下,反应A2(g)+B2(g) ??2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2的同时生成n mol AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成n mol A2的同时生成n mol B2
C
提示 在一定条件下,判断一个反应是否达到平衡,主要看正、逆反应速率是否相等,体系中各组分的浓度(或含量)是否保持不变
课堂小结
可逆反应
化学平衡状态
化学平衡状态的改变
逆、等、动、定、变
化学反应的限度
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第2课时 化学反应的限度
联想·质疑(课本P56页)
在利用化学反应时,我们除了关注化学反应的物质变化和能量变化外,还应关注哪些方面的问题?
硫酸是一种重要的化工产品。早在公元 7 世纪人们就开始寻找制取硫酸的方法,但是直到 1875 年德国化学家麦塞尔(R.Messel)以铂为催化剂才使硫酸生产有了较大的发展。尔后,硫酸工业生产的每次突破性进展都是因为使用了新型、高效的催化剂而取得的。那么,在硫酸的工业生产中,催化剂发挥了什么作用?在生产过程中,二氧化硫转化为三氧化硫需要氧气,但即使氧气再过量,二氧化硫也不能全部转化为三氧化硫,这是为什么?
反应快慢问题
反应程度问题
观察·思考
认识化学反应存在限度
向2mL 0.01mol L—1 KI溶液中加入1mL 0.01mol L—1 FeCl3溶液,再加入几滴 0.1mol L—1 KSCN 溶液,你认为能观察到什么现象?为什么?
预测实验现象 观察到的实验现象 结论
思考:上述实验,对你认识化学反应有什么新的启示?
2Fe3+ + 2I— 2Fe2+ + I2
溶液呈棕黄色
溶液显红色
KI溶液过量,FeCl3也不会全部转化成FeCl2,即FeCl3与KI的反应不能进行完全
=
化学反应
进行得比较完全
进行得不彻底
镁条在空气中燃烧
金属钠与水的反应
NaOH 溶液与盐酸的反应
N2与H2的反应
SO2与O2的反应
Cl2与H2O的反应
在硫酸的工业生产中,二氧化硫转化为三氧化硫需要氧气,但即使氧气再过量,二氧化硫也不能全部转化为三氧化硫,反应进行不彻底的原因是什么?
思考
交流·研讨(课本P60页)
信息1:实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
观点1错误
观点2错误
某班同学以二氧化硫与氧气生成三氧化硫的反应为例,分析为什么即使氧气过量二氧化硫也不能全部转化成三氧化硫。他们在讨论过程中形成了以下三种观点,请结合相关资料对他们的观点进行分析论证。
观点 1 :只有部分二氧化硫与氧气发生反应。
观点 2 :二氧化硫全部转化成三氧化硫后,部分三氧化硫分解又生成二氧化硫。
观点 3 :二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫分解生成二氧化硫和氧气。
针对上述三种观点,他们查阅资料获得了以下信息。
Δ
2SO2+O2 2SO3
一、可逆反应
1.概念
在相同条件下同时向正、逆两个方向进行的反应
(1)可逆反应不能进行到底
(2)可逆反应结束时,反应物和生成物共存
3.特点
正反应:反应物→生成物
逆反应:生成物→反应物
2.表示方法
正反应
逆反应
可逆反应的化学方程式中,用 代替
不是可逆反应,二者的反应条件不同
1.反应2H2+O2===2H2O和2H2O===2H2↑+O2↑,是否为可逆反应?
点燃
电解
思考
2. 2SO2 + 18O2 2SO3 ,达到最大限度后,混合物中含18O的粒子有哪些?
S18O3 S18O2 18O2
交流·研讨
①反应开始时:v(正) ,v(逆)为 ,原因是反应物浓度 ,生成物浓度为0.
0
最大
减小
增大
减小
增大
不再改变
最大
②反应过程中:v(正)逐渐 ,v(逆)逐渐 ,
原因是反应物浓度逐渐 ,生成物浓度逐渐 .
③t1时刻及以后:v(正)=v(逆),反应物和生成物的浓度 .
二、化学平衡状态
1.定义
在一定条件下可逆反应进行到一定程度时,反应物和生成物浓度不再随时间的延长而发生变化(即保持不变),正反应速率和逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡
2.特征
逆
等
动
定
条件一定,平衡混合物中各物质的浓度一定(不是相等)
动态平衡,v(正)= v(逆) ≠0
3.化学平衡状态的判断方法
(1)v(正)=v(逆)
①同一物质的正、逆反应速率相等
②不同物质表示的正、逆反应速率之比等于对应化学方程式中各物质的化学计量数之比
(2)浓度保持一定
各组分的浓度、物质的量、质量不随时间的改变而改变
可逆反应达到平衡状态后,平衡状态能否改变呢?
思考
观察·思考(课本P61页)
化学平衡状态的改变
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
思考:根据观察到的实验现象可以得出什么结论?
实验现象 热水中混合气体颜色较常温下的___,冰水中混合气体颜色较常温下的___
实验结论 混合气体受热颜色变___,说明NO2浓度_____,即平衡向_________方向移动,升高温度平衡状态被破坏
混合气体被冷却颜色变___,说明NO2浓度_____,即平衡向_________方向移动,降低温度平衡状态被破坏
深
深
浅
增大
吸热反应
浅
减小
放热反应
归纳总结
三、化学平衡状态的改变
化学平衡是在一定条件下建立起来的,当条件改变时,原平衡状态被破坏,并在新的条件下建立起新的平衡状态
原平衡
(v正=v逆)
条件改变
一定时间后
平衡破坏
(v正′≠v逆′)
新平衡
(v正"=v逆")
化学平衡的移动
说明:化学平衡状态通常会受到浓度、温度、压强等因素影响,具体内容会在选择性必修1中学习
例1 有关 的说法中,不正确的是( )
A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3
B.达到平衡后,反应就停止,故正、逆反应速率均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则v正减小,v逆增大,直至v正=v逆
D.平衡时SO2、O2、SO3的分子数之比不再改变
B
提示 化学平衡是动态平衡,达到化学平衡状态时反应并没停止,只是正、逆反应速率相等
例2 一定温度下,反应A2(g)+B2(g) ??2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2的同时生成n mol AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成n mol A2的同时生成n mol B2
C
提示 在一定条件下,判断一个反应是否达到平衡,主要看正、逆反应速率是否相等,体系中各组分的浓度(或含量)是否保持不变
课堂小结
可逆反应
化学平衡状态
化学平衡状态的改变
逆、等、动、定、变
化学反应的限度
