1.1.3电子云与原子轨道课件(共21张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.3电子云与原子轨道课件(共21张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 11:42:33 | ||
图片预览




文档简介
(共21张PPT)
第一节 原子结构
第三课时
电子云与原子轨道
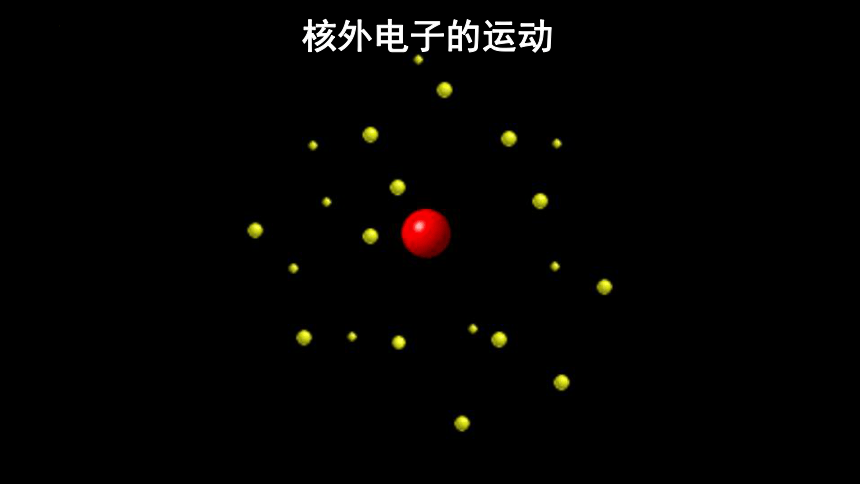
宏观物体的运动轨迹
电子的运动轨迹是什么样子?
核外电子的运动
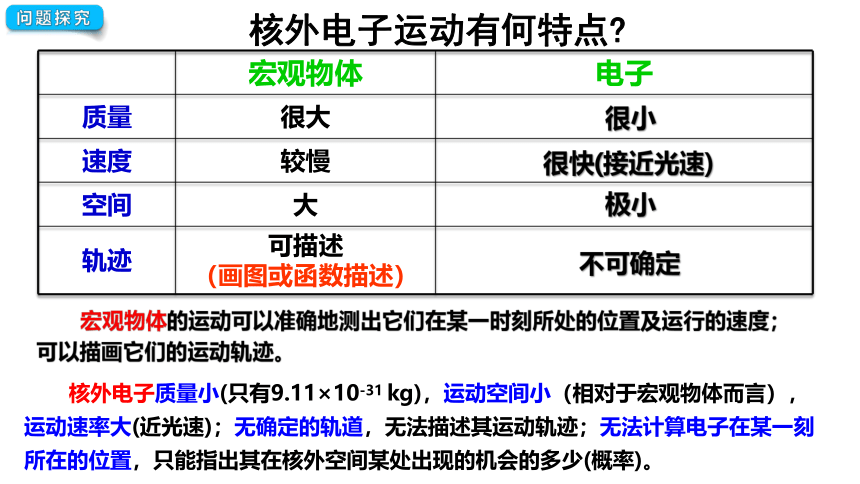
宏观物体 电子
质量 很大
速度 较慢
空间 大
轨迹 可描述 (画图或函数描述)
核外电子运动有何特点
问题探究
很小
很快(接近光速)
极小
不可确定
宏观物体的运动可以准确地测出它们在某一时刻所处的位置及运行的速度;
可以描画它们的运动轨迹。
核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速);无确定的轨道,无法描述其运动轨迹;无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会的多少(概率)。
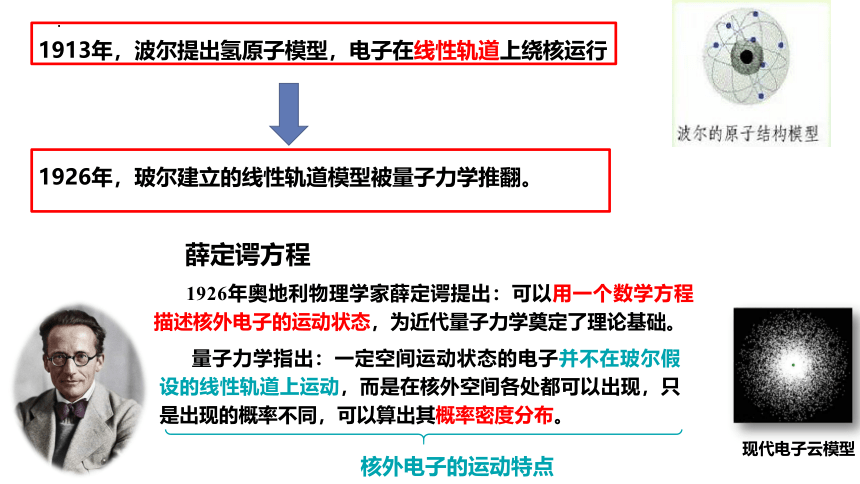
1913年,波尔提出氢原子模型,电子在线性轨道上绕核运行
1926年,玻尔建立的线性轨道模型被量子力学推翻。
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同,可以算出其概率密度分布。
薛定谔方程
1926~1935年
现代电子云模型
用P表示电子在某处出现的概率,V表示该处的体积,则
称为概率密度,用ρ表示
1.概率密度
2.氢原子的1s电子在原子核外出现的概率密度分布图
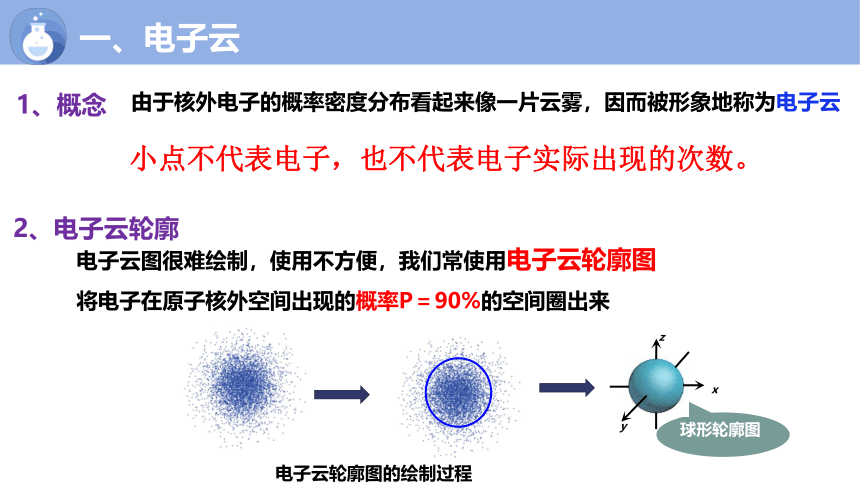
一、电子云
小点是1s电子在原子核外出现的概率密度的形象描述。小点越密,表明概率密度越大。
一、电子云
1、概念
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云
2、电子云轮廓
电子云轮廓图的绘制过程
球形轮廓图
x
y
z
将电子在原子核外空间出现的概率P=90%的空间圈出来
电子云图很难绘制,使用不方便,我们常使用电子云轮廓图
小点不代表电子,也不代表电子实际出现的次数。
3、电子云轮廓形状和大小
①s电子的电子云轮廓
同一原子的s电子的电子云轮廓图
相似点:任一能层的s电子的电子云轮廓图都是一个球形。
递变性:同一原子的能层越高,s电子云半径越大。
一、电子云
(只有1种空间运动状态)
球形
由于电子能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
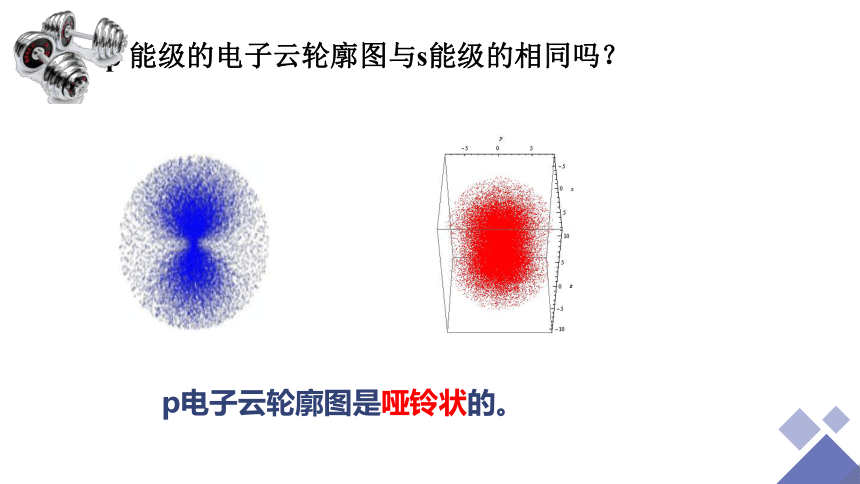
p 能级的电子云轮廓图与s能级的相同吗?
p电子云轮廓图是哑铃状的。
②p电子的电子云轮廓
Pz、Py、Px的电子云轮廓图
相似点:p电子云的形状是哑铃状的,同一能层中px、py、pz的能量相同
递变性:能层序数越大,p电子云半径越大
(x、y、z分别是p电子云在直角坐标系里的取向)
一、电子云
哑铃形
(有3种不同的空间运动状态)
d的电子云轮廓图(五个伸展方向)
f的电子云轮廓图(七个伸展方向)
一、电子云
课堂练习1:图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关认识正确的是( )
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s的电子云轮廓呈圆形,有无数对称轴
D.图1中小黑点的疏密表示某一时刻电子在核外出现概率的大小
D
二、原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
1、概念
2、轨道数
ns原子轨道1个
nd原子轨道有5个
np原子轨道有3个
nf 原子轨道有7个
常用电子云轮廓图来形象的描述电子的空间运动状态
原子轨道
几个空间运动状态=几个原子轨道
说明:①不同能层的同种能级的原子轨道形状相似,只是半径不同.
②p能级有三个原子轨道,相互垂直,分别以 px、 py、 pz表示.
在同一能层中, px、py、 pz的能量相同。
能量相同的轨道称为简并轨道
能层 能级 原子轨道数 单轨道最多容纳电子数 原子轨道名称 形状
K
L
M
N
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
1
1
1
1
1s
2s
3s
4s
球形
球形
球形
球形
3
3
3
2px、2py、2pz
3px、3py、3pz
4px、4py、4pz
哑铃形(相互垂直)
哑铃形(相互垂直)
哑铃形(相互垂直)
5
5
7
2
2
2
2
2
2
2
2
2
2
同一能级中px、py、pz的能量相同,称为简并轨道。
课堂达标
1. 下列说法中正确的是( )
A. 1s22s12p1表示的是激发态原子的核外电子排布
B. 3p2表示3p能级有两个原子轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级中的轨道数依次增多
A
如何区分原子是基态还是激发态?
课堂练习1:3px所代表的含义是( )
A.px轨道上有3个电子
B.第三电子层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第三电子层沿x轴方向伸展的P轨道
D
①同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )
③电子云图中小黑点密度的大小可表示电子的多少。( )
④p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。( )
⑤2p、3p、4p能级的轨道数依次增多( )
课堂练习2:判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
3、如图是s能级和P能级的原子轨道示意图,下列说法正确的是 ( )
A. s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.s能级的原子轨道的半径与电子层序数有关
D.Na原子的电子在11个原子轨道上高速运动
C
2、下列对核外电子运动状态的描述正确的是 ( )
电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
2px、2py、2pz轨道相互垂直,能量不相等
能层序数越大,s电子云的半径越大
在同一能级上运动的电子,其运动状态肯定相同
C
3、元素X的基态原子最外层电子排布式为nsnnpn+1,原子中能量最高的是 电子,其电子云在空间有 个
的伸展方向。
2p
3
相互垂直
4.某基态原子的核外电子排布式为[Ar]3d104s24p4,下列说法错误的是( )
A.该元素原子核外共有34个运动状态不同的电子B.该元素原子的最高能层符号为N
C.该元素原子核外电子有18种空间运动状态
D.该元素原子价层电子排布式为3d104s24p4
D
运动状态=电子数
空间运动状态=轨道数之和
第一节 原子结构
第三课时
电子云与原子轨道
宏观物体的运动轨迹
电子的运动轨迹是什么样子?
核外电子的运动
宏观物体 电子
质量 很大
速度 较慢
空间 大
轨迹 可描述 (画图或函数描述)
核外电子运动有何特点
问题探究
很小
很快(接近光速)
极小
不可确定
宏观物体的运动可以准确地测出它们在某一时刻所处的位置及运行的速度;
可以描画它们的运动轨迹。
核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速);无确定的轨道,无法描述其运动轨迹;无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会的多少(概率)。
1913年,波尔提出氢原子模型,电子在线性轨道上绕核运行
1926年,玻尔建立的线性轨道模型被量子力学推翻。
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同,可以算出其概率密度分布。
薛定谔方程
1926~1935年
现代电子云模型
用P表示电子在某处出现的概率,V表示该处的体积,则
称为概率密度,用ρ表示
1.概率密度
2.氢原子的1s电子在原子核外出现的概率密度分布图
一、电子云
小点是1s电子在原子核外出现的概率密度的形象描述。小点越密,表明概率密度越大。
一、电子云
1、概念
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云
2、电子云轮廓
电子云轮廓图的绘制过程
球形轮廓图
x
y
z
将电子在原子核外空间出现的概率P=90%的空间圈出来
电子云图很难绘制,使用不方便,我们常使用电子云轮廓图
小点不代表电子,也不代表电子实际出现的次数。
3、电子云轮廓形状和大小
①s电子的电子云轮廓
同一原子的s电子的电子云轮廓图
相似点:任一能层的s电子的电子云轮廓图都是一个球形。
递变性:同一原子的能层越高,s电子云半径越大。
一、电子云
(只有1种空间运动状态)
球形
由于电子能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
p 能级的电子云轮廓图与s能级的相同吗?
p电子云轮廓图是哑铃状的。
②p电子的电子云轮廓
Pz、Py、Px的电子云轮廓图
相似点:p电子云的形状是哑铃状的,同一能层中px、py、pz的能量相同
递变性:能层序数越大,p电子云半径越大
(x、y、z分别是p电子云在直角坐标系里的取向)
一、电子云
哑铃形
(有3种不同的空间运动状态)
d的电子云轮廓图(五个伸展方向)
f的电子云轮廓图(七个伸展方向)
一、电子云
课堂练习1:图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关认识正确的是( )
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s的电子云轮廓呈圆形,有无数对称轴
D.图1中小黑点的疏密表示某一时刻电子在核外出现概率的大小
D
二、原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
1、概念
2、轨道数
ns原子轨道1个
nd原子轨道有5个
np原子轨道有3个
nf 原子轨道有7个
常用电子云轮廓图来形象的描述电子的空间运动状态
原子轨道
几个空间运动状态=几个原子轨道
说明:①不同能层的同种能级的原子轨道形状相似,只是半径不同.
②p能级有三个原子轨道,相互垂直,分别以 px、 py、 pz表示.
在同一能层中, px、py、 pz的能量相同。
能量相同的轨道称为简并轨道
能层 能级 原子轨道数 单轨道最多容纳电子数 原子轨道名称 形状
K
L
M
N
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
1
1
1
1
1s
2s
3s
4s
球形
球形
球形
球形
3
3
3
2px、2py、2pz
3px、3py、3pz
4px、4py、4pz
哑铃形(相互垂直)
哑铃形(相互垂直)
哑铃形(相互垂直)
5
5
7
2
2
2
2
2
2
2
2
2
2
同一能级中px、py、pz的能量相同,称为简并轨道。
课堂达标
1. 下列说法中正确的是( )
A. 1s22s12p1表示的是激发态原子的核外电子排布
B. 3p2表示3p能级有两个原子轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级中的轨道数依次增多
A
如何区分原子是基态还是激发态?
课堂练习1:3px所代表的含义是( )
A.px轨道上有3个电子
B.第三电子层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第三电子层沿x轴方向伸展的P轨道
D
①同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )
③电子云图中小黑点密度的大小可表示电子的多少。( )
④p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。( )
⑤2p、3p、4p能级的轨道数依次增多( )
课堂练习2:判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
3、如图是s能级和P能级的原子轨道示意图,下列说法正确的是 ( )
A. s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.s能级的原子轨道的半径与电子层序数有关
D.Na原子的电子在11个原子轨道上高速运动
C
2、下列对核外电子运动状态的描述正确的是 ( )
电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
2px、2py、2pz轨道相互垂直,能量不相等
能层序数越大,s电子云的半径越大
在同一能级上运动的电子,其运动状态肯定相同
C
3、元素X的基态原子最外层电子排布式为nsnnpn+1,原子中能量最高的是 电子,其电子云在空间有 个
的伸展方向。
2p
3
相互垂直
4.某基态原子的核外电子排布式为[Ar]3d104s24p4,下列说法错误的是( )
A.该元素原子核外共有34个运动状态不同的电子B.该元素原子的最高能层符号为N
C.该元素原子核外电子有18种空间运动状态
D.该元素原子价层电子排布式为3d104s24p4
D
运动状态=电子数
空间运动状态=轨道数之和
