鲁教版化学九上同步课件:2.4 元素(共21张PPT)
文档属性
| 名称 | 鲁教版化学九上同步课件:2.4 元素(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 14:13:27 | ||
图片预览








文档简介
(共21张PPT)
鲁教版化学九年级(上)
4.元素
第二单元 探秘水世界
教学目标
重点难点
1.理解元素的概念并能用元素表示物质的组成,能从元素名称上识别元素的分类;知道元素与原子的区别和联系;能从宏观和微观的角度对物质的组成和结构作出合理解释。(重点)
2.记住并能正确书写常见元素的名称和元素符号,理解元素符号所表示的意文;记住单质、化合物的概念和区别,会判断常见的单质、化合物。(重点)
3.初步认识元素周期表的结构:能根据原子序数找到指定元素在元素周期表中的位置,并从中获取相关信息。(难点)
答一答
教学过程
温故知新
原子、分子和离子都是构成物质的基本粒子,它们具有微观粒子的一般性质。
1.构成物质的基本微粒有哪些?
2.原子的核电荷数、质子数与核外电子数有什么关系?
核电荷放=质子数=核外电子数
3.物质的化学性质与什么有关?
原子在化学反应中的表现主要是由原子的最外层电子数决定的。
议一议
教学过程
新课引入
自然界里形形色色的物质为什么会变化无穷、循环往复?人们很早就意识到,所有物质都是由几种亘古不变的基本成分——“元素”——组成的。然而对于这些元素究竟是什么,人们却众说纷纭。物质的基本成分——元素——究竟是什么呢?
议一议
教学过程
新知新授
活动天地2——4
元素与元素符号
组成物质世界的元素究竟是什么?
古人曾经认为水是组成物质世界的元素之一,认为它普遍存在、不易变化。根据你对水的认识谈谈这种观点是否正确。
小明认为“所有的物质都是由原子、分子、离子等基本粒子构成的,这些基本粒子才是组成物质的元素”。
小丽认为“分子在化学变化中可以再分,是容易变的;而原子是不变的,并且分子是由原子构成的,离子是由原子得失电子后形成的,所以原子才是组成世界万物的元素”。
请提出你的观点。
记一记
教学过程
新知新授
原子以不同数量、不同种类、按照不同的方式结合,构成了多种多样的物质。虽说大千世界中物质种类繁多、千变万化,但是构成它们的原子不易变化。所以,原子才能作为组成物质的基本成分——元素。
元素的概念
元素与元素符号
科学研究表明:原子核中质子数相同的原子在化学变化中表现出来的性质几乎完全相同。
具有相同质子数的原子归为一类,每一类原子称为一种元素。
对元素的概念理解
①元素的概念中的“一类原子”是指质子数相同、中子数不同原子,如碳12和碳13属于同种元素的原子。
②质子数相同的粒子不一定属于同种元素,如氖原子(Ne)与水分子(H2O)的质子数均为10,但二者不属于同种元素。
记一记
教学过程
新知新授
元素的概念
元素与元素符号
③原子与其对应的离子属于同种元素,如 Fe、Fe2+、Fe3+ 属于同种元素。
④元素是宏观概念,只讲种类,不讲个数,如不能说“两个氧无素、一个碳元素”等。
⑤原子中各微粒数量的意义:质子数决定元素的种类;质子数和中子数共同决定原子的种类;核外电子数,特别是最外层电子数决定元素的化学性质
记一记
教学过程
新知新授
元素的概念
元素与元素符号
元素与原子关系
元素 原子
概念 具有相同质子数(即核电荷数)的一类原子的总称 化学变化中的最小粒子
区别 ①元素是宏观概念,只讲种类,不讲个数和大小 ②元素只能组成物质,不能 构成分子和原子 ③在化学变化中,元素的种 类和质量保持不变 ①原子是微观概念,既讲种
类,又讲个数和大小
②原子可构成分子,也可直
接构成物质
③在化学变化中,原子的种
类、个数、质量保持不变
联系 ①原子的质子数决定元素的种类,原子的最外层电子数 决定元素的化学性质 ②元素是同一类原子的总称,原子是构成元素的基本单 元,两者是总体与个体的关系
记一记
教学过程
新知新授
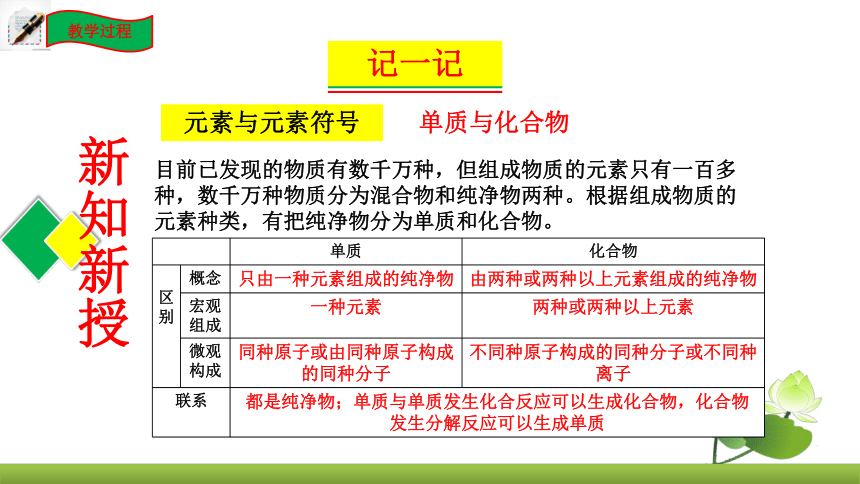
单质与化合物
元素与元素符号
目前已发现的物质有数千万种,但组成物质的元素只有一百多种,数千万种物质分为混合物和纯净物两种。根据组成物质的元素种类,有把纯净物分为单质和化合物。
单质 化合物
区别 概念 只由一种元素组成的纯净物 由两种或两种以上元素组成的纯净物
宏观组成 一种元素 两种或两种以上元素
微观构成 同种原子或由同种原子构成的同种分子 不同种原子构成的同种分子或不同种离子
联系 都是纯净物;单质与单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质
记一记
教学过程
新知新授
物质的分类
元素与元素符号
纯净物
(有一种物质组成)
单质
金属单质
化合物
混合物(有两种或两种以上物质组成)
物质
非金属单质
稀有气体单质
记住:按质量计算,地壳中含量最多的五种元素分别是氧、硅、铝、铁、钙。
记一记
教学过程
新知新授
元素符号
元素与元素符号
为方便区分和交流,国际上规定每种元素都采用统一的符号来表示,这种符号叫作元素符号。
(1)元素符号的概念
①由一个字母表示的元素符号要大写。如 C、H、O、P、K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如 Fe、Mg、Ca、Zn、Si。
(2)元素符号的写法
(3)元素符号的意义
记一记
教学过程
新知新授
元素符号
元素与元素符号
①宏观意义:表示一种元素,如H表示氢元素;若物质是由原子直接构成的,还表示这种物质,如Fe表示铁这种物质。
②微观意义:表示某元素的一个原子,如O表示一个氧原子。
注意:元素符号既有宏观意义,又有微观意义,但当元素符号前面加上具体的数字时,则只具有微观意义,只能表示某元素的几个原子。如2H只能表示2个氢原子。
记住:课本第47页“一些常见元素的名称、符号和原子结构示意图。
记一记
教学过程
新知新授
元素周期表简介
元素与元素符号
(1)元素周期表的概念
把目前已发现并被正式命名的元素按照原子核内质子数由小到大的顺序排列而成的表,叫作元素周期表。
(2)元素周期表的结构
(1)元素周期表共有7个横行、18个纵行,每一个横行叫作一个周期,每一个纵行叫作一个族(8、9、10三个纵行共同组成一个族)。
(2)在元素周期表中,每一种元素均占据一格。从每一格中获取的元素信息如下图所示(以氢元素为例)。此外,在元素周|表中,还用不同的颜色对金属元素、非金属元素做了区分。
元素符号
元素名称
相对原子质量
原子序数
记一记
教学过程
新知新授
元素周期表简介
元素与元素符号
(3)元素周期表的规律
(1)同周期元素原子电子层数相同,且电子层数=周期数。同主族元素的最外层电子数相同,且最外层电子数=族序数
(2)同周期元素从左到右,核电荷数逐渐增大(原子序数=核电荷数=核内质子数=核外电子数)。原子最外层电子数逐渐增多。同周期的元素从金属元素开始,逐渐过渡到非金属元素,最后以稀有气体元素结束。
(3)同族元素原子电子层数从上到下逐渐增多,原子半径逐渐增大。最外层电子数相同,化学性质相似。
元素周期表简介
元素与元素符号
记一记
教学过程
新知新授
元素周期表中元素分为金属、非金属和稀有气体三类。其中“钅”为偏旁的是金属(汞也为金属);以“气”、“石”、“氵”为偏旁的为非金属;氦、氖、氩、氪、氙、氡为稀有气体。
(4)元素周期表中元素的分类
(5)元素周期表中物质的构成
直接由原子构成的物质有金属、稀有气体(氦、氖、氩、氪、氙、氡属于单原子分子)、原子晶体如石墨、金刚石、晶体硅、二氧化铝等。
由原子构成分子,再由分子构成的物质有氧气、氢气等。
典例解析
教学过程
学以致用
【典例1】 生活中的“加碘盐”“含氟牙膏”,“加铁酱油”,其中的“碘”“氟”“铁”指的是( )
A.原子 B.离子 C.元素 D.分子
C
【典例2】铝(Al)是地壳中含量最多的金属元素,在生活中有着广泛的应用。元素符号“Al”不能表示( )
A.铝元素 B.金属铝
C.一个铝原子 D.一个铝分子
D
【典例3】下列按单质、化合物、混合物的顺序排列的一组是( )
A.汞、氧化汞、高锰酸钾 B液氧、空气、五氧化二磷
C糖水、氯化钠、硫黄 D.氩气、冰水混合物、海水
D
典例解析
教学过程
学以致用
【典例4】 下表是元素周期表的一部分,请根据表中信息回答下列问题:
典例解析
教学过程
学以致用
(1)钠元素的相对原子质量是 ,在化学反应中容易 (填“得到”或“失去”)电子。
(2)由原子序数为8和12的元素形成的离子符号分别为 、 。
(3)第二、三周期的元素从左至右排列所遵循的规律是 (写一种)。
22.99
失去
O2-
Mg2+
核电荷数逐渐增大
原子最外层电子数逐渐增多
由近代开始过度到非金属,最后以稀有气体结束。
用心记记
教学过程
课堂小结
1.元素是组成物质的基本成分,人们把质子数相同的一类原子称为一种元素。国际上通常采用元素符号表示每一种元素。
2.只由一种元素组成的纯净物属于单质,由两种或两种以上的元素组成的纯净物属于化合物。
3.元素周期表是学习和研究化学的重要工具。
分层作业
教学过程
课后巩固
完成课本相关作业
教学过程
结束新课
感谢聆听
鲁教版化学九年级(上)
4.元素
第二单元 探秘水世界
教学目标
重点难点
1.理解元素的概念并能用元素表示物质的组成,能从元素名称上识别元素的分类;知道元素与原子的区别和联系;能从宏观和微观的角度对物质的组成和结构作出合理解释。(重点)
2.记住并能正确书写常见元素的名称和元素符号,理解元素符号所表示的意文;记住单质、化合物的概念和区别,会判断常见的单质、化合物。(重点)
3.初步认识元素周期表的结构:能根据原子序数找到指定元素在元素周期表中的位置,并从中获取相关信息。(难点)
答一答
教学过程
温故知新
原子、分子和离子都是构成物质的基本粒子,它们具有微观粒子的一般性质。
1.构成物质的基本微粒有哪些?
2.原子的核电荷数、质子数与核外电子数有什么关系?
核电荷放=质子数=核外电子数
3.物质的化学性质与什么有关?
原子在化学反应中的表现主要是由原子的最外层电子数决定的。
议一议
教学过程
新课引入
自然界里形形色色的物质为什么会变化无穷、循环往复?人们很早就意识到,所有物质都是由几种亘古不变的基本成分——“元素”——组成的。然而对于这些元素究竟是什么,人们却众说纷纭。物质的基本成分——元素——究竟是什么呢?
议一议
教学过程
新知新授
活动天地2——4
元素与元素符号
组成物质世界的元素究竟是什么?
古人曾经认为水是组成物质世界的元素之一,认为它普遍存在、不易变化。根据你对水的认识谈谈这种观点是否正确。
小明认为“所有的物质都是由原子、分子、离子等基本粒子构成的,这些基本粒子才是组成物质的元素”。
小丽认为“分子在化学变化中可以再分,是容易变的;而原子是不变的,并且分子是由原子构成的,离子是由原子得失电子后形成的,所以原子才是组成世界万物的元素”。
请提出你的观点。
记一记
教学过程
新知新授
原子以不同数量、不同种类、按照不同的方式结合,构成了多种多样的物质。虽说大千世界中物质种类繁多、千变万化,但是构成它们的原子不易变化。所以,原子才能作为组成物质的基本成分——元素。
元素的概念
元素与元素符号
科学研究表明:原子核中质子数相同的原子在化学变化中表现出来的性质几乎完全相同。
具有相同质子数的原子归为一类,每一类原子称为一种元素。
对元素的概念理解
①元素的概念中的“一类原子”是指质子数相同、中子数不同原子,如碳12和碳13属于同种元素的原子。
②质子数相同的粒子不一定属于同种元素,如氖原子(Ne)与水分子(H2O)的质子数均为10,但二者不属于同种元素。
记一记
教学过程
新知新授
元素的概念
元素与元素符号
③原子与其对应的离子属于同种元素,如 Fe、Fe2+、Fe3+ 属于同种元素。
④元素是宏观概念,只讲种类,不讲个数,如不能说“两个氧无素、一个碳元素”等。
⑤原子中各微粒数量的意义:质子数决定元素的种类;质子数和中子数共同决定原子的种类;核外电子数,特别是最外层电子数决定元素的化学性质
记一记
教学过程
新知新授
元素的概念
元素与元素符号
元素与原子关系
元素 原子
概念 具有相同质子数(即核电荷数)的一类原子的总称 化学变化中的最小粒子
区别 ①元素是宏观概念,只讲种类,不讲个数和大小 ②元素只能组成物质,不能 构成分子和原子 ③在化学变化中,元素的种 类和质量保持不变 ①原子是微观概念,既讲种
类,又讲个数和大小
②原子可构成分子,也可直
接构成物质
③在化学变化中,原子的种
类、个数、质量保持不变
联系 ①原子的质子数决定元素的种类,原子的最外层电子数 决定元素的化学性质 ②元素是同一类原子的总称,原子是构成元素的基本单 元,两者是总体与个体的关系
记一记
教学过程
新知新授
单质与化合物
元素与元素符号
目前已发现的物质有数千万种,但组成物质的元素只有一百多种,数千万种物质分为混合物和纯净物两种。根据组成物质的元素种类,有把纯净物分为单质和化合物。
单质 化合物
区别 概念 只由一种元素组成的纯净物 由两种或两种以上元素组成的纯净物
宏观组成 一种元素 两种或两种以上元素
微观构成 同种原子或由同种原子构成的同种分子 不同种原子构成的同种分子或不同种离子
联系 都是纯净物;单质与单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质
记一记
教学过程
新知新授
物质的分类
元素与元素符号
纯净物
(有一种物质组成)
单质
金属单质
化合物
混合物(有两种或两种以上物质组成)
物质
非金属单质
稀有气体单质
记住:按质量计算,地壳中含量最多的五种元素分别是氧、硅、铝、铁、钙。
记一记
教学过程
新知新授
元素符号
元素与元素符号
为方便区分和交流,国际上规定每种元素都采用统一的符号来表示,这种符号叫作元素符号。
(1)元素符号的概念
①由一个字母表示的元素符号要大写。如 C、H、O、P、K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如 Fe、Mg、Ca、Zn、Si。
(2)元素符号的写法
(3)元素符号的意义
记一记
教学过程
新知新授
元素符号
元素与元素符号
①宏观意义:表示一种元素,如H表示氢元素;若物质是由原子直接构成的,还表示这种物质,如Fe表示铁这种物质。
②微观意义:表示某元素的一个原子,如O表示一个氧原子。
注意:元素符号既有宏观意义,又有微观意义,但当元素符号前面加上具体的数字时,则只具有微观意义,只能表示某元素的几个原子。如2H只能表示2个氢原子。
记住:课本第47页“一些常见元素的名称、符号和原子结构示意图。
记一记
教学过程
新知新授
元素周期表简介
元素与元素符号
(1)元素周期表的概念
把目前已发现并被正式命名的元素按照原子核内质子数由小到大的顺序排列而成的表,叫作元素周期表。
(2)元素周期表的结构
(1)元素周期表共有7个横行、18个纵行,每一个横行叫作一个周期,每一个纵行叫作一个族(8、9、10三个纵行共同组成一个族)。
(2)在元素周期表中,每一种元素均占据一格。从每一格中获取的元素信息如下图所示(以氢元素为例)。此外,在元素周|表中,还用不同的颜色对金属元素、非金属元素做了区分。
元素符号
元素名称
相对原子质量
原子序数
记一记
教学过程
新知新授
元素周期表简介
元素与元素符号
(3)元素周期表的规律
(1)同周期元素原子电子层数相同,且电子层数=周期数。同主族元素的最外层电子数相同,且最外层电子数=族序数
(2)同周期元素从左到右,核电荷数逐渐增大(原子序数=核电荷数=核内质子数=核外电子数)。原子最外层电子数逐渐增多。同周期的元素从金属元素开始,逐渐过渡到非金属元素,最后以稀有气体元素结束。
(3)同族元素原子电子层数从上到下逐渐增多,原子半径逐渐增大。最外层电子数相同,化学性质相似。
元素周期表简介
元素与元素符号
记一记
教学过程
新知新授
元素周期表中元素分为金属、非金属和稀有气体三类。其中“钅”为偏旁的是金属(汞也为金属);以“气”、“石”、“氵”为偏旁的为非金属;氦、氖、氩、氪、氙、氡为稀有气体。
(4)元素周期表中元素的分类
(5)元素周期表中物质的构成
直接由原子构成的物质有金属、稀有气体(氦、氖、氩、氪、氙、氡属于单原子分子)、原子晶体如石墨、金刚石、晶体硅、二氧化铝等。
由原子构成分子,再由分子构成的物质有氧气、氢气等。
典例解析
教学过程
学以致用
【典例1】 生活中的“加碘盐”“含氟牙膏”,“加铁酱油”,其中的“碘”“氟”“铁”指的是( )
A.原子 B.离子 C.元素 D.分子
C
【典例2】铝(Al)是地壳中含量最多的金属元素,在生活中有着广泛的应用。元素符号“Al”不能表示( )
A.铝元素 B.金属铝
C.一个铝原子 D.一个铝分子
D
【典例3】下列按单质、化合物、混合物的顺序排列的一组是( )
A.汞、氧化汞、高锰酸钾 B液氧、空气、五氧化二磷
C糖水、氯化钠、硫黄 D.氩气、冰水混合物、海水
D
典例解析
教学过程
学以致用
【典例4】 下表是元素周期表的一部分,请根据表中信息回答下列问题:
典例解析
教学过程
学以致用
(1)钠元素的相对原子质量是 ,在化学反应中容易 (填“得到”或“失去”)电子。
(2)由原子序数为8和12的元素形成的离子符号分别为 、 。
(3)第二、三周期的元素从左至右排列所遵循的规律是 (写一种)。
22.99
失去
O2-
Mg2+
核电荷数逐渐增大
原子最外层电子数逐渐增多
由近代开始过度到非金属,最后以稀有气体结束。
用心记记
教学过程
课堂小结
1.元素是组成物质的基本成分,人们把质子数相同的一类原子称为一种元素。国际上通常采用元素符号表示每一种元素。
2.只由一种元素组成的纯净物属于单质,由两种或两种以上的元素组成的纯净物属于化合物。
3.元素周期表是学习和研究化学的重要工具。
分层作业
教学过程
课后巩固
完成课本相关作业
教学过程
结束新课
感谢聆听
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
