鲁教版化学九上5.1 化学反应中的质量守恒(第1课时)同步课件(共21张PPT)
文档属性
| 名称 | 鲁教版化学九上5.1 化学反应中的质量守恒(第1课时)同步课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 14:30:11 | ||
图片预览





文档简介
(共21张PPT)
鲁教版化学九年级(上)
1.化学反应中的质量守恒
第五单元 定量研究化学反应
第1课时 质量守恒定律
教学目标
重点难点
1.通过实验探究,理解并描述质量守恒定律的内容。(重点)
2.能利用质量守恒定律解释实验现象并解决问题。(难点)
答一答
教学过程
温故知新
化学反应中,有新的物质产生,那么新物质的元素种类,有什么变化?请举例说明。
化学变化中,物质的元素种类不会发生变化。
例如过氧化氢由氢元素和氧元素组成,过氧化氢分解后的水和氧气,仍然是由氢元素和氧元素组成。
议一议
教学过程
新课引入
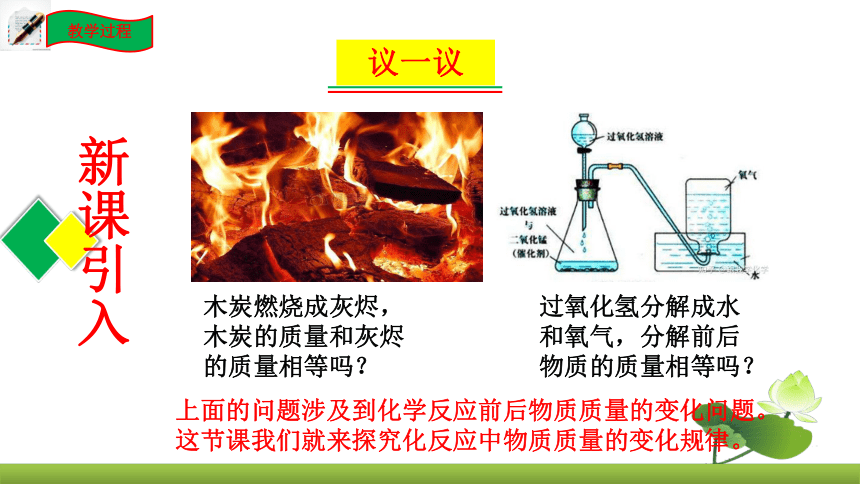
木炭燃烧成灰烬,木炭的质量和灰烬的质量相等吗?
过氧化氢分解成水和氧气,分解前后物质的质量相等吗?
上面的问题涉及到化学反应前后物质质量的变化问题。这节课我们就来探究化反应中物质质量的变化规律。
议一议
教学过程
新知新授
问题讨论
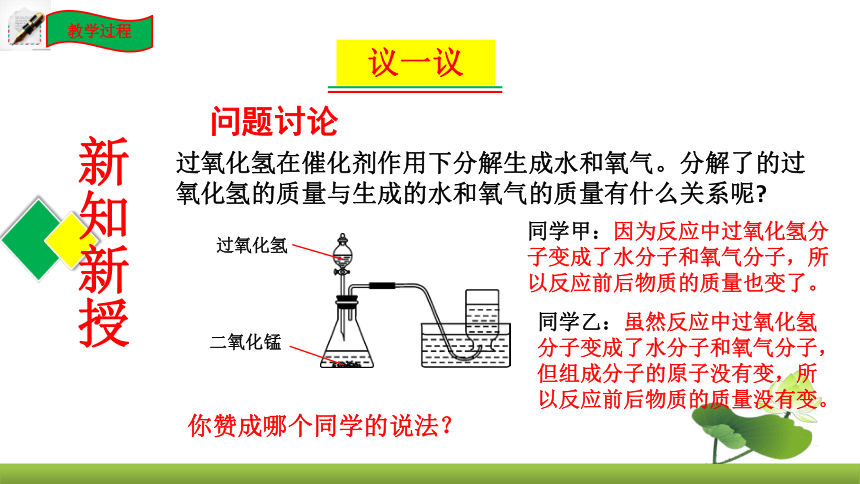
过氧化氢在催化剂作用下分解生成水和氧气。分解了的过氧化氢的质量与生成的水和氧气的质量有什么关系呢
过氧化氢
二氧化锰
同学甲:因为反应中过氧化氢分子变成了水分子和氧气分子,所以反应前后物质的质量也变了。
同学乙:虽然反应中过氧化氢分子变成了水分子和氧气分子,但组成分子的原子没有变,所以反应前后物质的质量没有变。
你赞成哪个同学的说法?
议一议
教学过程
新知新授
问题讨论
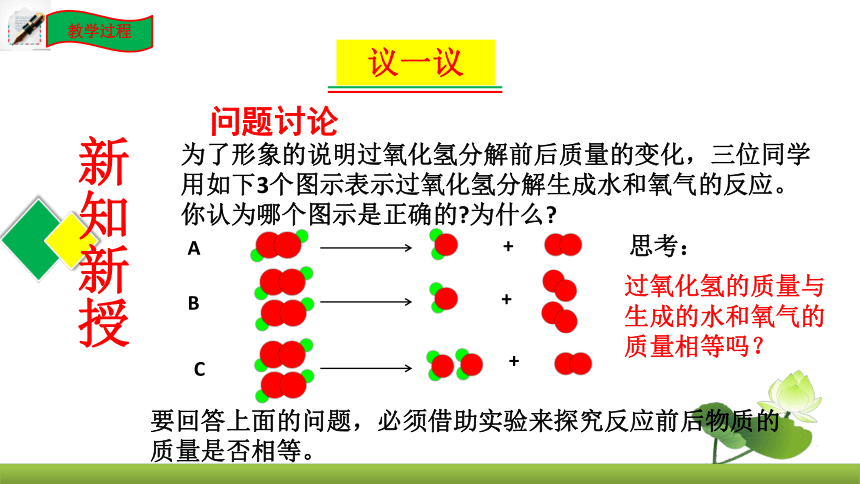
为了形象的说明过氧化氢分解前后质量的变化,三位同学用如下3个图示表示过氧化氢分解生成水和氧气的反应。你认为哪个图示是正确的 为什么
A
+
B
+
C
+
思考:
过氧化氢的质量与生成的水和氧气的质量相等吗?
要回答上面的问题,必须借助实验来探究反应前后物质的质量是否相等。
做一做
教学过程
新知新授
实验探究1
利用盐酸与大理石来探究反应前后物质的质量是否相等。
1.药品:盐酸(HCl)、大理石(主要成分CaCO3)
2.反应原理:碳酸钙 + 盐酸 氯化钙 + 二氧化碳 + 水
HCl CaCO3 CaCl CO2 H2O
3.仪器装置:
方案一
方案二
做一做
教学过程
新知新授
实验探究1
4.实验步骤:
①称量反应前反应物和反应容器的总质量;
②将试管内的溶液倒入烧杯或锥形瓶中(试管仍留在烧杯或锥形瓶中),使反应发生;
③称量反应后物质和反应容器的总质量。
5.实验现象:
方案一
固体减少,有气泡产生;天平失去平衡,
反应后的质量小于反应前的质量。
方案二
固体减少,有气泡产生,气球膨胀;天平保持平衡,反应前后质量相等。
做一做
教学过程
新知新授
实验探究1
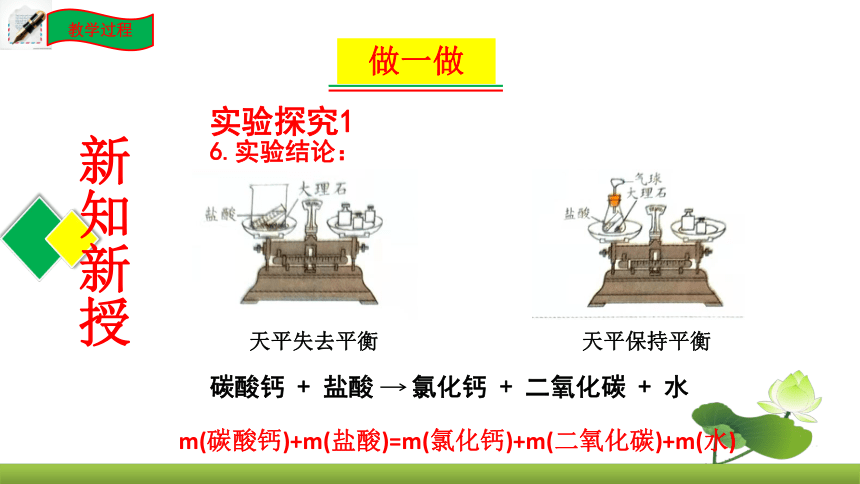
6.实验结论:
天平失去平衡
天平保持平衡
m(碳酸钙)+m(盐酸)=m(氯化钙)+m(二氧化碳)+m(水)
碳酸钙 + 盐酸 氯化钙 + 二氧化碳 + 水
做一做
教学过程
新知新授
实验探究2
利用氢氧化钠溶液与硫酸铜溶液反应来探究反应前后物质的质量是否相等。
1.药品:氢氧化钠溶液(NaOH)、硫酸铜溶液(CuSO4)
2.反应原理:氢氧化钠 + 硫酸铜 硫酸钠 + 氢氧化铜
NaOH CuSO4 Na2SO4 Cu(OH)2
3.仪器装置:
做一做
教学过程
新知新授
实验探究2
4.实验步骤:
①称量反应前反应物和反应容器的总质量;
②将小试管倾斜,使硫酸铜溶液与氢氧化钠溶液混合;
③称量反应后物质和反应容器的总质量。
5.实验现象:
产生蓝色沉淀;天平保持平衡,反应前后质量相等。
做一做
教学过程
新知新授
实验探究2
6.实验结论:
天平保持平衡
m(氢氧化钠)+m(硫酸铜)=m(硫酸钠)+m(氢氧化铜)
氢氧化钠 + 硫酸铜 硫酸钠 + 氢氧化铜
做一做
教学过程
新知新授
实验探究3
利用白磷在空气中燃烧来探究反应前后物质的质量是否相等。
1.药品:白磷(P)
2.反应原理:磷 + 氧气 五氧化二磷
P O2 P2O5
3.仪器装置:
方案一
方案二
做一做
教学过程
新知新授
实验探究3
4.实验步骤:
①称量反应前反应物和反应容器的总质量;
②用放大镜聚焦太阳光引燃白磷;
③称量反应后物质和反应容器的总质量
5.实验现象:
方案一
白磷燃烧,锥形瓶内有大量白烟;天平失去平衡,反应后的质量大于反应前的质量
方案二
白磷燃烧,锥形瓶内有有大量白烟;气球先鼓起后又变瘪;天平保持平衡,反应前后质量相等
做一做
教学过程
新知新授
实验探究3
6.实验结论:
天平失去平衡
天平保持平衡
m(磷)+m(氧气)=m(五氧化二磷)
记一记
教学过程
新知新授
实验总结
根据前面的实验探究,我们可以得出结论:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
质量守恒定律是自然科学的基本定律之一,它告诉我们化学变化只能改变物质的种类而不能改变物质的总质量。
m参加反应的所有物质质量=m生成的所有物质的质量
3.计入质量总和的是参加化学反应的反应物质量,过量的反应物不应计算在内。例如10克氢气与80克氧气刚好反应生成90克水,但15克氢气与80克氧气反应生成的水不是95克,仍然是80克水。
记一记
教学过程
新知新授
实验总结
使用质量守恒定律注意事项:
1.质量守恒定律适用于一切化学反应。
2.不能用质量守恒定律解释非化学变化(物理变化)。例如5克糖+15克水=20克糖水
做一做
教学过程
新知应用
判断下列说法是否正确:
(1) 根据质量守恒定律可知10g食盐加入10g水中可得到20克盐水
(2) 铝条燃烧后增加的质量等于参加反应的氧气的质量
(3) 过氧化氢和烧杯共重200g,等完全分解所后质量仍为200克
(4)根据质量守恒定律可知15g碳和15g氧气完全反应生成30g 二氧化碳
(5)蒸发液态空气所得各气体的质量总和等于液态空气的质量,这有力地证实了质量守恒定律
(6)电解100克水,完全分解后,得到是氢气和氧气一定是100克
记一记
教学过程
课堂小结
今天学到了什么?
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
3.计入质量总和的是参加化学反应的反应物质量,过量的反应物不应计算在内。例如10克氢气与80克氧气刚好反应生成90克水,但15克氢气与80克氧气反应生成的水不水95克,仍然是80克水。
1.质量守恒定律适用于一切化学反应。
2.不能用质量守恒定律解释非化学变化(物理变化)。例如5克糖+15克水=20克糖水
做一做
教学过程
课后巩固
现有m克过氧化氢溶液跟n克MnO2混合,完全反应后,称量剩余液体和固体物质的总质量是a克,求生成氧气的质量为多少克。
教学过程
结束新课
感谢聆听
鲁教版化学九年级(上)
1.化学反应中的质量守恒
第五单元 定量研究化学反应
第1课时 质量守恒定律
教学目标
重点难点
1.通过实验探究,理解并描述质量守恒定律的内容。(重点)
2.能利用质量守恒定律解释实验现象并解决问题。(难点)
答一答
教学过程
温故知新
化学反应中,有新的物质产生,那么新物质的元素种类,有什么变化?请举例说明。
化学变化中,物质的元素种类不会发生变化。
例如过氧化氢由氢元素和氧元素组成,过氧化氢分解后的水和氧气,仍然是由氢元素和氧元素组成。
议一议
教学过程
新课引入
木炭燃烧成灰烬,木炭的质量和灰烬的质量相等吗?
过氧化氢分解成水和氧气,分解前后物质的质量相等吗?
上面的问题涉及到化学反应前后物质质量的变化问题。这节课我们就来探究化反应中物质质量的变化规律。
议一议
教学过程
新知新授
问题讨论
过氧化氢在催化剂作用下分解生成水和氧气。分解了的过氧化氢的质量与生成的水和氧气的质量有什么关系呢
过氧化氢
二氧化锰
同学甲:因为反应中过氧化氢分子变成了水分子和氧气分子,所以反应前后物质的质量也变了。
同学乙:虽然反应中过氧化氢分子变成了水分子和氧气分子,但组成分子的原子没有变,所以反应前后物质的质量没有变。
你赞成哪个同学的说法?
议一议
教学过程
新知新授
问题讨论
为了形象的说明过氧化氢分解前后质量的变化,三位同学用如下3个图示表示过氧化氢分解生成水和氧气的反应。你认为哪个图示是正确的 为什么
A
+
B
+
C
+
思考:
过氧化氢的质量与生成的水和氧气的质量相等吗?
要回答上面的问题,必须借助实验来探究反应前后物质的质量是否相等。
做一做
教学过程
新知新授
实验探究1
利用盐酸与大理石来探究反应前后物质的质量是否相等。
1.药品:盐酸(HCl)、大理石(主要成分CaCO3)
2.反应原理:碳酸钙 + 盐酸 氯化钙 + 二氧化碳 + 水
HCl CaCO3 CaCl CO2 H2O
3.仪器装置:
方案一
方案二
做一做
教学过程
新知新授
实验探究1
4.实验步骤:
①称量反应前反应物和反应容器的总质量;
②将试管内的溶液倒入烧杯或锥形瓶中(试管仍留在烧杯或锥形瓶中),使反应发生;
③称量反应后物质和反应容器的总质量。
5.实验现象:
方案一
固体减少,有气泡产生;天平失去平衡,
反应后的质量小于反应前的质量。
方案二
固体减少,有气泡产生,气球膨胀;天平保持平衡,反应前后质量相等。
做一做
教学过程
新知新授
实验探究1
6.实验结论:
天平失去平衡
天平保持平衡
m(碳酸钙)+m(盐酸)=m(氯化钙)+m(二氧化碳)+m(水)
碳酸钙 + 盐酸 氯化钙 + 二氧化碳 + 水
做一做
教学过程
新知新授
实验探究2
利用氢氧化钠溶液与硫酸铜溶液反应来探究反应前后物质的质量是否相等。
1.药品:氢氧化钠溶液(NaOH)、硫酸铜溶液(CuSO4)
2.反应原理:氢氧化钠 + 硫酸铜 硫酸钠 + 氢氧化铜
NaOH CuSO4 Na2SO4 Cu(OH)2
3.仪器装置:
做一做
教学过程
新知新授
实验探究2
4.实验步骤:
①称量反应前反应物和反应容器的总质量;
②将小试管倾斜,使硫酸铜溶液与氢氧化钠溶液混合;
③称量反应后物质和反应容器的总质量。
5.实验现象:
产生蓝色沉淀;天平保持平衡,反应前后质量相等。
做一做
教学过程
新知新授
实验探究2
6.实验结论:
天平保持平衡
m(氢氧化钠)+m(硫酸铜)=m(硫酸钠)+m(氢氧化铜)
氢氧化钠 + 硫酸铜 硫酸钠 + 氢氧化铜
做一做
教学过程
新知新授
实验探究3
利用白磷在空气中燃烧来探究反应前后物质的质量是否相等。
1.药品:白磷(P)
2.反应原理:磷 + 氧气 五氧化二磷
P O2 P2O5
3.仪器装置:
方案一
方案二
做一做
教学过程
新知新授
实验探究3
4.实验步骤:
①称量反应前反应物和反应容器的总质量;
②用放大镜聚焦太阳光引燃白磷;
③称量反应后物质和反应容器的总质量
5.实验现象:
方案一
白磷燃烧,锥形瓶内有大量白烟;天平失去平衡,反应后的质量大于反应前的质量
方案二
白磷燃烧,锥形瓶内有有大量白烟;气球先鼓起后又变瘪;天平保持平衡,反应前后质量相等
做一做
教学过程
新知新授
实验探究3
6.实验结论:
天平失去平衡
天平保持平衡
m(磷)+m(氧气)=m(五氧化二磷)
记一记
教学过程
新知新授
实验总结
根据前面的实验探究,我们可以得出结论:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
质量守恒定律是自然科学的基本定律之一,它告诉我们化学变化只能改变物质的种类而不能改变物质的总质量。
m参加反应的所有物质质量=m生成的所有物质的质量
3.计入质量总和的是参加化学反应的反应物质量,过量的反应物不应计算在内。例如10克氢气与80克氧气刚好反应生成90克水,但15克氢气与80克氧气反应生成的水不是95克,仍然是80克水。
记一记
教学过程
新知新授
实验总结
使用质量守恒定律注意事项:
1.质量守恒定律适用于一切化学反应。
2.不能用质量守恒定律解释非化学变化(物理变化)。例如5克糖+15克水=20克糖水
做一做
教学过程
新知应用
判断下列说法是否正确:
(1) 根据质量守恒定律可知10g食盐加入10g水中可得到20克盐水
(2) 铝条燃烧后增加的质量等于参加反应的氧气的质量
(3) 过氧化氢和烧杯共重200g,等完全分解所后质量仍为200克
(4)根据质量守恒定律可知15g碳和15g氧气完全反应生成30g 二氧化碳
(5)蒸发液态空气所得各气体的质量总和等于液态空气的质量,这有力地证实了质量守恒定律
(6)电解100克水,完全分解后,得到是氢气和氧气一定是100克
记一记
教学过程
课堂小结
今天学到了什么?
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
3.计入质量总和的是参加化学反应的反应物质量,过量的反应物不应计算在内。例如10克氢气与80克氧气刚好反应生成90克水,但15克氢气与80克氧气反应生成的水不水95克,仍然是80克水。
1.质量守恒定律适用于一切化学反应。
2.不能用质量守恒定律解释非化学变化(物理变化)。例如5克糖+15克水=20克糖水
做一做
教学过程
课后巩固
现有m克过氧化氢溶液跟n克MnO2混合,完全反应后,称量剩余液体和固体物质的总质量是a克,求生成氧气的质量为多少克。
教学过程
结束新课
感谢聆听
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
