鲁教版化学九上5.1 化学反应中的质量守恒(第2课时)同步课件(共22张PPT)
文档属性
| 名称 | 鲁教版化学九上5.1 化学反应中的质量守恒(第2课时)同步课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 14:31:50 | ||
图片预览








文档简介
(共22张PPT)
鲁教版化学九年级(上)
1.化学反应中的质量守恒
第五单元 定量研究化学反应
第2课时 质量守恒定律的微观解释及应用
教学目标
重点难点
1.能从微观的角度解释质量守恒定律。(重点)
2.能利用质量守恒定律从宏观解释一些实验现象并应用质量守恒定律进行相关计算。(难点)
答一答
教学过程
温故知新
质量守恒定律的内容是什么?
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
m参加反应的所有物质质量=m生成的所有物质的质量
议一议
教学过程
新课引入
上节课我们从宏观了解了化学反应中,反应的质量遵循“质量守恒定律”,因为我们知道构成物质的原子是化学变化中不能再分割的粒子,那么我们能不能从微观的角度对“质量守恒定律”做出解释呢?
看一看
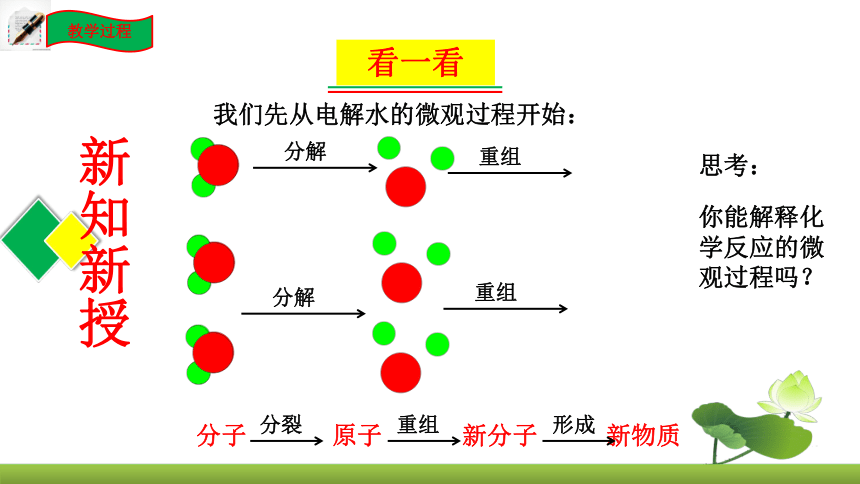
教学过程
新知新授
我们先从电解水的微观过程开始:
分解
重组
分解
重组
你能解释化学反应的微观过程吗?
思考:
分子 原子 新分子 新物质
分裂
重组
形成
记一记
教学过程
新知新授
“质量守恒定律”的微观解释:
化学变化中分子破裂成原子,原子重新组合成新的分子,新的分子形成新物质。但原子的种类、个数、质量都没有改变,所以反应前后物质的总质量不变(参加化学反应的反应物的总质量等于反应后生成的各物质的质量总和)
m参加反应的所有物质质量=m生成的所有物质的质量
记一记
教学过程
新知新授
“质量守恒定律”中的变与不变:
“质量守恒定律”中的不变(宏观):
元素的种类不变
各种元素的质量不变
参加反应物的总质量不变
“质量守恒定律”中的不变(微观):
原子的种类不变
原子的个数不变
原子的质量不变
“质量守恒定律”中的变(宏观):
物质的种类改变
“质量守恒定律”中的变(微观):
分子的种类改变
“质量守恒定律”中的可能变:
元素的化合价可能改变
分子的数目可能改变
记一记
教学过程
新知新授
质量守恒定律的应用
一、根据质量守恒定律求物质的质量:
a克A物质与b克B物质恰好反应完,生成c克C物质,则a+b=c。
a克A物质与b克B物质恰好反应完,生成c克C物质和d克D物质,则a+b=c+d。
a克A物质完全分解生成b克B物质和c克C物质则a=b+c。
例1 已知3克碳在8克氧气恰好燃烧完毕,可以得到多少克二氧化碳?现有15克碳放在24克氧气中燃烧,可以得到多少克二氧化碳?
做一做
教学过程
例题解析
做一做
教学过程
例题解析
解:3克碳在8克氧气恰好反应,根据质量守恒定律,生成的二氧化碳为3g+8g=11g,所以得到11克二氧化碳。
由前面可知碳与氧完全反应的质量比为3:8,所以15克碳放在24克氧气中燃烧,反应物碳过剩。
设有x克碳参加了反应,则x:24g=3g:8g,解得x=9g。所以只有9g参加了化学反应,根据质量守恒定律,生成的二氧化碳为33克。
做一做
教学过程
新知应用
把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。分析回答下列问题;
物质 甲 乙 丙 丁
反应前的质量/g 4.0 2.0 3.0 2.0
反应后的质量/g 1.2 x 2.4 5.4
2.哪几种物质参加了反应?该反应的生成物是什么?
1.表中的x是多少?
3.参加物质反应的物质的质量比是多少?
4.物质丙是单质还是化合物?
5.该反应是化合化合反应吗?
做一做
教学过程
新知应用
答案:
(1)x=4.1。
(2)甲物质与丙物质参加了反应,生成物是丁物质。
物质 甲 乙 丙 丁
反应前的质量/g 5.4 4.1 4.3 2.0
反应后的质量/g 3.2 x 2.4 6.1
(3)参加反应的物质质量比为22:19。
(4)丙物质既可能是单质,也可能是化合物。
(5)该反应是化合反应。
记一记
教学过程
新知新授
质量守恒定律的应用
二、根据质量守恒定律推算物质元素的组成:
根据质量守恒定律,参与反应的物质的元素的种类不变,可以有生成物推算参与反应的物质由什么元素组成。
做一做
教学过程
例题解析
例2 实验室常用燃烧的方法测定有机物的组成。3.0g某有机物完全燃烧后生成4.4g二氧化碳和1.8g 水。判断该有机物由哪些元素组成,并计算3.0g该有机物中各种元素的质量。
4.4g二氧化碳中碳元素的质量为4.4g××100%=1.2g
做一做
教学过程
例题解析
1.8g水中氢元素的质量为1.8g××100%=0.2g
解:因为生成物二氧化碳和水中含有碳元素和氢元素,所以有机物中一定含有碳、氢两种元素。通过计算才能确定是否含有氧元素。
1.2g+0.2g=1.4g<3.0g,所以元有机物中含有氧元素,氧元素质量为3.0g-1.4g=1.6g。
所以该有机物中含有碳元素、氢元素和氧元素,质量分别为1.2g、0.2g和1.6g。
记一记
教学过程
新知新授
质量守恒定律的应用
三、根据质量守恒定律推算物质化学式:
根据质量守恒定律,参与反应的物质的原子种类和原子数目不变,可以推算出物质的化学式。
例3 已知2个高锰酸钾(KMnO4)分子分解后得到1个锰酸钾(K2MnO4)分子、一个氧(O2)分子和一个A物质的分子,写出A物质的化学式。
做一做
教学过程
例题解析
做一做
教学过程
例题解析
解:因为两个KMnO4分子含有2个K原子、2个Mn原子和8个O原子,而1个K2MnO4分子含有2个K原子、1个Mn原子和4个O原子,一个O分子中含有2个O原子,KMnO4的生成物中还有1个Mn原子和两个O原子,所以KMnO4的生成物中A物质为二氧化锰,根据它们各自的化合价可写出其化学式为MnO2。
做一做
教学过程
随堂练习
某物质在纯氧中燃烧得到二氧化碳和水,下列说法正确的是( )
A.该物质一定是由碳元素和氢元素组成
B.该物质一定含有氧元素
C.该物质一定是由碳元素、氢元素和氧元素组成
D.该物质一定含有碳元素和氢元素,可能含有氧元
记一记
教学过程
课堂小结
今天学到了什么?
化学变化中分子破裂成原子,原子重新组合成新的分子,新的分子形成新物质。但原子的种类、个数、质量都没有改变,所以反应前后物质的总质量不变(参加化学反应的反应物的总质量等于反应后生成的各物质的质量总和)
做一做
教学过程
课后巩固
完成练习册上本科时作业。
教学过程
结束新课
感谢聆听
鲁教版化学九年级(上)
1.化学反应中的质量守恒
第五单元 定量研究化学反应
第2课时 质量守恒定律的微观解释及应用
教学目标
重点难点
1.能从微观的角度解释质量守恒定律。(重点)
2.能利用质量守恒定律从宏观解释一些实验现象并应用质量守恒定律进行相关计算。(难点)
答一答
教学过程
温故知新
质量守恒定律的内容是什么?
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
m参加反应的所有物质质量=m生成的所有物质的质量
议一议
教学过程
新课引入
上节课我们从宏观了解了化学反应中,反应的质量遵循“质量守恒定律”,因为我们知道构成物质的原子是化学变化中不能再分割的粒子,那么我们能不能从微观的角度对“质量守恒定律”做出解释呢?
看一看
教学过程
新知新授
我们先从电解水的微观过程开始:
分解
重组
分解
重组
你能解释化学反应的微观过程吗?
思考:
分子 原子 新分子 新物质
分裂
重组
形成
记一记
教学过程
新知新授
“质量守恒定律”的微观解释:
化学变化中分子破裂成原子,原子重新组合成新的分子,新的分子形成新物质。但原子的种类、个数、质量都没有改变,所以反应前后物质的总质量不变(参加化学反应的反应物的总质量等于反应后生成的各物质的质量总和)
m参加反应的所有物质质量=m生成的所有物质的质量
记一记
教学过程
新知新授
“质量守恒定律”中的变与不变:
“质量守恒定律”中的不变(宏观):
元素的种类不变
各种元素的质量不变
参加反应物的总质量不变
“质量守恒定律”中的不变(微观):
原子的种类不变
原子的个数不变
原子的质量不变
“质量守恒定律”中的变(宏观):
物质的种类改变
“质量守恒定律”中的变(微观):
分子的种类改变
“质量守恒定律”中的可能变:
元素的化合价可能改变
分子的数目可能改变
记一记
教学过程
新知新授
质量守恒定律的应用
一、根据质量守恒定律求物质的质量:
a克A物质与b克B物质恰好反应完,生成c克C物质,则a+b=c。
a克A物质与b克B物质恰好反应完,生成c克C物质和d克D物质,则a+b=c+d。
a克A物质完全分解生成b克B物质和c克C物质则a=b+c。
例1 已知3克碳在8克氧气恰好燃烧完毕,可以得到多少克二氧化碳?现有15克碳放在24克氧气中燃烧,可以得到多少克二氧化碳?
做一做
教学过程
例题解析
做一做
教学过程
例题解析
解:3克碳在8克氧气恰好反应,根据质量守恒定律,生成的二氧化碳为3g+8g=11g,所以得到11克二氧化碳。
由前面可知碳与氧完全反应的质量比为3:8,所以15克碳放在24克氧气中燃烧,反应物碳过剩。
设有x克碳参加了反应,则x:24g=3g:8g,解得x=9g。所以只有9g参加了化学反应,根据质量守恒定律,生成的二氧化碳为33克。
做一做
教学过程
新知应用
把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。分析回答下列问题;
物质 甲 乙 丙 丁
反应前的质量/g 4.0 2.0 3.0 2.0
反应后的质量/g 1.2 x 2.4 5.4
2.哪几种物质参加了反应?该反应的生成物是什么?
1.表中的x是多少?
3.参加物质反应的物质的质量比是多少?
4.物质丙是单质还是化合物?
5.该反应是化合化合反应吗?
做一做
教学过程
新知应用
答案:
(1)x=4.1。
(2)甲物质与丙物质参加了反应,生成物是丁物质。
物质 甲 乙 丙 丁
反应前的质量/g 5.4 4.1 4.3 2.0
反应后的质量/g 3.2 x 2.4 6.1
(3)参加反应的物质质量比为22:19。
(4)丙物质既可能是单质,也可能是化合物。
(5)该反应是化合反应。
记一记
教学过程
新知新授
质量守恒定律的应用
二、根据质量守恒定律推算物质元素的组成:
根据质量守恒定律,参与反应的物质的元素的种类不变,可以有生成物推算参与反应的物质由什么元素组成。
做一做
教学过程
例题解析
例2 实验室常用燃烧的方法测定有机物的组成。3.0g某有机物完全燃烧后生成4.4g二氧化碳和1.8g 水。判断该有机物由哪些元素组成,并计算3.0g该有机物中各种元素的质量。
4.4g二氧化碳中碳元素的质量为4.4g××100%=1.2g
做一做
教学过程
例题解析
1.8g水中氢元素的质量为1.8g××100%=0.2g
解:因为生成物二氧化碳和水中含有碳元素和氢元素,所以有机物中一定含有碳、氢两种元素。通过计算才能确定是否含有氧元素。
1.2g+0.2g=1.4g<3.0g,所以元有机物中含有氧元素,氧元素质量为3.0g-1.4g=1.6g。
所以该有机物中含有碳元素、氢元素和氧元素,质量分别为1.2g、0.2g和1.6g。
记一记
教学过程
新知新授
质量守恒定律的应用
三、根据质量守恒定律推算物质化学式:
根据质量守恒定律,参与反应的物质的原子种类和原子数目不变,可以推算出物质的化学式。
例3 已知2个高锰酸钾(KMnO4)分子分解后得到1个锰酸钾(K2MnO4)分子、一个氧(O2)分子和一个A物质的分子,写出A物质的化学式。
做一做
教学过程
例题解析
做一做
教学过程
例题解析
解:因为两个KMnO4分子含有2个K原子、2个Mn原子和8个O原子,而1个K2MnO4分子含有2个K原子、1个Mn原子和4个O原子,一个O分子中含有2个O原子,KMnO4的生成物中还有1个Mn原子和两个O原子,所以KMnO4的生成物中A物质为二氧化锰,根据它们各自的化合价可写出其化学式为MnO2。
做一做
教学过程
随堂练习
某物质在纯氧中燃烧得到二氧化碳和水,下列说法正确的是( )
A.该物质一定是由碳元素和氢元素组成
B.该物质一定含有氧元素
C.该物质一定是由碳元素、氢元素和氧元素组成
D.该物质一定含有碳元素和氢元素,可能含有氧元
记一记
教学过程
课堂小结
今天学到了什么?
化学变化中分子破裂成原子,原子重新组合成新的分子,新的分子形成新物质。但原子的种类、个数、质量都没有改变,所以反应前后物质的总质量不变(参加化学反应的反应物的总质量等于反应后生成的各物质的质量总和)
做一做
教学过程
课后巩固
完成练习册上本科时作业。
教学过程
结束新课
感谢聆听
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
