1.2.1 原电池的工作原理-2023-2024学年高二化学鲁科版选择性必修第一册课件(共27张PPT)
文档属性
| 名称 | 1.2.1 原电池的工作原理-2023-2024学年高二化学鲁科版选择性必修第一册课件(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 582.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览






文档简介
(共27张PPT)
第二节 化学能转化为电能——电池
第1课时 原电池的工作原理
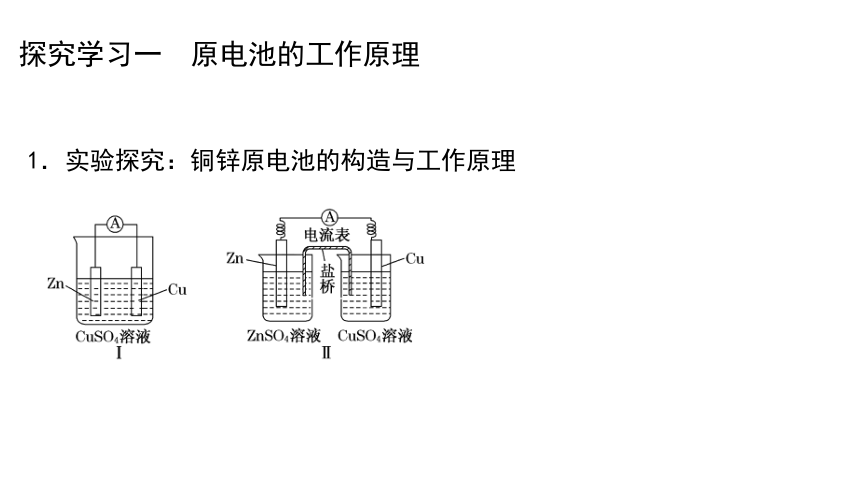
探究学习一 原电池的工作原理
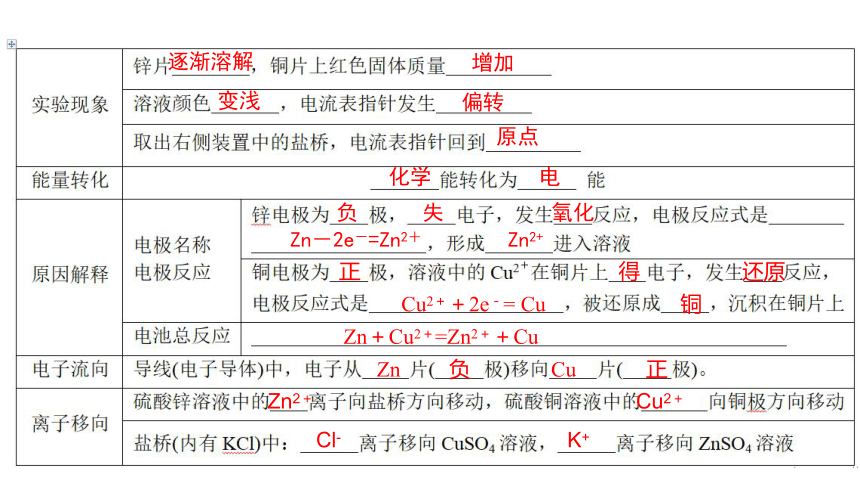
1.实验探究:铜锌原电池的构造与工作原理
称
逐渐溶解
增加
变浅
偏转
原点
化学 电
负 失 氧化
Zn-2e-=Zn2+ Zn2+
正 得 还原
Cu2++2e-= Cu 铜
Zn+Cu2+=Zn2++Cu
Zn 负 Cu 正
Zn2+ Cu2+
Cl- K+
?想一想
1.比较铜锌原电池I与铜锌原电池Ⅱ构成上的差异,哪一种原电池化学能转化电能的效率高?说明理由?
第二种 铜锌原电池I中,锌能与电解质溶液中的Cu2+直接发生氧化还原反应,转化为热能,电能利用效率较低;铜锌原电池Ⅱ中,锌与Cu2+彼此隔离,锌发生氧化反应失去的电子都通过导线,能较充分将化学能转化为电能。
?想一想
(1)构成闭合回路,形成原电池。
(2)避免电极与电解质溶液直接反应,有利于最大程度地将化学能转化为电能。
(3)盐桥中的阴、阳离子定向迁移,使溶液保持电中性,维持两电极电势差(平衡电荷),使电池能持续提供电流。
2.盐桥有什么作用?
2.原电池的工作原理
(1)定义:将 能转化为 能的装置。
(2)装置构成的条件:
。
电极反应物、电极材料、离子导体、电子导体、自发进行的氧化还原反应
化学
电
(3)电极
负极——电子 (还原剂发生 反应)的电极。
正极——电子 (氧化剂发生 反应)的电极。
氧化
还原
流出
流入
(4) 3个移动方向
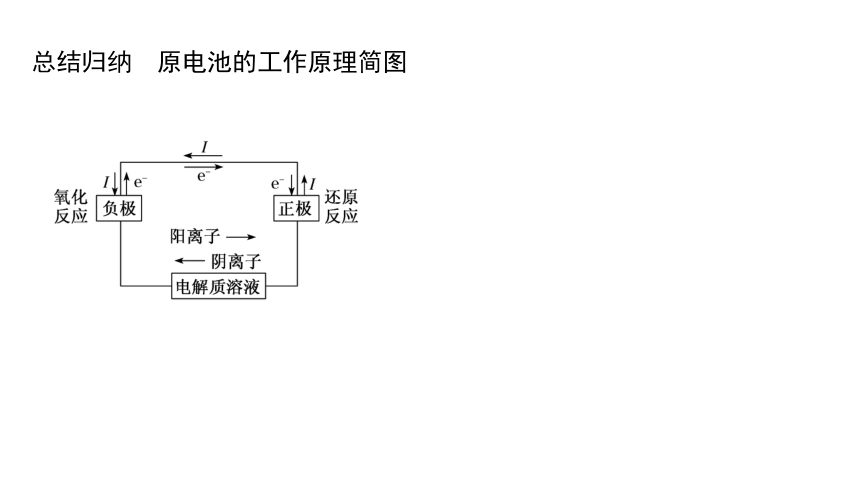
①电子移向:电子从 极流出经外电路流入 极。
②电流方向:电流从 极流向 极。
③离子移动方向:阳离子向 极移动,阴离子向 极移动。
负
正
正
负
正
负
总结归纳 原电池的工作原理简图
【理解应用】
1.某原电池装置如图所示。下列有关叙述中,正确的是( )
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
×
√
×
【思维模型】
原电池正、负电极的判断
2.(2015天津高考题改编)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。回答下列问题:
(1)铜电极上的电极反应式为 ,发生 (填“氧化”“还原”)反应。
(2)锌电极的名称为 ,该原电池的总反应为 。
(3)电池工作一段时间后,甲池溶液的 (填“”“减小”或“”,下同 ),乙池溶液的总质量 。
Cu2++2e-=Cu 还原
负极
Cu2++Zn=Zn2++Cu
不变
增加
【思维模型】
原电池电极反应式的书写
(1)判断原电池的正、负极,即找出氧化剂和还原剂。
(2)结合介质的酸碱性确定还原产物和氧化产物。
(3)写出电极反应式,将两式相加得总反应式。
【思维模型】
根据键能计算反应热的方法
正确书写化学方程式。
分析断裂或形成的化学键的数目。
代入公式计算:Q=E1(断裂反应物化学键吸收总能量)-E2形成(反应产物化学键释放总能量)。
探究学习二 原电池工作原理的应用
1.加快氧化还原反应的速率
一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率 。
加快
2.比较金属的活动性强弱
在原电池中,若两电极是两种活泼性不同的金属,一般负极金属的活泼性比正极金属的的活泼性 。
强
任何自发的氧化还原反应都可以设计成原电池。
还原性较强的物质在负极上失去电子,氧化性较强的物质在正极上得到电子。
将两电极浸入电解质溶液中,阴、阳离子作定向移动。
3.设计化学电池
【理解应用】
1.设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:__________________。
(2)若要将上述反应设计成原电池,电极反应式分别是:
①负极_________________;②正极________________________。
2Fe3++Cu=2Fe2++Cu2+
Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+
①不含盐桥 ②含盐桥
(3)在框中画出装置图,指出电极材料和电解质溶液:
【思维模型】
根据氧化还原反应设计化学电池
2.依据氧化还原反应:Cu+2Ag+=Cu2++2Ag设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是________,电解质溶液Y是____________。
(2)银电极的电极反应式是________________________________;
X电极的电极反应式是_____________________________________。
(3)外电路中的电子是从________极流向________极。
(4)该原电池的正极可以选用_____________材料。
【理解应用】
铜 硝酸银溶液
2Ag++2e-=2Ag
负(或铜) 正(或银)
Cu-2e-=Cu2+
银 铂、石墨
3.[2017·北京]可利用原电池装置证明反应Ag++Fe2+=Ag+Fe3+能发生。已知实验时,在甲溶液的上层加有一层无色有机液体,以防止空气中的氧气氧化铁元素。
其中甲溶液是__________________________,
操作及现象是____________________________________________________________。
FeSO4溶液
分别取电池工作前与工作一段时间后左侧烧杯中溶液于试管中,滴加KSCN溶液,后者红色加深
【思维模型】
已知氧化还原总反应式,书写电极反应式步骤
①分析化合价,确定正极、负极的反应物与产物。
正极反应:氧化剂→还原产物,
负极反应:还原剂→氧化产物。
②在电极反应式的左边写出得失电子数,使得失电子守恒。
③根据质量守恒配平电极反应式。
提醒
(1)复杂电极反应式=总反应式-简单的电极反应式(先写)。
(2)书写原电池电极反应式应注意电解质溶液参加反应。
(3)电极反应式得失电子数相等时,将两式相加得总反应式。
1.下列有关图甲和图乙的叙述不正确的是( )
A.均发生了化学能转化为电能的过程
B.Zn和Cu既是电极材料又是反应物
C.工作过程中,电子均由Zn经导线流向Cu
D.相同条件下,图乙比图甲的能量利用效率高
【基础达标】
【基础达标】
2.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
【基础达标】
3.铜片、银片设计成如图所示的原电池。下列关于原电池的叙述正确的是( )
A.电极Ⅰ上发生还原反应,作原电池的负极
B.电极Ⅱ的电极反应式为Cu2++2e-=Cu
C.该原电池的总反应:2Fe3++Cu=Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼胶,其作用是传递电子
4.控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流表读数为零时,反应达到化学平衡状态
D.电流表读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
【基础达标】
【素养提升】
6.由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
(1)原电池的负极反应是________________,
正极反应是________________。
(2)电流的方向是____________________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗______g 锌,有________个电子通过了导线,原硫酸的物质的量浓度是_______________(设溶液体积不变)。
Zn-2e-=Zn2+
由Cu极经导线流向Zn极
2H++2e-=H2↑
4.875
9.03×1022
0.75 mol·L-1
第二节 化学能转化为电能——电池
第1课时 原电池的工作原理
探究学习一 原电池的工作原理
1.实验探究:铜锌原电池的构造与工作原理
称
逐渐溶解
增加
变浅
偏转
原点
化学 电
负 失 氧化
Zn-2e-=Zn2+ Zn2+
正 得 还原
Cu2++2e-= Cu 铜
Zn+Cu2+=Zn2++Cu
Zn 负 Cu 正
Zn2+ Cu2+
Cl- K+
?想一想
1.比较铜锌原电池I与铜锌原电池Ⅱ构成上的差异,哪一种原电池化学能转化电能的效率高?说明理由?
第二种 铜锌原电池I中,锌能与电解质溶液中的Cu2+直接发生氧化还原反应,转化为热能,电能利用效率较低;铜锌原电池Ⅱ中,锌与Cu2+彼此隔离,锌发生氧化反应失去的电子都通过导线,能较充分将化学能转化为电能。
?想一想
(1)构成闭合回路,形成原电池。
(2)避免电极与电解质溶液直接反应,有利于最大程度地将化学能转化为电能。
(3)盐桥中的阴、阳离子定向迁移,使溶液保持电中性,维持两电极电势差(平衡电荷),使电池能持续提供电流。
2.盐桥有什么作用?
2.原电池的工作原理
(1)定义:将 能转化为 能的装置。
(2)装置构成的条件:
。
电极反应物、电极材料、离子导体、电子导体、自发进行的氧化还原反应
化学
电
(3)电极
负极——电子 (还原剂发生 反应)的电极。
正极——电子 (氧化剂发生 反应)的电极。
氧化
还原
流出
流入
(4) 3个移动方向
①电子移向:电子从 极流出经外电路流入 极。
②电流方向:电流从 极流向 极。
③离子移动方向:阳离子向 极移动,阴离子向 极移动。
负
正
正
负
正
负
总结归纳 原电池的工作原理简图
【理解应用】
1.某原电池装置如图所示。下列有关叙述中,正确的是( )
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
×
√
×
【思维模型】
原电池正、负电极的判断
2.(2015天津高考题改编)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。回答下列问题:
(1)铜电极上的电极反应式为 ,发生 (填“氧化”“还原”)反应。
(2)锌电极的名称为 ,该原电池的总反应为 。
(3)电池工作一段时间后,甲池溶液的 (填“”“减小”或“”,下同 ),乙池溶液的总质量 。
Cu2++2e-=Cu 还原
负极
Cu2++Zn=Zn2++Cu
不变
增加
【思维模型】
原电池电极反应式的书写
(1)判断原电池的正、负极,即找出氧化剂和还原剂。
(2)结合介质的酸碱性确定还原产物和氧化产物。
(3)写出电极反应式,将两式相加得总反应式。
【思维模型】
根据键能计算反应热的方法
正确书写化学方程式。
分析断裂或形成的化学键的数目。
代入公式计算:Q=E1(断裂反应物化学键吸收总能量)-E2形成(反应产物化学键释放总能量)。
探究学习二 原电池工作原理的应用
1.加快氧化还原反应的速率
一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率 。
加快
2.比较金属的活动性强弱
在原电池中,若两电极是两种活泼性不同的金属,一般负极金属的活泼性比正极金属的的活泼性 。
强
任何自发的氧化还原反应都可以设计成原电池。
还原性较强的物质在负极上失去电子,氧化性较强的物质在正极上得到电子。
将两电极浸入电解质溶液中,阴、阳离子作定向移动。
3.设计化学电池
【理解应用】
1.设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:__________________。
(2)若要将上述反应设计成原电池,电极反应式分别是:
①负极_________________;②正极________________________。
2Fe3++Cu=2Fe2++Cu2+
Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+
①不含盐桥 ②含盐桥
(3)在框中画出装置图,指出电极材料和电解质溶液:
【思维模型】
根据氧化还原反应设计化学电池
2.依据氧化还原反应:Cu+2Ag+=Cu2++2Ag设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是________,电解质溶液Y是____________。
(2)银电极的电极反应式是________________________________;
X电极的电极反应式是_____________________________________。
(3)外电路中的电子是从________极流向________极。
(4)该原电池的正极可以选用_____________材料。
【理解应用】
铜 硝酸银溶液
2Ag++2e-=2Ag
负(或铜) 正(或银)
Cu-2e-=Cu2+
银 铂、石墨
3.[2017·北京]可利用原电池装置证明反应Ag++Fe2+=Ag+Fe3+能发生。已知实验时,在甲溶液的上层加有一层无色有机液体,以防止空气中的氧气氧化铁元素。
其中甲溶液是__________________________,
操作及现象是____________________________________________________________。
FeSO4溶液
分别取电池工作前与工作一段时间后左侧烧杯中溶液于试管中,滴加KSCN溶液,后者红色加深
【思维模型】
已知氧化还原总反应式,书写电极反应式步骤
①分析化合价,确定正极、负极的反应物与产物。
正极反应:氧化剂→还原产物,
负极反应:还原剂→氧化产物。
②在电极反应式的左边写出得失电子数,使得失电子守恒。
③根据质量守恒配平电极反应式。
提醒
(1)复杂电极反应式=总反应式-简单的电极反应式(先写)。
(2)书写原电池电极反应式应注意电解质溶液参加反应。
(3)电极反应式得失电子数相等时,将两式相加得总反应式。
1.下列有关图甲和图乙的叙述不正确的是( )
A.均发生了化学能转化为电能的过程
B.Zn和Cu既是电极材料又是反应物
C.工作过程中,电子均由Zn经导线流向Cu
D.相同条件下,图乙比图甲的能量利用效率高
【基础达标】
【基础达标】
2.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
【基础达标】
3.铜片、银片设计成如图所示的原电池。下列关于原电池的叙述正确的是( )
A.电极Ⅰ上发生还原反应,作原电池的负极
B.电极Ⅱ的电极反应式为Cu2++2e-=Cu
C.该原电池的总反应:2Fe3++Cu=Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼胶,其作用是传递电子
4.控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流表读数为零时,反应达到化学平衡状态
D.电流表读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
【基础达标】
【素养提升】
6.由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
(1)原电池的负极反应是________________,
正极反应是________________。
(2)电流的方向是____________________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗______g 锌,有________个电子通过了导线,原硫酸的物质的量浓度是_______________(设溶液体积不变)。
Zn-2e-=Zn2+
由Cu极经导线流向Zn极
2H++2e-=H2↑
4.875
9.03×1022
0.75 mol·L-1
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
