2.2.3 反应条件对化学平衡的影响(共27张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 2.2.3 反应条件对化学平衡的影响(共27张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 14:56:45 | ||
图片预览





文档简介
(共27张PPT)
第二章第2节 化学反应的限度
第3课时反应条件对化学平衡的影响
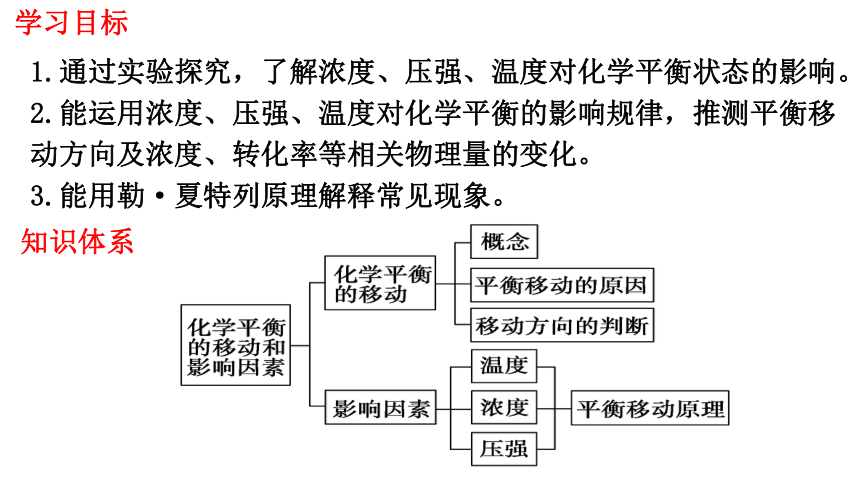
学习目标
知识体系
1.通过实验探究,了解浓度、压强、温度对化学平衡状态的影响。
2.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。
3.能用勒·夏特列原理解释常见现象。
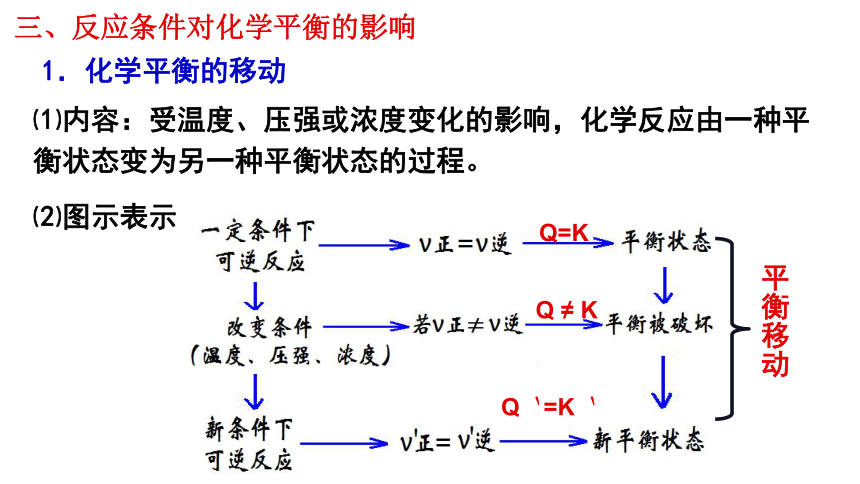
⑴内容:受温度、压强或浓度变化的影响,化学反应由一种平衡状态变为另一种平衡状态的过程。
三、反应条件对化学平衡的影响
1.化学平衡的移动
⑵图示表示
平衡移动
Q=K
Q ≠ K
Q`=K`
①根据速率判断
若v(正)___v(逆),则平衡正向移动。
若v(正)___v(逆),则平衡不移动。
若v(正)___v(逆),则平衡逆向移动。
②根据结果判断
对于一个已达到化学平衡状态的反应,如平衡移动的结果使反应产物浓度更大,则称平衡正向移动或向右移动;如平衡移动的结果使反应物浓度更大,称平衡逆向移动或向左移动。
⑶平衡移动方向的判断
>
=
<
注意:反应速率改变时平衡不一定移动,但平衡移动时反应速率一定改变。
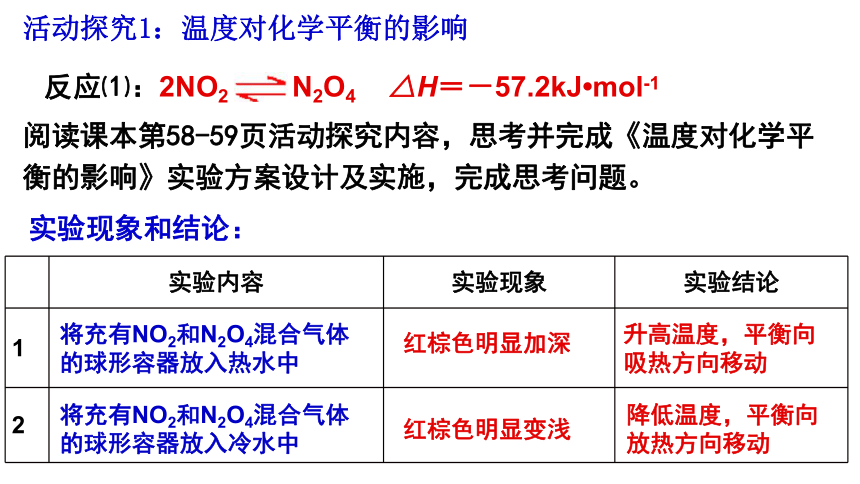
阅读课本第58-59页活动探究内容,思考并完成《温度对化学平衡的影响》实验方案设计及实施,完成思考问题。
反应⑴:2NO2 N2O4 △H=-57.2kJ mol-1
活动探究1:温度对化学平衡的影响
实验内容 实验现象 实验结论
1
2
实验现象和结论:
将充有NO2和N2O4混合气体的球形容器放入热水中
将充有NO2和N2O4混合气体的球形容器放入冷水中
红棕色明显加深
红棕色明显变浅
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
2、温度的影响:
在其它条件不变的情况下:
升高温度,使吸热反应的平衡常数增大,平衡向吸热方向移动;
降低温度,使放热反应的平衡常数增大,平衡向放热方向移动。
温度对化学平衡的影响是通过改变平衡常数实现的,温度的变化对吸热反应影响大。
例1、以下几个反应,在一定条件下达到平衡时升高温度,平衡向什么方向移动,平衡常数K如何变化?如果降低温度呢?
例2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动
BD
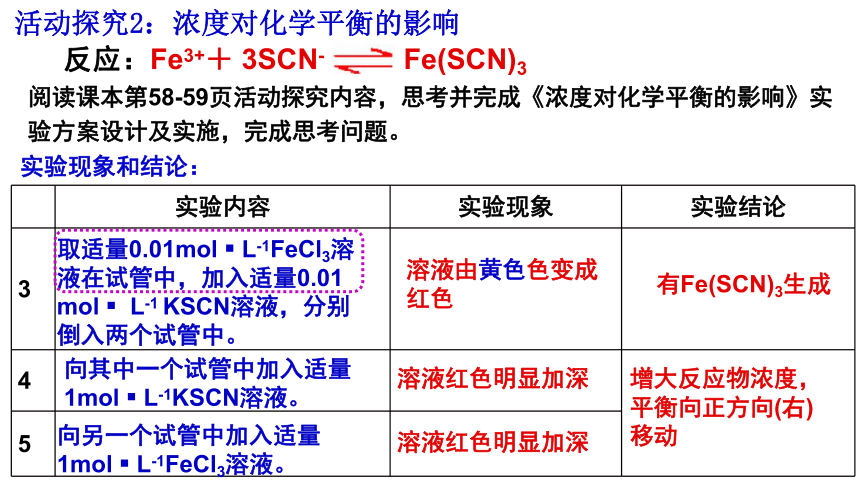
阅读课本第58-59页活动探究内容,思考并完成《浓度对化学平衡的影响》实验方案设计及实施,完成思考问题。
反应:Fe3++ 3SCN- Fe(SCN)3
活动探究2:浓度对化学平衡的影响
实验内容 实验现象 实验结论
3
4
5
实验现象和结论:
取适量0.01mol L-1FeCl3溶液在试管中,加入适量0.01 mol L-1 KSCN溶液,分别倒入两个试管中。
向其中一个试管中加入适量1mol L-1KSCN溶液。
向另一个试管中加入适量1mol L-1FeCl3溶液。
溶液由黄色色变成红色
溶液红色明显加深
溶液红色明显加深
增大反应物浓度,平衡向正方向(右)移动
有Fe(SCN)3生成
1、增大反应物浓度,平衡怎样移动?减小生成物浓度,平衡怎样移动?
2、减小反应物浓度,平衡怎样移动?增大生成物浓度,平衡怎样移动?
3、不改变其他条件,只改变反应物和生成物的浓度,平衡常数是否发生变化?
4、利用平衡常数和浓度商的关系,能否判断浓度改变时平衡的移动方向?
思考:
3、浓度的影响:
c反应物 增大 或 c产物 减小,(Q ﹤ K) 平衡正向移动;
c产物 增大或 c反应物 减小,(Q > K) 平衡逆向移动。
对于确定的化学反应,改变浓度,化学平衡发生移动,平衡常数K不变。
在其它条件不变的情况下:
1、工业合成氨过程中不断把生成的氨从反应混合物中分离出来,分析原因?
2、利用酯化反应制备乙酸乙酯时,使用加热的条件、使用浓硫酸等措施,试从化学平衡移动的角度分析原因?如果在制备中要提高乙酸的转化率,还可以采用什么方法?
思考:
例3、铬酸钾(K2CrO4)与重铬酸钾(K2Cr2O7)有如下转化: 已知重铬酸钾的稀溶液呈橙红色。2CrO42-+ 2H+ Cr2O72- + H2O
黄色 橙红色
(1)向重铬酸钾的稀溶液中加入NaOH,溶液呈 色;
(2)向(1)的溶液中再加入过量的H2SO4,溶液呈 色;
(3)向重铬酸钾的稀溶液中加入Ba(NO3)2溶液(BaCrO4为黄色沉淀),平衡向 移动(左,右)
黄
橙红
左
例4、血红蛋白(Hb)和氧气(O2)、一氧化碳(CO)的结合,煤气中毒病人的治疗原理:
血红蛋白(Hb)和氧气(O2)的结合① Hb + O2(g) Hb (O2);
血红蛋白(Hb)和一氧化碳(CO)的结合② Hb + CO (g) Hb (CO);
发现有人煤气中毒,应当怎救治?
增大氧气浓度,①反应QK,CO结合Hb的化学平衡左移。
高压氧舱?是不是总压强大?
压强对化学平衡的影响——增大压强
推活塞之前
推活塞的瞬间
推活塞后一段时间
平衡状态
平衡被破坏
重新达到平衡状态
颜色最浅
颜色最深
颜色较深
2NO2 N2O4 △H=-57.2kJ mol-1
压强对化学平衡的影响——减小压强
颜色最深
颜色最浅
颜色较深
拉开活塞之前
拉开活塞的瞬间
拉开活塞后一段时间
平衡状态
平衡被破坏
重新达到平衡状态
2NO2 N2O4 △H=-57.2kJ mol-1
1、对于△νg =0的反应,改变压强,平衡是否移动?
△νg >0的反应,增大压强,平衡怎样移动?减小压强,平衡怎样移动?
△νg <0的反应,增大压强,平衡怎样移动?减小压强,平衡怎样移动?
2、利用平衡常数和浓度商的关系,能否判断压强改变时平衡的移动方向?
思考:
对于反应 aA(g)+bB(g) cC(g)+dD(g) ,△νg =(c+d)-(a+b)
4.压强对化学平衡的影响
①若 a+b ≠ c + d (△νg ≠0)
增大压强,平衡向 的方向移动;
减小压强,平衡向 的方向移动。
化学方程式中气体系数减小
对于反应 aA(g)+bB(g) cC(g)+dD(g)
②若 a+b=c + d (△νg =0) ,改变压强,平衡 移动。
化学方程式中气体系数增大
不
对于只涉及固体或液体的反应,压强对平衡影响极其微弱,可以不予考虑。
例5.恒温下, 反应aX(g) bY(g)+cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1 mol/L增大到0.19 mol/L, 下列判断正确的( )
A.a>b+c B.a<b+c C.a=b+c D.a=b=c
A
例6.在高温下,反应2HBr(g) H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体的颜色加深,可采取的方法是( )
A.减压 B.缩小体积
C.升温 D.增大H2浓度
BC
原平衡状态
新平衡状态
改变条件平 衡 移 动
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
总结
温度对化学平衡的影响是通过改变平衡常数K来实现的
改变浓度,若Q < K,平衡正向移动
改变浓度,若Q > K,平衡逆向移动
浓度对化学平衡的影响是通过改变Q与K的相对大小判断
改变压强,若Q < K,平衡正向移动
改变压强,若Q > K,平衡逆向移动
压强对化学平衡的影响是通过改变Q与K的相对大小判断
根据浓度、温度对化学平衡的影响,能不能概括出一个外界条件与平衡移动方向关系的定性普遍原理?
勒夏特列原理:均相、封闭体系中,如果仅改变平衡体系的一个条件,化学平衡总是朝着能减弱这个改变的方向移动。
思考总结:
1.在一定条件下,反应CO + NO2 CO2 + NO达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A.正反应为吸热反应 B.正反应为放热反应
C.CO的平衡转化率降低 D.各物质的浓度不变
B
练习:
2.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的浓度一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤ C.③⑤ D.④⑥
B
3.下列事实中不能用平衡移动原理解释的是( )
A.密闭、低温是存放氨水的必要条件
B.实验室用排饱和食盐水法收集氯气
C.在硝酸工业生产中,使用过量空气以提高NH3的利用率
D.在FeSO4溶液中,加入铁粉以防止氧化
D
4.在一定条件下,反应 H2(g)+Br2(g) 2HBr(g) ΔH< 0,达到化学平衡状态且其他条件不变时:
(1)如果升高温度,平衡混合物的颜色 ;
(2)如果在体积固定的容器中加入一定量的氢气,化学平衡 移动,Br2(g)的平衡转化率 (填“变大”“变小”或“不变”)。
变深
正向
变大
5、在一定体积的 密闭容器中,反应CO2(g) + H2(g) CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。
吸热
c平(CO) c平(H2O)
c平(CO2) c平(H2)
830
第二章第2节 化学反应的限度
第3课时反应条件对化学平衡的影响
学习目标
知识体系
1.通过实验探究,了解浓度、压强、温度对化学平衡状态的影响。
2.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。
3.能用勒·夏特列原理解释常见现象。
⑴内容:受温度、压强或浓度变化的影响,化学反应由一种平衡状态变为另一种平衡状态的过程。
三、反应条件对化学平衡的影响
1.化学平衡的移动
⑵图示表示
平衡移动
Q=K
Q ≠ K
Q`=K`
①根据速率判断
若v(正)___v(逆),则平衡正向移动。
若v(正)___v(逆),则平衡不移动。
若v(正)___v(逆),则平衡逆向移动。
②根据结果判断
对于一个已达到化学平衡状态的反应,如平衡移动的结果使反应产物浓度更大,则称平衡正向移动或向右移动;如平衡移动的结果使反应物浓度更大,称平衡逆向移动或向左移动。
⑶平衡移动方向的判断
>
=
<
注意:反应速率改变时平衡不一定移动,但平衡移动时反应速率一定改变。
阅读课本第58-59页活动探究内容,思考并完成《温度对化学平衡的影响》实验方案设计及实施,完成思考问题。
反应⑴:2NO2 N2O4 △H=-57.2kJ mol-1
活动探究1:温度对化学平衡的影响
实验内容 实验现象 实验结论
1
2
实验现象和结论:
将充有NO2和N2O4混合气体的球形容器放入热水中
将充有NO2和N2O4混合气体的球形容器放入冷水中
红棕色明显加深
红棕色明显变浅
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
2、温度的影响:
在其它条件不变的情况下:
升高温度,使吸热反应的平衡常数增大,平衡向吸热方向移动;
降低温度,使放热反应的平衡常数增大,平衡向放热方向移动。
温度对化学平衡的影响是通过改变平衡常数实现的,温度的变化对吸热反应影响大。
例1、以下几个反应,在一定条件下达到平衡时升高温度,平衡向什么方向移动,平衡常数K如何变化?如果降低温度呢?
例2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动
BD
阅读课本第58-59页活动探究内容,思考并完成《浓度对化学平衡的影响》实验方案设计及实施,完成思考问题。
反应:Fe3++ 3SCN- Fe(SCN)3
活动探究2:浓度对化学平衡的影响
实验内容 实验现象 实验结论
3
4
5
实验现象和结论:
取适量0.01mol L-1FeCl3溶液在试管中,加入适量0.01 mol L-1 KSCN溶液,分别倒入两个试管中。
向其中一个试管中加入适量1mol L-1KSCN溶液。
向另一个试管中加入适量1mol L-1FeCl3溶液。
溶液由黄色色变成红色
溶液红色明显加深
溶液红色明显加深
增大反应物浓度,平衡向正方向(右)移动
有Fe(SCN)3生成
1、增大反应物浓度,平衡怎样移动?减小生成物浓度,平衡怎样移动?
2、减小反应物浓度,平衡怎样移动?增大生成物浓度,平衡怎样移动?
3、不改变其他条件,只改变反应物和生成物的浓度,平衡常数是否发生变化?
4、利用平衡常数和浓度商的关系,能否判断浓度改变时平衡的移动方向?
思考:
3、浓度的影响:
c反应物 增大 或 c产物 减小,(Q ﹤ K) 平衡正向移动;
c产物 增大或 c反应物 减小,(Q > K) 平衡逆向移动。
对于确定的化学反应,改变浓度,化学平衡发生移动,平衡常数K不变。
在其它条件不变的情况下:
1、工业合成氨过程中不断把生成的氨从反应混合物中分离出来,分析原因?
2、利用酯化反应制备乙酸乙酯时,使用加热的条件、使用浓硫酸等措施,试从化学平衡移动的角度分析原因?如果在制备中要提高乙酸的转化率,还可以采用什么方法?
思考:
例3、铬酸钾(K2CrO4)与重铬酸钾(K2Cr2O7)有如下转化: 已知重铬酸钾的稀溶液呈橙红色。2CrO42-+ 2H+ Cr2O72- + H2O
黄色 橙红色
(1)向重铬酸钾的稀溶液中加入NaOH,溶液呈 色;
(2)向(1)的溶液中再加入过量的H2SO4,溶液呈 色;
(3)向重铬酸钾的稀溶液中加入Ba(NO3)2溶液(BaCrO4为黄色沉淀),平衡向 移动(左,右)
黄
橙红
左
例4、血红蛋白(Hb)和氧气(O2)、一氧化碳(CO)的结合,煤气中毒病人的治疗原理:
血红蛋白(Hb)和氧气(O2)的结合① Hb + O2(g) Hb (O2);
血红蛋白(Hb)和一氧化碳(CO)的结合② Hb + CO (g) Hb (CO);
发现有人煤气中毒,应当怎救治?
增大氧气浓度,①反应Q
高压氧舱?是不是总压强大?
压强对化学平衡的影响——增大压强
推活塞之前
推活塞的瞬间
推活塞后一段时间
平衡状态
平衡被破坏
重新达到平衡状态
颜色最浅
颜色最深
颜色较深
2NO2 N2O4 △H=-57.2kJ mol-1
压强对化学平衡的影响——减小压强
颜色最深
颜色最浅
颜色较深
拉开活塞之前
拉开活塞的瞬间
拉开活塞后一段时间
平衡状态
平衡被破坏
重新达到平衡状态
2NO2 N2O4 △H=-57.2kJ mol-1
1、对于△νg =0的反应,改变压强,平衡是否移动?
△νg >0的反应,增大压强,平衡怎样移动?减小压强,平衡怎样移动?
△νg <0的反应,增大压强,平衡怎样移动?减小压强,平衡怎样移动?
2、利用平衡常数和浓度商的关系,能否判断压强改变时平衡的移动方向?
思考:
对于反应 aA(g)+bB(g) cC(g)+dD(g) ,△νg =(c+d)-(a+b)
4.压强对化学平衡的影响
①若 a+b ≠ c + d (△νg ≠0)
增大压强,平衡向 的方向移动;
减小压强,平衡向 的方向移动。
化学方程式中气体系数减小
对于反应 aA(g)+bB(g) cC(g)+dD(g)
②若 a+b=c + d (△νg =0) ,改变压强,平衡 移动。
化学方程式中气体系数增大
不
对于只涉及固体或液体的反应,压强对平衡影响极其微弱,可以不予考虑。
例5.恒温下, 反应aX(g) bY(g)+cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1 mol/L增大到0.19 mol/L, 下列判断正确的( )
A.a>b+c B.a<b+c C.a=b+c D.a=b=c
A
例6.在高温下,反应2HBr(g) H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体的颜色加深,可采取的方法是( )
A.减压 B.缩小体积
C.升温 D.增大H2浓度
BC
原平衡状态
新平衡状态
改变条件平 衡 移 动
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
总结
温度对化学平衡的影响是通过改变平衡常数K来实现的
改变浓度,若Q < K,平衡正向移动
改变浓度,若Q > K,平衡逆向移动
浓度对化学平衡的影响是通过改变Q与K的相对大小判断
改变压强,若Q < K,平衡正向移动
改变压强,若Q > K,平衡逆向移动
压强对化学平衡的影响是通过改变Q与K的相对大小判断
根据浓度、温度对化学平衡的影响,能不能概括出一个外界条件与平衡移动方向关系的定性普遍原理?
勒夏特列原理:均相、封闭体系中,如果仅改变平衡体系的一个条件,化学平衡总是朝着能减弱这个改变的方向移动。
思考总结:
1.在一定条件下,反应CO + NO2 CO2 + NO达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A.正反应为吸热反应 B.正反应为放热反应
C.CO的平衡转化率降低 D.各物质的浓度不变
B
练习:
2.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的浓度一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤ C.③⑤ D.④⑥
B
3.下列事实中不能用平衡移动原理解释的是( )
A.密闭、低温是存放氨水的必要条件
B.实验室用排饱和食盐水法收集氯气
C.在硝酸工业生产中,使用过量空气以提高NH3的利用率
D.在FeSO4溶液中,加入铁粉以防止氧化
D
4.在一定条件下,反应 H2(g)+Br2(g) 2HBr(g) ΔH< 0,达到化学平衡状态且其他条件不变时:
(1)如果升高温度,平衡混合物的颜色 ;
(2)如果在体积固定的容器中加入一定量的氢气,化学平衡 移动,Br2(g)的平衡转化率 (填“变大”“变小”或“不变”)。
变深
正向
变大
5、在一定体积的 密闭容器中,反应CO2(g) + H2(g) CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。
吸热
c平(CO) c平(H2O)
c平(CO2) c平(H2)
830
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
