2.2.4 化学平衡的图像-2023-2024学年高二化学鲁科版选择性必修第一册课件(共16张PPT)
文档属性
| 名称 | 2.2.4 化学平衡的图像-2023-2024学年高二化学鲁科版选择性必修第一册课件(共16张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 417.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 14:57:43 | ||
图片预览





文档简介
(共16张PPT)
第二章第2节 化学反应的限度
第4课时化学平衡的图像
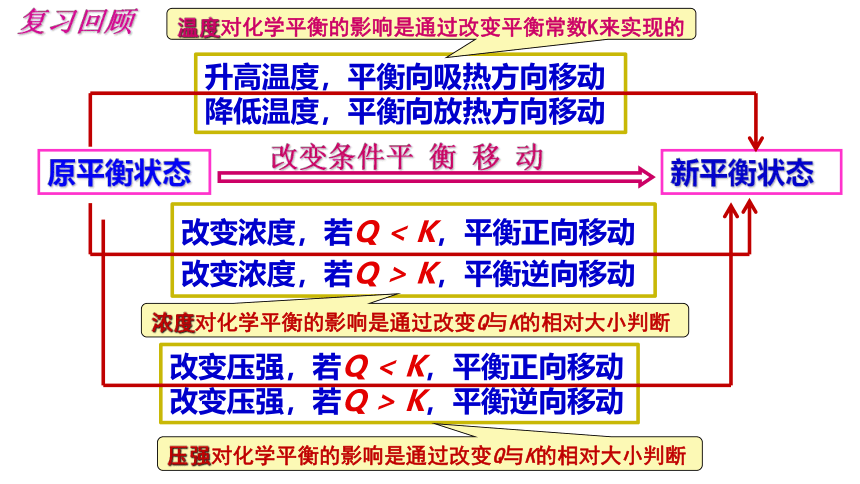
原平衡状态
新平衡状态
改变条件平 衡 移 动
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
复习回顾
温度对化学平衡的影响是通过改变平衡常数K来实现的
改变浓度,若Q < K,平衡正向移动
改变浓度,若Q > K,平衡逆向移动
浓度对化学平衡的影响是通过改变Q与K的相对大小判断
改变压强,若Q < K,平衡正向移动
改变压强,若Q > K,平衡逆向移动
压强对化学平衡的影响是通过改变Q与K的相对大小判断
1.图像问题解题步骤
(1)看懂图像:
①看面(即弄清纵坐标与横坐标的意义);
②看线(即弄清线的走向和变化趋势);
③看点(即弄清起点、拐点、交点、终点的意义);
④看是否要作辅助线(如等温线、等压线);
⑤看定量图像中有关量的多少。
一、化学平衡图像
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。
2.原则
(1)“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
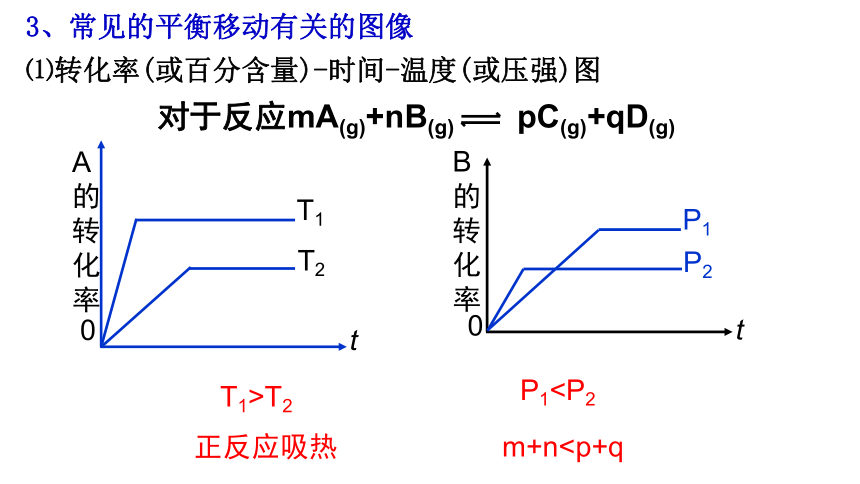
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A的转化率
T1
T2
0
t
B的转化率
P1
P2
0
T1>T2
P1正反应吸热
m+n⑴转化率(或百分含量)-时间-温度(或压强)图
3、常见的平衡移动有关的图像
例1.反应aA(g)+bB(g) cC(g)在不同温度下(T1(1)T1为一条等温线,随着压强的增大,C%____,化学平衡_____移动,a+b__c。
(2)在压强一定时(如p3),温度升高,C%的变化是____,化学平衡____移动,正反应是______反应。
<
正向
吸热
增大
逆向
减小
(1)图1中,温度T1、T2的大小关系是______,温度升高,C%(C的含量)的变化是____,化学平衡____移动,正反应是_____反应。
(2)图2中,压强p1、p2的大小关系是______,压强增大,C%(C的含量)的变化是____,化学平衡____移动,a+b__c。
例2.在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
T2>T1
减小
根据图像回答下列问题:
逆向
放热
p1>p2
减小
逆向
<
例3、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) △H<0 的反应过程,若使a曲线变为b曲线,可采取的措施是( )
0
Z%
t
a
b
A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
AD
⑵转化率(或百分含量)-温度-压强图
对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01×107Pa
1.01×106Pa
1.01×105Pa
0
P
C的浓度
500℃
200℃
0
正反应放热
正反应吸热
m+n>p+q
m+n>p+q
恒温线
恒压线
“定一议二”
P
A%
300℃
200℃
0
对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应吸热
m+n=p+q
恒压线
“定一议二”
例4、对于2A(g)+B(g) C(g)+3D(g) △H>0,有如下图所示的变化,图中Y轴可能表示 ( )
P/pa
Y
100℃
200℃
300℃
0
AD
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
例5、下图是在其它条件一定时,反应2NO+O2 2NO2 △H<0 中NO的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
C点
0
A
B
C
E
D
T
NO转化率
练习:
1.T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g) X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
A.T℃时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T℃
D.T℃时,在d点加入一定量X可达到c点
C
2、在一固定体积的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)═xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6mol A、0.3mol B 和1.4mol C为起始物质,达到平衡后,C的体积分数也为W%.平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是( )
A. B. C. D.
D
3、对于可逆反应N2(g)+3H2(g) 2NH3(g)△H<0.如表所示研究目的和图示相符的是( )
B. 压强(p)对平衡常数的影响
C. 温度(T)对反应的影响
A. 温度(T)对反应的影响(T2>T1)
D. 压强(p)对体积分数的影响(p2>p1)
C
第二章第2节 化学反应的限度
第4课时化学平衡的图像
原平衡状态
新平衡状态
改变条件平 衡 移 动
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
复习回顾
温度对化学平衡的影响是通过改变平衡常数K来实现的
改变浓度,若Q < K,平衡正向移动
改变浓度,若Q > K,平衡逆向移动
浓度对化学平衡的影响是通过改变Q与K的相对大小判断
改变压强,若Q < K,平衡正向移动
改变压强,若Q > K,平衡逆向移动
压强对化学平衡的影响是通过改变Q与K的相对大小判断
1.图像问题解题步骤
(1)看懂图像:
①看面(即弄清纵坐标与横坐标的意义);
②看线(即弄清线的走向和变化趋势);
③看点(即弄清起点、拐点、交点、终点的意义);
④看是否要作辅助线(如等温线、等压线);
⑤看定量图像中有关量的多少。
一、化学平衡图像
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。
2.原则
(1)“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A的转化率
T1
T2
0
t
B的转化率
P1
P2
0
T1>T2
P1
m+n
3、常见的平衡移动有关的图像
例1.反应aA(g)+bB(g) cC(g)在不同温度下(T1
(2)在压强一定时(如p3),温度升高,C%的变化是____,化学平衡____移动,正反应是______反应。
<
正向
吸热
增大
逆向
减小
(1)图1中,温度T1、T2的大小关系是______,温度升高,C%(C的含量)的变化是____,化学平衡____移动,正反应是_____反应。
(2)图2中,压强p1、p2的大小关系是______,压强增大,C%(C的含量)的变化是____,化学平衡____移动,a+b__c。
例2.在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
T2>T1
减小
根据图像回答下列问题:
逆向
放热
p1>p2
减小
逆向
<
例3、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) △H<0 的反应过程,若使a曲线变为b曲线,可采取的措施是( )
0
Z%
t
a
b
A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
AD
⑵转化率(或百分含量)-温度-压强图
对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01×107Pa
1.01×106Pa
1.01×105Pa
0
P
C的浓度
500℃
200℃
0
正反应放热
正反应吸热
m+n>p+q
m+n>p+q
恒温线
恒压线
“定一议二”
P
A%
300℃
200℃
0
对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应吸热
m+n=p+q
恒压线
“定一议二”
例4、对于2A(g)+B(g) C(g)+3D(g) △H>0,有如下图所示的变化,图中Y轴可能表示 ( )
P/pa
Y
100℃
200℃
300℃
0
AD
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
例5、下图是在其它条件一定时,反应2NO+O2 2NO2 △H<0 中NO的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
C点
0
A
B
C
E
D
T
NO转化率
练习:
1.T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g) X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
A.T℃时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T℃
D.T℃时,在d点加入一定量X可达到c点
C
2、在一固定体积的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)═xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6mol A、0.3mol B 和1.4mol C为起始物质,达到平衡后,C的体积分数也为W%.平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是( )
A. B. C. D.
D
3、对于可逆反应N2(g)+3H2(g) 2NH3(g)△H<0.如表所示研究目的和图示相符的是( )
B. 压强(p)对平衡常数的影响
C. 温度(T)对反应的影响
A. 温度(T)对反应的影响(T2>T1)
D. 压强(p)对体积分数的影响(p2>p1)
C
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
