2.3.2 化学反应的限度和速率的图像(共27张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 2.3.2 化学反应的限度和速率的图像(共27张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 766.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览





文档简介
(共27张PPT)
第二章第3节 化学反应的速率
第2课时 化学反应的限度和速率的图像
1.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响,认识其一般规律。
2.通过对化学反应历程的认知,认识基元反应活化能对化学反应速率的影响。
3.通过“外界条件对化学反应速率影响”等实验活动,形成并发展控制变量法的实验思想。
学习目标
知识体系
归纳总结:
外部条件对化学反应速率的影响
①当其它条件不变时,
增大反应物的浓度,可以提高化学反应速率;
减小反应物的浓度,可以降低化学反应速率。
②对于气体参加的反应,当其它条件不变时:
增大压强,可以提高化学反应速率;
减小压强,可以降低化学反应速率。
③当其它条件不变时, 升高温度,化学反应速率一般要加快;
降低温度,化学反应速率一般要减慢。
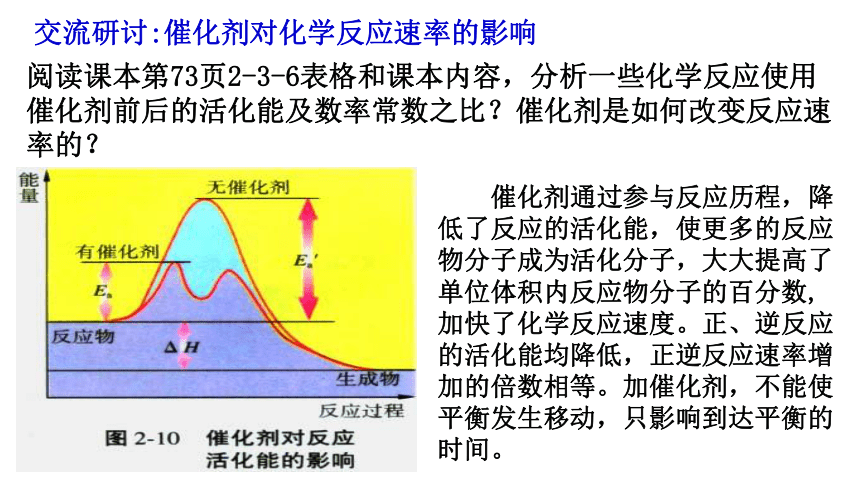
交流研讨:催化剂对化学反应速率的影响
催化剂通过参与反应历程,降低了反应的活化能,使更多的反应物分子成为活化分子,大大提高了单位体积内反应物分子的百分数,加快了化学反应速度。正、逆反应的活化能均降低,正逆反应速率增加的倍数相等。加催化剂,不能使平衡发生移动,只影响到达平衡的时间。
阅读课本第73页2-3-6表格和课本内容,分析一些化学反应使用催化剂前后的活化能及数率常数之比?催化剂是如何改变反应速率的?
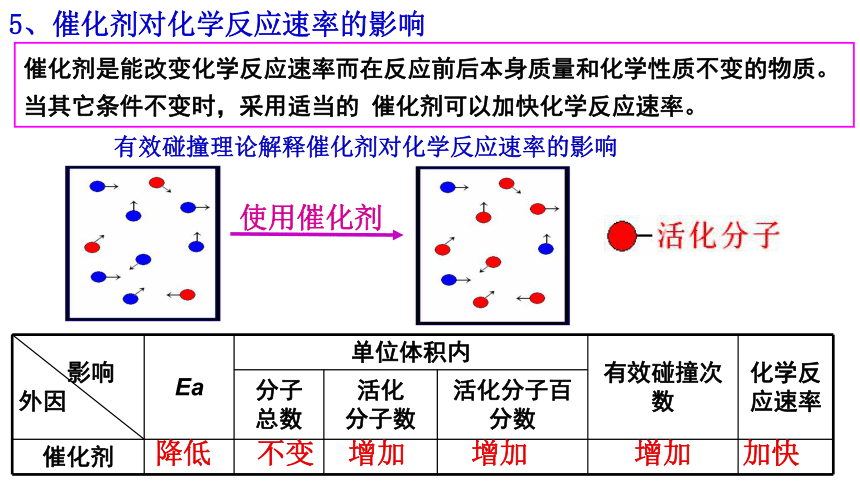
5、催化剂对化学反应速率的影响
催化剂是能改变化学反应速率而在反应前后本身质量和化学性质不变的物质。
当其它条件不变时,采用适当的 催化剂可以加快化学反应速率。
影响
外因 Ea 单位体积内 有效碰撞次数 化学反应速率
分子
总数 活化
分子数 活化分子百分数
催化剂
降低
不变
增加
增加
增加
加快
有效碰撞理论解释催化剂对化学反应速率的影响
使用催化剂
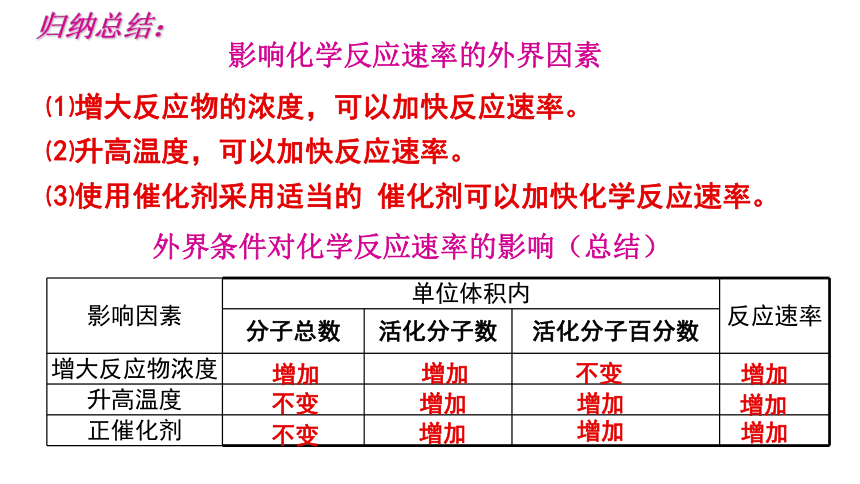
影响化学反应速率的外界因素
归纳总结:
⑴增大反应物的浓度,可以加快反应速率。
⑵升高温度,可以加快反应速率。
⑶使用催化剂采用适当的 催化剂可以加快化学反应速率。
外界条件对化学反应速率的影响(总结)
影响因素 单位体积内 反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
升高温度
正催化剂
增加
不变
不变
不变
增加
增加
增加
增加
增加
增加
增加
增加
1.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大反应物浓度 B、增大压强
C、升高温度 D、使用催化剂
D
练习
一、化学平衡图像
化学平衡的有关图像是中学化学中基础图像知识的一个重要方面,它能把抽象的化学平衡理论形象、直观地表述出来,要求能熟练地解答化学图像问题。
⑴看懂图像:一看面(横坐标与纵坐标);二看线(线的走向、变化的趋势);三看点(线的起点、交点及拐点);四看要不要作辅助线(如等温线、等压线)。
1、分析解答化学平衡图像问题要注意以下几点:
⑶方法技巧:①利用图像判断外界条件对平衡的影响时,必须找准是一种平衡状态到另一种平衡状态的变化。②平衡图像曲线上的每一个点都代表在该条件下体系的平衡状态,而曲线外的点表示该条件下体系未达到平衡。
⑵联想规律:联想外界条件对化学反应速率和化学平衡的影响规律,要求熟练准确。
(1)看图:弄清纵、横坐标的含义。
(2)看线:弄清线的走向、变化趋势及线的陡与平。
(3)看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。
(4)看变化:弄清是浓度变化、温度变化还是转化率的变化。
2、解化学反应速率与化学平衡图像题的步骤
⑴计算平衡浓度。
⑵(已知反应)判断引起平衡移动的因素。
⑶已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
3、速率-时间图像
----增大反应物浓度
0
v
t
V(正)
V(逆)
原平衡
V' (正)
V'(逆)
新平衡
t1时刻增大反应物浓度
t1
速率-时间关系图
t1时刻增大反应物浓度,
V(正)增大,V(逆)瞬间不变;
V(正) > V(逆) ;
平衡向正反应方向移动。
平衡向正反应方向移动。
-----减少生成物浓度
速率-时间关系图
0
v
t
V(正)
V(逆)
原平衡
V'(正)
V'(逆)
新平衡
t1减小生成物浓度
t1
t1减小生成物浓度;
t1时刻V(正)瞬间不变、 V(逆)突然减小;
V(正) > V(逆) ;
平衡向逆反应方向移动。
------增大生成物浓度
速率-时间关系图
新平衡
t
0
V
V(正)
V(逆)
原平衡
V'(正)
V'(逆)
t1时刻增大生成物浓度
t1
t1时刻增大生成物浓度 ;
t1时刻V(正)瞬间不变、 V(逆) 突然增大;
V(正) < V(逆);
平衡向逆反应方向移动。
------减少反应物浓度
速率-时间关系图
0
V
t
V(正)
V(逆)
原平衡
V'(正)
V'(逆)
新平衡
t1时刻减小反应物的浓度
t1
t1时刻减小反应物的浓度 ;
t1时刻V(正)突然减小、V(逆)瞬间不变;
V(正) < V(逆),
升温对吸热反应更有利,吸热反应速率增得更快。V(吸) > V(放);
--------升高温度
速率-时间关系图
V(正)
V'(吸)
新平衡
原平衡
t
0
v
V(逆)
V'(放)
t1时刻升高温度
t1
V(吸)、 V(放)都加快(比原平衡快);
升高温度;
平衡向吸热反应方向移动.
速率-时间关系图
--------降低温度
t1时刻,降低温度
0
v
t
V(正)
V(逆)
原平衡
V' (放)
V' (吸)
新平衡
t1
V(吸)、 V(放)都减慢,(比原平衡慢);
吸热反应速率变化更快V(放) > V(吸) ;
t1时刻,降低温度;
平衡向放热反应方向移动,
对于反应:aA(g)+bB(g) c C(g)+dD(g) a+b﹥c+d
速率-时间关系图
--------增大压强
平衡向正反应方向移动。
原平衡
t1时刻,增大压强
t
0
v
V(正)
V(逆)
V'(正)
V'(逆)
新平衡
t1
t1时刻,增大压强;
V(正)、 V(逆)都加快,气体系数大的一方增得多,
V(正) > V(逆) ;
-------减小压强
速率-时间关系图
对于反应:aA(g)+bB(g) c C(g)+dD(g) a+b﹥c+d
t1时刻减小压强
0
v
t
V(正)
V(逆)
原平衡
V'(逆)
V'(正)
新平衡
t1
平衡向逆反应方向移动。
t1时刻,减小压强;
V(正)、 V(逆)都减慢;
气体系数大的一方减慢得明显, V(正) < V(逆) ;
对于反应aA(g)+bB(g) cC(g)+dD(g) a+b= c+d
----------增大压强
速率-时间关系图
t1时刻增大压强
原平衡
0
v
t
V(正)
V(逆)
新平衡
V'(正)
V'(逆)
=
t1
平衡不移动。
t1时刻增大压强;
V(正)、 V(逆)都加快,比原平衡快;
V(正) = V(逆) ;
对于反应aA(g)+bB(g) cC(g)+dD(g) a+b= c+d
----------减小压强
速率-时间关系图
t1时刻减小压强
原平衡
0
v
t
V(正)
V(逆)
新平衡
V'(正)
V'(逆)
=
t1
平衡不移动。
t1时刻减小压强;
V(正)、 V(逆)都减慢,比原平衡慢;
V(正) = V(逆) ;
--催化剂对化学平衡的影响
速率-时间关系图
原平衡
t1时刻使用催化剂
0
v
t
V(正)
V(逆)
新平衡
V'(正)
V' (逆)
=
t1
化学平衡不移动。
催化剂参与反应历程,降低反应活化能,能同等程度改变化学反应速率;
V(正)、V(逆)都加快;
V'(正)=V'(逆),仍然相等;
1、右图表示反应N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
A. t0~t1
B. t2~t3
C. t3~t4
D. t5~t6
A
练习
2、可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容
器的压强
D.若a+b≠c,则t0时只能是加入了
催化剂
D
3、对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
A
4.反应2SO2(g)+O2(g) 2SO3(g) ΔH<0已达到平衡,在其他条件不变时,下列操作与图像不符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)( )
A.增加氧气的浓度 B.增大压强(减小反应器的体积)
C.升高温度 D.加入催化剂
C
5.一定条件下,在一体积不变的密闭容器中发生反应2A(g)+B(g)
3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
(1)t3时改变的条件为_____ ___,t4时改变的条件为____ ____。
(2)a________0(填“>”或“<”)。
减小压强
升高温度
>
第二章第3节 化学反应的速率
第2课时 化学反应的限度和速率的图像
1.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响,认识其一般规律。
2.通过对化学反应历程的认知,认识基元反应活化能对化学反应速率的影响。
3.通过“外界条件对化学反应速率影响”等实验活动,形成并发展控制变量法的实验思想。
学习目标
知识体系
归纳总结:
外部条件对化学反应速率的影响
①当其它条件不变时,
增大反应物的浓度,可以提高化学反应速率;
减小反应物的浓度,可以降低化学反应速率。
②对于气体参加的反应,当其它条件不变时:
增大压强,可以提高化学反应速率;
减小压强,可以降低化学反应速率。
③当其它条件不变时, 升高温度,化学反应速率一般要加快;
降低温度,化学反应速率一般要减慢。
交流研讨:催化剂对化学反应速率的影响
催化剂通过参与反应历程,降低了反应的活化能,使更多的反应物分子成为活化分子,大大提高了单位体积内反应物分子的百分数,加快了化学反应速度。正、逆反应的活化能均降低,正逆反应速率增加的倍数相等。加催化剂,不能使平衡发生移动,只影响到达平衡的时间。
阅读课本第73页2-3-6表格和课本内容,分析一些化学反应使用催化剂前后的活化能及数率常数之比?催化剂是如何改变反应速率的?
5、催化剂对化学反应速率的影响
催化剂是能改变化学反应速率而在反应前后本身质量和化学性质不变的物质。
当其它条件不变时,采用适当的 催化剂可以加快化学反应速率。
影响
外因 Ea 单位体积内 有效碰撞次数 化学反应速率
分子
总数 活化
分子数 活化分子百分数
催化剂
降低
不变
增加
增加
增加
加快
有效碰撞理论解释催化剂对化学反应速率的影响
使用催化剂
影响化学反应速率的外界因素
归纳总结:
⑴增大反应物的浓度,可以加快反应速率。
⑵升高温度,可以加快反应速率。
⑶使用催化剂采用适当的 催化剂可以加快化学反应速率。
外界条件对化学反应速率的影响(总结)
影响因素 单位体积内 反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
升高温度
正催化剂
增加
不变
不变
不变
增加
增加
增加
增加
增加
增加
增加
增加
1.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大反应物浓度 B、增大压强
C、升高温度 D、使用催化剂
D
练习
一、化学平衡图像
化学平衡的有关图像是中学化学中基础图像知识的一个重要方面,它能把抽象的化学平衡理论形象、直观地表述出来,要求能熟练地解答化学图像问题。
⑴看懂图像:一看面(横坐标与纵坐标);二看线(线的走向、变化的趋势);三看点(线的起点、交点及拐点);四看要不要作辅助线(如等温线、等压线)。
1、分析解答化学平衡图像问题要注意以下几点:
⑶方法技巧:①利用图像判断外界条件对平衡的影响时,必须找准是一种平衡状态到另一种平衡状态的变化。②平衡图像曲线上的每一个点都代表在该条件下体系的平衡状态,而曲线外的点表示该条件下体系未达到平衡。
⑵联想规律:联想外界条件对化学反应速率和化学平衡的影响规律,要求熟练准确。
(1)看图:弄清纵、横坐标的含义。
(2)看线:弄清线的走向、变化趋势及线的陡与平。
(3)看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。
(4)看变化:弄清是浓度变化、温度变化还是转化率的变化。
2、解化学反应速率与化学平衡图像题的步骤
⑴计算平衡浓度。
⑵(已知反应)判断引起平衡移动的因素。
⑶已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
3、速率-时间图像
----增大反应物浓度
0
v
t
V(正)
V(逆)
原平衡
V' (正)
V'(逆)
新平衡
t1时刻增大反应物浓度
t1
速率-时间关系图
t1时刻增大反应物浓度,
V(正)增大,V(逆)瞬间不变;
V(正) > V(逆) ;
平衡向正反应方向移动。
平衡向正反应方向移动。
-----减少生成物浓度
速率-时间关系图
0
v
t
V(正)
V(逆)
原平衡
V'(正)
V'(逆)
新平衡
t1减小生成物浓度
t1
t1减小生成物浓度;
t1时刻V(正)瞬间不变、 V(逆)突然减小;
V(正) > V(逆) ;
平衡向逆反应方向移动。
------增大生成物浓度
速率-时间关系图
新平衡
t
0
V
V(正)
V(逆)
原平衡
V'(正)
V'(逆)
t1时刻增大生成物浓度
t1
t1时刻增大生成物浓度 ;
t1时刻V(正)瞬间不变、 V(逆) 突然增大;
V(正) < V(逆);
平衡向逆反应方向移动。
------减少反应物浓度
速率-时间关系图
0
V
t
V(正)
V(逆)
原平衡
V'(正)
V'(逆)
新平衡
t1时刻减小反应物的浓度
t1
t1时刻减小反应物的浓度 ;
t1时刻V(正)突然减小、V(逆)瞬间不变;
V(正) < V(逆),
升温对吸热反应更有利,吸热反应速率增得更快。V(吸) > V(放);
--------升高温度
速率-时间关系图
V(正)
V'(吸)
新平衡
原平衡
t
0
v
V(逆)
V'(放)
t1时刻升高温度
t1
V(吸)、 V(放)都加快(比原平衡快);
升高温度;
平衡向吸热反应方向移动.
速率-时间关系图
--------降低温度
t1时刻,降低温度
0
v
t
V(正)
V(逆)
原平衡
V' (放)
V' (吸)
新平衡
t1
V(吸)、 V(放)都减慢,(比原平衡慢);
吸热反应速率变化更快V(放) > V(吸) ;
t1时刻,降低温度;
平衡向放热反应方向移动,
对于反应:aA(g)+bB(g) c C(g)+dD(g) a+b﹥c+d
速率-时间关系图
--------增大压强
平衡向正反应方向移动。
原平衡
t1时刻,增大压强
t
0
v
V(正)
V(逆)
V'(正)
V'(逆)
新平衡
t1
t1时刻,增大压强;
V(正)、 V(逆)都加快,气体系数大的一方增得多,
V(正) > V(逆) ;
-------减小压强
速率-时间关系图
对于反应:aA(g)+bB(g) c C(g)+dD(g) a+b﹥c+d
t1时刻减小压强
0
v
t
V(正)
V(逆)
原平衡
V'(逆)
V'(正)
新平衡
t1
平衡向逆反应方向移动。
t1时刻,减小压强;
V(正)、 V(逆)都减慢;
气体系数大的一方减慢得明显, V(正) < V(逆) ;
对于反应aA(g)+bB(g) cC(g)+dD(g) a+b= c+d
----------增大压强
速率-时间关系图
t1时刻增大压强
原平衡
0
v
t
V(正)
V(逆)
新平衡
V'(正)
V'(逆)
=
t1
平衡不移动。
t1时刻增大压强;
V(正)、 V(逆)都加快,比原平衡快;
V(正) = V(逆) ;
对于反应aA(g)+bB(g) cC(g)+dD(g) a+b= c+d
----------减小压强
速率-时间关系图
t1时刻减小压强
原平衡
0
v
t
V(正)
V(逆)
新平衡
V'(正)
V'(逆)
=
t1
平衡不移动。
t1时刻减小压强;
V(正)、 V(逆)都减慢,比原平衡慢;
V(正) = V(逆) ;
--催化剂对化学平衡的影响
速率-时间关系图
原平衡
t1时刻使用催化剂
0
v
t
V(正)
V(逆)
新平衡
V'(正)
V' (逆)
=
t1
化学平衡不移动。
催化剂参与反应历程,降低反应活化能,能同等程度改变化学反应速率;
V(正)、V(逆)都加快;
V'(正)=V'(逆),仍然相等;
1、右图表示反应N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
A. t0~t1
B. t2~t3
C. t3~t4
D. t5~t6
A
练习
2、可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容
器的压强
D.若a+b≠c,则t0时只能是加入了
催化剂
D
3、对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
A
4.反应2SO2(g)+O2(g) 2SO3(g) ΔH<0已达到平衡,在其他条件不变时,下列操作与图像不符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)( )
A.增加氧气的浓度 B.增大压强(减小反应器的体积)
C.升高温度 D.加入催化剂
C
5.一定条件下,在一体积不变的密闭容器中发生反应2A(g)+B(g)
3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
(1)t3时改变的条件为_____ ___,t4时改变的条件为____ ____。
(2)a________0(填“>”或“<”)。
减小压强
升高温度
>
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
