2.3.3 化学反应的限度和速率的图像(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 2.3.3 化学反应的限度和速率的图像(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 932.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:00:09 | ||
图片预览







文档简介
(共25张PPT)
第二章第3节 化学反应的速率
第3课时 化学反应的限度和速率的图像
一、化学平衡图像
化学平衡的有关图像是中学化学中基础图像知识的一个重要方面,它能把抽象的化学平衡理论形象、直观地表述出来,要求能熟练地解答化学图像问题。
⑴看懂图像:一看面(横坐标与纵坐标);二看线(线的走向、变化的趋势);三看点(线的起点、交点及拐点);四看要不要作辅助线(如等温线、等压线)。
1、分析解答化学平衡图像问题要注意以下几点:
⑶方法技巧:①利用图像判断外界条件对平衡的影响时,必须找准是一种平衡状态到另一种平衡状态的变化。②平衡图像曲线上的每一个点都代表在该条件下体系的平衡状态,而曲线外的点表示该条件下体系未达到平衡。
⑵联想规律:联想外界条件对化学反应速率和化学平衡的影响规律,要求熟练准确。
(1)看图:弄清纵、横坐标的含义。
(2)看线:弄清线的走向、变化趋势及线的陡与平。
(3)看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。
(4)看变化:弄清是浓度变化、温度变化还是转化率的变化。
2、解化学反应速率与化学平衡图像题的步骤
⑴计算平衡浓度。
⑵(已知反应)判断引起平衡移动的因素。
⑶已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
3、速率-时间图像
T
v
v逆
v正
T1
T2
T
v
v正
v逆
吸热△H>0
吸热△H>0
对于反应mA(g)+nB(g) pC(g)+qD(g)
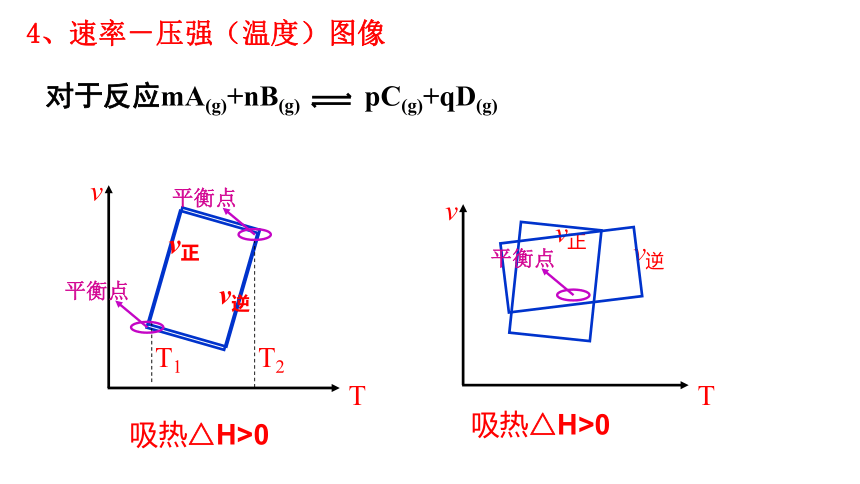
4、速率-压强(温度)图像
平衡点
平衡点
平衡点
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A的转化率
T1
T2
0
t
B的转化率
P1
P2
0
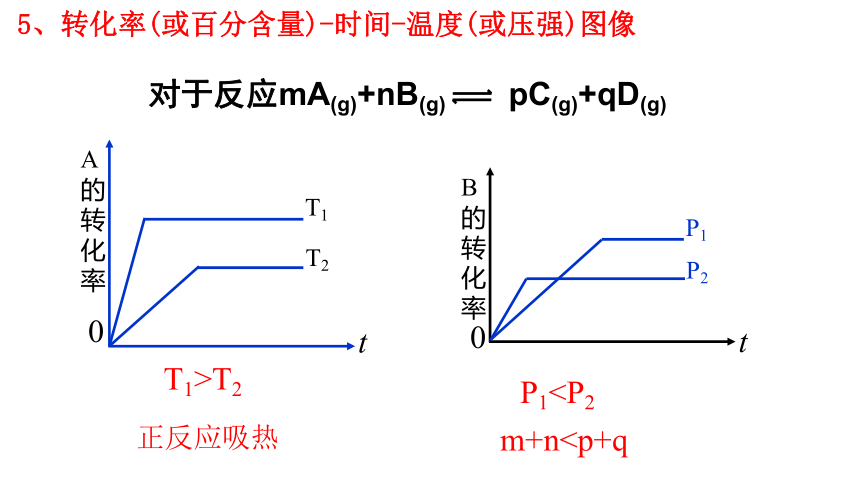
T1>T2
P1正反应吸热
m+n5、转化率(或百分含量)-时间-温度(或压强)图像
1.反应aA(g)+bB(g) cC(g)在不同温度下(T1(1)T1为一条等温线,随着压强的增大,C%____,化学平衡_____移动,a+b__c。
(2)在压强一定时(如p3),温度升高,C%的变化是____,化学平衡____移动,正反应是______反应。
<
正向
吸热
增大
逆向
减小
练习
(1)图1中,温度T1、T2的大小关系是______,温度升高,C%(C的含量)的变化是____,化学平衡____移动,正反应是_____反应。
(2)图2中,压强p1、p2的大小关系是______,压强增大,C%(C的含量)的变化是____,化学平衡____移动,a+b__c。
2.在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
T2>T1
减小
根据图像回答下列问题:
逆向
放热
p1>p2
减小
逆向
<
3、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) △H<0 的反应过程,若使a曲线变为b曲线,可采取的措施是( )
0
Z%
t
a
b
A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
AD
根据以上规律判断(填“>”“=”或“<”):
(1)反应Ⅰ:p2 p1,ΔH 0。
在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(右图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):
<
>
(2)反应Ⅱ:T1 T2,ΔH 0。
<
>
6、转化率(或百分含量)-温度-压强图像
根据以上规律判断(填“>”“=”或“<”):
在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(右图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):
(3)反应Ⅲ:若T2 T1,ΔH 0。
>(或<)
> (或<)
(4)反应Ⅳ:若T2 T1,ΔH 0。
>(或<)
>(或<)
4、对于2A(g)+B(g) C(g)+3D(g) △H>0有如下图所示的变化,图中Y轴可能表示 ( )
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
P
Y
100℃
200℃
300℃
0
AD
5.某温度下按如图装置进行实验,锥形瓶内盛有6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为 50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
A.用锌粒表示的10 s内该反应的速率为0.013 g·s-1
B.忽略锥形瓶内溶液体积的变化,用H+表示的10 s内该反应的速率为0.01 mol·L-1·s-1
C.忽略锥形瓶内溶液体积的变化,用Zn2+表示的10 s内该反应的速率为0.01 mol·L-1·s-1
D.用H2表示的10 s内该反应的速率为0.000 2 mol·s-1
C
6、下列各图中,表示2A(g)+B(g) 2C(g)(正反应放热)这个可逆反应的正确图像为( )
A
7、在恒容密闭容器中通入X并反应:2X(g) Y(g),温度T1、T2下,X的物质的量浓度c(X)随时间t变化的曲线如图所示:
(1)该反应进行到M点放出的热量 (填“>”或“<”)进行到W点放出的热量。
<
(2)T2下,在0~t1时间内,v(Y)=______mol·L-1·min-1。
(3)M点的正反应速率 (填“>”或“<”)N点的逆反应速率。
>
(4)M点时再加入一定量X,平衡后X的转化率 (填“增大”“减小”或“不变”)。
增大
8.已知可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
D
9.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示。下列说法正确的是( )
A.反应 I2(aq)+I-(aq) I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
C(I3-)
T
T1
T2
T3
A
B
C
D
0
BC
10.在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
t/s
VY/(mol·L-1·s-1)
a
b
d
O
B
11、反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为( )
A B C D
V
t
V正
V逆
V
t
V逆
V正
V
t
V逆
V正
V
t
V正
V逆
C
12、可逆反应2A+B 2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B不可能都是气体
E. A和B可能都是气体
平均摩尔质量
温度
CE
⑵此反应的正反应是___热反应。
⑶T1到T2变化时,V正 V逆;T3时,V正 V逆;T3到T4变化时,V正 V逆。
放
⑴A、B、C、D、E中,尚未达到化学平衡状态的点是 。
>
=
<
A、B
平衡点
均达平衡
13、在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2(g)+3H2(g) 2NH3(g)△H<0,在第7秒时分别测定其中的体积分数,并绘成下图曲线。
AC段化学反应尚未平衡,受速率控制,T升高,反应速率加快,φ(NH3)增大为增函数;CE段达到平衡后受平衡因素控制,T升高,平衡向吸热的逆向移动,故φ(NH3)下降为减函数。
⑷AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为是 。
14、500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
A.反应开始到第10min,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20 min时可能是使用了催化剂.
C.从曲线变化可以看出,反应进行至25min时,
分离出0.1mol的氨气
D.在25min时平衡正向移动但达到新平衡后
NH3的体积分数比原平衡小
BC
D.在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
平衡怎么移动?为什么?
算K和Q的关系!
体积分数怎么变?
第二章第3节 化学反应的速率
第3课时 化学反应的限度和速率的图像
一、化学平衡图像
化学平衡的有关图像是中学化学中基础图像知识的一个重要方面,它能把抽象的化学平衡理论形象、直观地表述出来,要求能熟练地解答化学图像问题。
⑴看懂图像:一看面(横坐标与纵坐标);二看线(线的走向、变化的趋势);三看点(线的起点、交点及拐点);四看要不要作辅助线(如等温线、等压线)。
1、分析解答化学平衡图像问题要注意以下几点:
⑶方法技巧:①利用图像判断外界条件对平衡的影响时,必须找准是一种平衡状态到另一种平衡状态的变化。②平衡图像曲线上的每一个点都代表在该条件下体系的平衡状态,而曲线外的点表示该条件下体系未达到平衡。
⑵联想规律:联想外界条件对化学反应速率和化学平衡的影响规律,要求熟练准确。
(1)看图:弄清纵、横坐标的含义。
(2)看线:弄清线的走向、变化趋势及线的陡与平。
(3)看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。
(4)看变化:弄清是浓度变化、温度变化还是转化率的变化。
2、解化学反应速率与化学平衡图像题的步骤
⑴计算平衡浓度。
⑵(已知反应)判断引起平衡移动的因素。
⑶已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
3、速率-时间图像
T
v
v逆
v正
T1
T2
T
v
v正
v逆
吸热△H>0
吸热△H>0
对于反应mA(g)+nB(g) pC(g)+qD(g)
4、速率-压强(温度)图像
平衡点
平衡点
平衡点
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A的转化率
T1
T2
0
t
B的转化率
P1
P2
0
T1>T2
P1
m+n
1.反应aA(g)+bB(g) cC(g)在不同温度下(T1
(2)在压强一定时(如p3),温度升高,C%的变化是____,化学平衡____移动,正反应是______反应。
<
正向
吸热
增大
逆向
减小
练习
(1)图1中,温度T1、T2的大小关系是______,温度升高,C%(C的含量)的变化是____,化学平衡____移动,正反应是_____反应。
(2)图2中,压强p1、p2的大小关系是______,压强增大,C%(C的含量)的变化是____,化学平衡____移动,a+b__c。
2.在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g) cC(g)为例]。
T2>T1
减小
根据图像回答下列问题:
逆向
放热
p1>p2
减小
逆向
<
3、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) △H<0 的反应过程,若使a曲线变为b曲线,可采取的措施是( )
0
Z%
t
a
b
A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
AD
根据以上规律判断(填“>”“=”或“<”):
(1)反应Ⅰ:p2 p1,ΔH 0。
在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(右图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):
<
>
(2)反应Ⅱ:T1 T2,ΔH 0。
<
>
6、转化率(或百分含量)-温度-压强图像
根据以上规律判断(填“>”“=”或“<”):
在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(右图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):
(3)反应Ⅲ:若T2 T1,ΔH 0。
>(或<)
> (或<)
(4)反应Ⅳ:若T2 T1,ΔH 0。
>(或<)
>(或<)
4、对于2A(g)+B(g) C(g)+3D(g) △H>0有如下图所示的变化,图中Y轴可能表示 ( )
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
P
Y
100℃
200℃
300℃
0
AD
5.某温度下按如图装置进行实验,锥形瓶内盛有6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为 50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
A.用锌粒表示的10 s内该反应的速率为0.013 g·s-1
B.忽略锥形瓶内溶液体积的变化,用H+表示的10 s内该反应的速率为0.01 mol·L-1·s-1
C.忽略锥形瓶内溶液体积的变化,用Zn2+表示的10 s内该反应的速率为0.01 mol·L-1·s-1
D.用H2表示的10 s内该反应的速率为0.000 2 mol·s-1
C
6、下列各图中,表示2A(g)+B(g) 2C(g)(正反应放热)这个可逆反应的正确图像为( )
A
7、在恒容密闭容器中通入X并反应:2X(g) Y(g),温度T1、T2下,X的物质的量浓度c(X)随时间t变化的曲线如图所示:
(1)该反应进行到M点放出的热量 (填“>”或“<”)进行到W点放出的热量。
<
(2)T2下,在0~t1时间内,v(Y)=______mol·L-1·min-1。
(3)M点的正反应速率 (填“>”或“<”)N点的逆反应速率。
>
(4)M点时再加入一定量X,平衡后X的转化率 (填“增大”“减小”或“不变”)。
增大
8.已知可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
D
9.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示。下列说法正确的是( )
A.反应 I2(aq)+I-(aq) I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
C(I3-)
T
T1
T2
T3
A
B
C
D
0
BC
10.在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
t/s
VY/(mol·L-1·s-1)
a
b
d
O
B
11、反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为( )
A B C D
V
t
V正
V逆
V
t
V逆
V正
V
t
V逆
V正
V
t
V正
V逆
C
12、可逆反应2A+B 2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B不可能都是气体
E. A和B可能都是气体
平均摩尔质量
温度
CE
⑵此反应的正反应是___热反应。
⑶T1到T2变化时,V正 V逆;T3时,V正 V逆;T3到T4变化时,V正 V逆。
放
⑴A、B、C、D、E中,尚未达到化学平衡状态的点是 。
>
=
<
A、B
平衡点
均达平衡
13、在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2(g)+3H2(g) 2NH3(g)△H<0,在第7秒时分别测定其中的体积分数,并绘成下图曲线。
AC段化学反应尚未平衡,受速率控制,T升高,反应速率加快,φ(NH3)增大为增函数;CE段达到平衡后受平衡因素控制,T升高,平衡向吸热的逆向移动,故φ(NH3)下降为减函数。
⑷AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为是 。
14、500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
A.反应开始到第10min,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20 min时可能是使用了催化剂.
C.从曲线变化可以看出,反应进行至25min时,
分离出0.1mol的氨气
D.在25min时平衡正向移动但达到新平衡后
NH3的体积分数比原平衡小
BC
D.在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
平衡怎么移动?为什么?
算K和Q的关系!
体积分数怎么变?
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
