2.4 化学反应条件的优化——工业合成氨(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 2.4 化学反应条件的优化——工业合成氨(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 579.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:00:49 | ||
图片预览






文档简介
(共21张PPT)
第二章第4节 化学反应条件的优化
——工业合成氨
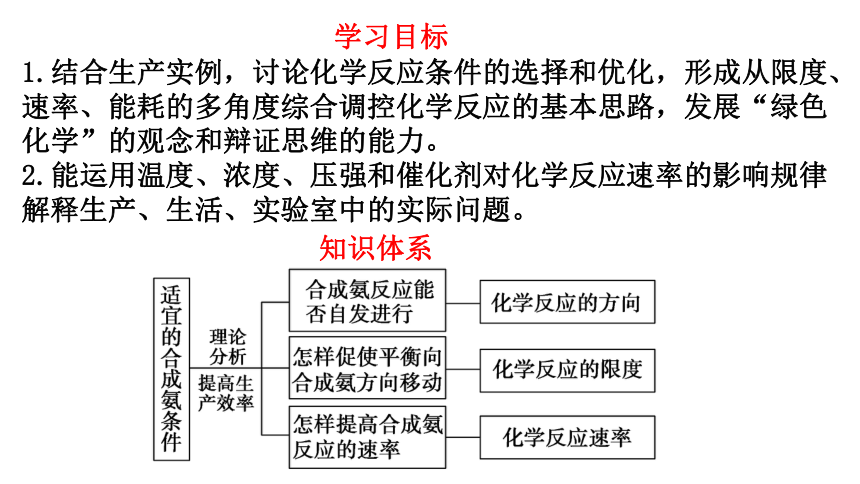
学习目标
知识体系
1.结合生产实例,讨论化学反应条件的选择和优化,形成从限度、速率、能耗的多角度综合调控化学反应的基本思路,发展“绿色化学”的观念和辩证思维的能力。
2.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的实际问题。
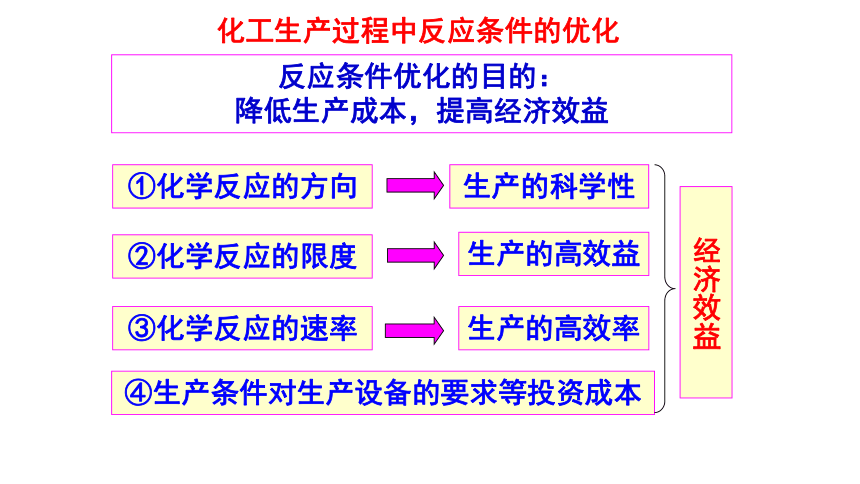
化工生产过程中反应条件的优化
反应条件优化的目的:
降低生产成本,提高经济效益
②化学反应的限度
③化学反应的速率
生产的高效益
生产的高效率
④生产条件对生产设备的要求等投资成本
经济效益
①化学反应的方向
生产的科学性
交流研讨
阅读课本第76-77页,以合成氨为例来分析反应条件的选择
1.请根据正反应的焓变和熵变分析在298K下合成氨反应能否自发进行?
△H-T△S= -92.2KJ·mol-1-298K×(-198.2×10-3KJ·K-1 ·mol -1 )
= -33.1KJ·mol-1<0
反应能自发进行
一、合成氨反应的限度
降低温、增大压强有利于化学平衡正向移动,
N2、H2浓度比为1:3,平衡混合物中氨的含量最高。
2.根据合成氨反应的特点,利用影响化学平衡移动的因素,分析什么条件有利于氨的合成?
1、结合影响反应速率的因素,你认为通过控制什哪些反应条件来提高合成氨反应的速率?
(1)温度: (2)压强:
(3)浓度: (4)催化剂:
二、合成氨反应的速率
升高温度
增大压强
增大反应物浓度
使用催化剂
交流研讨:
阅读课本第77-78页
增大N2、H2浓度,将氨及时从混合气中分离出去
请你根据关系式分析:各物质的浓度对反应速率有哪些影响?可以采取哪些措施来提高反应速率?
2、实验表明,在特定条件下,合成氨反应的速率与反应的物质的浓度的关系为:v =kc(N2)c1.5(H2)c-1(NH3)
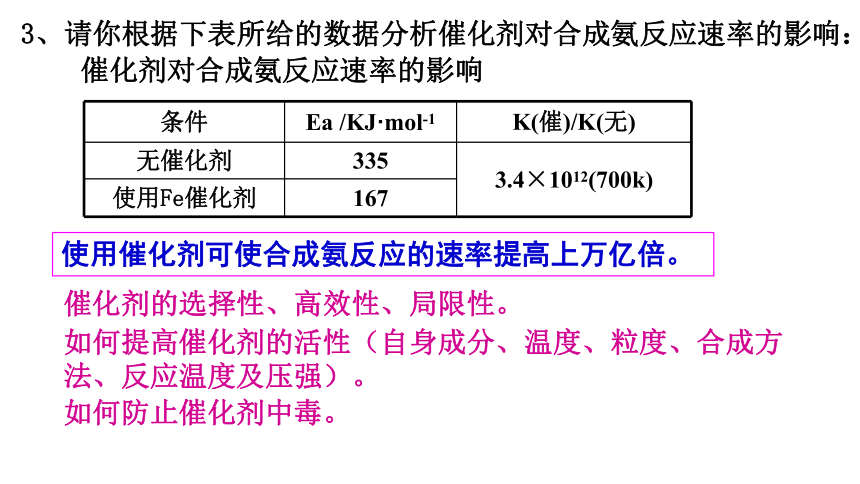
3、请你根据下表所给的数据分析催化剂对合成氨反应速率的影响:
催化剂对合成氨反应速率的影响
条件 Ea /KJ·mol-1 K(催)/K(无)
无催化剂 335 3.4×1012(700k)
使用Fe催化剂 167
使用催化剂可使合成氨反应的速率提高上万亿倍。
催化剂的选择性、高效性、局限性。
如何提高催化剂的活性(自身成分、温度、粒度、合成方法、反应温度及压强)。
如何防止催化剂中毒。
1、根据合成氨反应的特点,应分别采取什么措施提高反应的平衡转化率和反应速率?请填写课本第79页表格
三、合成氨的适宜条件
交流研讨
⑵既然增大压强既可提高反应速率,又可提高氨的产量,那么在合成氨工业中压强是否越大越好?
⑴既然降低温度有利于平衡向生成氨的方向移动,那么生产中是否温度越低越好?
⑶在合成氨工业中要使用催化剂,既然催化剂对化学平衡的移动没有影响,为什么还要使用呢?
2、请你尝试为合成氨选择适宜条件
合成氨适宜条件
催化剂_________
温度__________________________
根据设备动力选择压强________________
N2、H2投料比______
及时分离________
铁
700K左右(催化剂的活性温度)
1×107~ 1×108Pa
1:2.8
氨气
1、已知2SO2(g)+O2(g) 2SO3 (g) △H<0其实验数据见表
(1) 应选用的温度是______。
应采用的压强是______,理由是___________
________________________________________________________________________________。
450℃
常压
因为常压下SO2
的转化率已经很高,若采用较大压强,SO2的转化率提高很少,但需要的动力更大,对设备的要求更高
练习:
2、氨的合成反应,生产中采用的适宜条件是( )
A、低温、高压、适当的催化剂
B、高温、常压
C、尽可能高温、高压
D、适当的温度、适当的高压、适宜催化剂
D
3.下列有关工业合成氨的叙述中正确的是( )
A.温度升高,不利于提高合成氨的反应速率
B.工业上选择合适的条件,可以使氮气全部转化为氨
C.合成氨反应化学平衡的移动受到温度、反应物浓度、压强等因素的影响
D.使用铁催化剂,可以使氮气和氢气化合的速率明显加快
CD
4.在一定温度下,在恒压容器 a 与恒容容器 b 中,分别盛入体积比为1∶3 的N2和H2,开始时体积相同,达到平衡时,N2的转化率应该是( )
A. a大 B. b大
C. a、b一样大 D.不一定
A
平衡后,恒压容器 压强大, 恒容容器容积大!
5.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的体积分数接近于( )
A.5% B.10% C.15% D.20%
C
列三段式
6.下列所述情况表示合成氨反应达到平衡状态的是( )
A、H2的消耗速率与NH3的生成速率之比为3∶2
B、混合气体的平均相对分子质量不再改变
C、N2的生成速率与NH3的生成速率之比为1∶1
D、密闭容器中H2、N2、NH3的物质的量之比为3∶1∶2
B
7、合成氨技术的发明使工业化人工固氮成为现实。
(1)下列有关合成氨工业的叙述,不能用平衡移动原理来解释的是_____。
A、使用铁催化剂有利于合成氨的反应
B、高压比常压更有利于合成氨的反应
C、500 ℃左右比室温更有利于合成氨的反应
D、使反应混合物中的氨液化后分离有利于合成氨的反应
AC
(2)已知工业合成氨N2(g)+3H2(g) 2NH3(g)ΔH=-92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的 N2 和 H2 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2、t4、t7时刻所对应的实验条件改变分别是:
t2 t4 t7 。
增大N2或H2的浓度
加入催化剂
降温
增上减下、
哪移哪大、
温压要断、
浓度相连
规律总结:
②温度为T ℃时,将2a mol H2和a mol N2放入0.5 L密闭容器中,充分反应达平衡后测得N2的转化率为50%,此时放出热量46.1 kJ,则该温度下反应的平衡常数为__________。
4.0
用三段式计算: N2(g) + 3H2(g) 2NH3(g)
起始物质的量浓度(mol L-1): 2a 4a 0
转化物质的量浓度(mol L-1): a 3a 2a
平衡物质的量浓度(mol L-1): a a 2a
平衡常数K=4a2/a4=4/a2
平衡时放出热量46.1 kJ,则平衡时N2转化了0.5 mol,0.5a=0.5 mol,a=1.0,K=4.0。
8.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2 (g) 2SO3 (g)ΔH =-198kJ·mol-1 。如表为不同温度和压强下SO2的转化率(%)
催化剂
△
====
(1)从理论上分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是_____________。
(2)实际生产中,选定400 ℃~500 ℃作为操作温度其原因是__________________。
(3)实际生产中,采用的压强为常压,其原因是__________________________________。
(4)在生产中,通入过量空气的目的___________。
(5)尾气中的SO2必须回收是为了_________。
低温,高压
该温度催化剂的活性最高,选择此温度可提高反应速率,缩短反应达到平衡所需要的时间
因为在常压下400 ℃~500 ℃时SO2的转化率已经很高了,若再加压,对设备及动力系统要求高,加大了成本和能量消耗,不合适
增大氧气的浓度,使平衡向生成SO3的方向移动,提高二氧化硫的转化率
减少对环境的污染
9、0.1 mol CO2与0.3 mol C在恒压密闭容器中发生反应:CO2(g)+C(s) 2CO(g)。平衡时,体系中各气体的体积分数与温度的关系如图。已知:用气体分压表示的化学平衡常数Kp= P2平(CO)/P平(CO2) ;气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.650 ℃时,CO2的平衡转化率为25%
B.800 ℃达平衡时,若充入气体He,v正C.T ℃达平衡时,若充入等体积的CO2和CO时,v正>v逆
D.925 ℃时,用平衡气体分压表示的化学平衡常数Kp=23.04p总
AD
CO%
CO2%
都是平衡点
第二章第4节 化学反应条件的优化
——工业合成氨
学习目标
知识体系
1.结合生产实例,讨论化学反应条件的选择和优化,形成从限度、速率、能耗的多角度综合调控化学反应的基本思路,发展“绿色化学”的观念和辩证思维的能力。
2.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的实际问题。
化工生产过程中反应条件的优化
反应条件优化的目的:
降低生产成本,提高经济效益
②化学反应的限度
③化学反应的速率
生产的高效益
生产的高效率
④生产条件对生产设备的要求等投资成本
经济效益
①化学反应的方向
生产的科学性
交流研讨
阅读课本第76-77页,以合成氨为例来分析反应条件的选择
1.请根据正反应的焓变和熵变分析在298K下合成氨反应能否自发进行?
△H-T△S= -92.2KJ·mol-1-298K×(-198.2×10-3KJ·K-1 ·mol -1 )
= -33.1KJ·mol-1<0
反应能自发进行
一、合成氨反应的限度
降低温、增大压强有利于化学平衡正向移动,
N2、H2浓度比为1:3,平衡混合物中氨的含量最高。
2.根据合成氨反应的特点,利用影响化学平衡移动的因素,分析什么条件有利于氨的合成?
1、结合影响反应速率的因素,你认为通过控制什哪些反应条件来提高合成氨反应的速率?
(1)温度: (2)压强:
(3)浓度: (4)催化剂:
二、合成氨反应的速率
升高温度
增大压强
增大反应物浓度
使用催化剂
交流研讨:
阅读课本第77-78页
增大N2、H2浓度,将氨及时从混合气中分离出去
请你根据关系式分析:各物质的浓度对反应速率有哪些影响?可以采取哪些措施来提高反应速率?
2、实验表明,在特定条件下,合成氨反应的速率与反应的物质的浓度的关系为:v =kc(N2)c1.5(H2)c-1(NH3)
3、请你根据下表所给的数据分析催化剂对合成氨反应速率的影响:
催化剂对合成氨反应速率的影响
条件 Ea /KJ·mol-1 K(催)/K(无)
无催化剂 335 3.4×1012(700k)
使用Fe催化剂 167
使用催化剂可使合成氨反应的速率提高上万亿倍。
催化剂的选择性、高效性、局限性。
如何提高催化剂的活性(自身成分、温度、粒度、合成方法、反应温度及压强)。
如何防止催化剂中毒。
1、根据合成氨反应的特点,应分别采取什么措施提高反应的平衡转化率和反应速率?请填写课本第79页表格
三、合成氨的适宜条件
交流研讨
⑵既然增大压强既可提高反应速率,又可提高氨的产量,那么在合成氨工业中压强是否越大越好?
⑴既然降低温度有利于平衡向生成氨的方向移动,那么生产中是否温度越低越好?
⑶在合成氨工业中要使用催化剂,既然催化剂对化学平衡的移动没有影响,为什么还要使用呢?
2、请你尝试为合成氨选择适宜条件
合成氨适宜条件
催化剂_________
温度__________________________
根据设备动力选择压强________________
N2、H2投料比______
及时分离________
铁
700K左右(催化剂的活性温度)
1×107~ 1×108Pa
1:2.8
氨气
1、已知2SO2(g)+O2(g) 2SO3 (g) △H<0其实验数据见表
(1) 应选用的温度是______。
应采用的压强是______,理由是___________
________________________________________________________________________________。
450℃
常压
因为常压下SO2
的转化率已经很高,若采用较大压强,SO2的转化率提高很少,但需要的动力更大,对设备的要求更高
练习:
2、氨的合成反应,生产中采用的适宜条件是( )
A、低温、高压、适当的催化剂
B、高温、常压
C、尽可能高温、高压
D、适当的温度、适当的高压、适宜催化剂
D
3.下列有关工业合成氨的叙述中正确的是( )
A.温度升高,不利于提高合成氨的反应速率
B.工业上选择合适的条件,可以使氮气全部转化为氨
C.合成氨反应化学平衡的移动受到温度、反应物浓度、压强等因素的影响
D.使用铁催化剂,可以使氮气和氢气化合的速率明显加快
CD
4.在一定温度下,在恒压容器 a 与恒容容器 b 中,分别盛入体积比为1∶3 的N2和H2,开始时体积相同,达到平衡时,N2的转化率应该是( )
A. a大 B. b大
C. a、b一样大 D.不一定
A
平衡后,恒压容器 压强大, 恒容容器容积大!
5.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的体积分数接近于( )
A.5% B.10% C.15% D.20%
C
列三段式
6.下列所述情况表示合成氨反应达到平衡状态的是( )
A、H2的消耗速率与NH3的生成速率之比为3∶2
B、混合气体的平均相对分子质量不再改变
C、N2的生成速率与NH3的生成速率之比为1∶1
D、密闭容器中H2、N2、NH3的物质的量之比为3∶1∶2
B
7、合成氨技术的发明使工业化人工固氮成为现实。
(1)下列有关合成氨工业的叙述,不能用平衡移动原理来解释的是_____。
A、使用铁催化剂有利于合成氨的反应
B、高压比常压更有利于合成氨的反应
C、500 ℃左右比室温更有利于合成氨的反应
D、使反应混合物中的氨液化后分离有利于合成氨的反应
AC
(2)已知工业合成氨N2(g)+3H2(g) 2NH3(g)ΔH=-92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的 N2 和 H2 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2、t4、t7时刻所对应的实验条件改变分别是:
t2 t4 t7 。
增大N2或H2的浓度
加入催化剂
降温
增上减下、
哪移哪大、
温压要断、
浓度相连
规律总结:
②温度为T ℃时,将2a mol H2和a mol N2放入0.5 L密闭容器中,充分反应达平衡后测得N2的转化率为50%,此时放出热量46.1 kJ,则该温度下反应的平衡常数为__________。
4.0
用三段式计算: N2(g) + 3H2(g) 2NH3(g)
起始物质的量浓度(mol L-1): 2a 4a 0
转化物质的量浓度(mol L-1): a 3a 2a
平衡物质的量浓度(mol L-1): a a 2a
平衡常数K=4a2/a4=4/a2
平衡时放出热量46.1 kJ,则平衡时N2转化了0.5 mol,0.5a=0.5 mol,a=1.0,K=4.0。
8.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2 (g) 2SO3 (g)ΔH =-198kJ·mol-1 。如表为不同温度和压强下SO2的转化率(%)
催化剂
△
====
(1)从理论上分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是_____________。
(2)实际生产中,选定400 ℃~500 ℃作为操作温度其原因是__________________。
(3)实际生产中,采用的压强为常压,其原因是__________________________________。
(4)在生产中,通入过量空气的目的___________。
(5)尾气中的SO2必须回收是为了_________。
低温,高压
该温度催化剂的活性最高,选择此温度可提高反应速率,缩短反应达到平衡所需要的时间
因为在常压下400 ℃~500 ℃时SO2的转化率已经很高了,若再加压,对设备及动力系统要求高,加大了成本和能量消耗,不合适
增大氧气的浓度,使平衡向生成SO3的方向移动,提高二氧化硫的转化率
减少对环境的污染
9、0.1 mol CO2与0.3 mol C在恒压密闭容器中发生反应:CO2(g)+C(s) 2CO(g)。平衡时,体系中各气体的体积分数与温度的关系如图。已知:用气体分压表示的化学平衡常数Kp= P2平(CO)/P平(CO2) ;气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.650 ℃时,CO2的平衡转化率为25%
B.800 ℃达平衡时,若充入气体He,v正
D.925 ℃时,用平衡气体分压表示的化学平衡常数Kp=23.04p总
AD
CO%
CO2%
都是平衡点
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
