3.1.1 水与水溶液(第1课时)(共20张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 3.1.1 水与水溶液(第1课时)(共20张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 637.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:01:38 | ||
图片预览






文档简介
(共20张PPT)
第三章物质在水溶液中的行为
第1节 水与水溶液(第1课时)
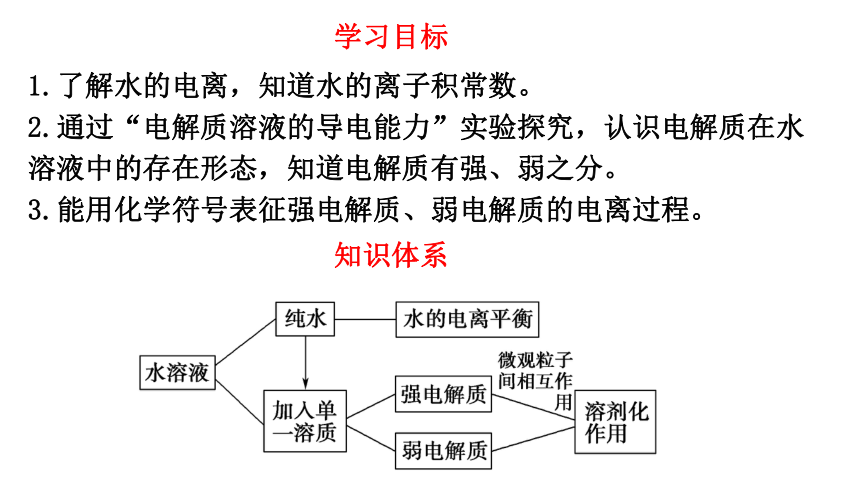
学习目标
知识体系
1.了解水的电离,知道水的离子积常数。
2.通过“电解质溶液的导电能力”实验探究,认识电解质在水溶液中的存在形态,知道电解质有强、弱之分。
3.能用化学符号表征强电解质、弱电解质的电离过程。
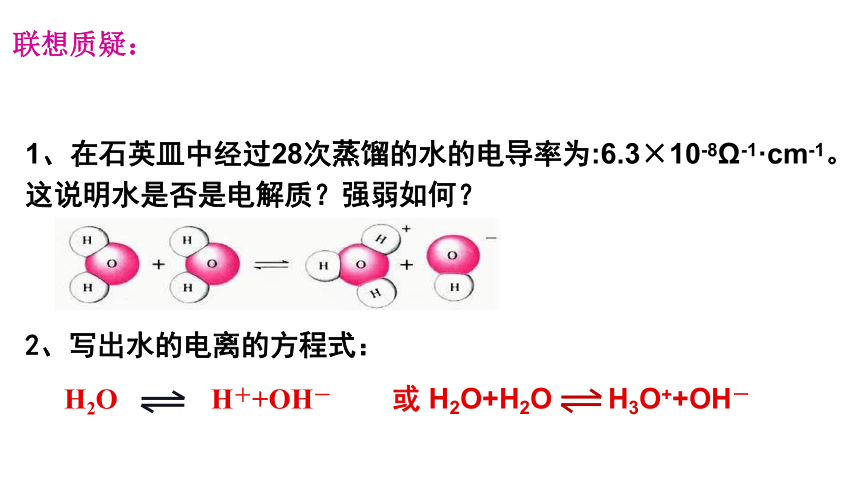
联想质疑:
1、在石英皿中经过28次蒸馏的水的电导率为:6.3×10-8Ω-1·cm-1。这说明水是否是电解质?强弱如何?
2、写出水的电离的方程式:
H2O H++OH-
或 H2O+H2O H3O++OH-
Kw=c平(H+) c平(OH-)
3、室温下1L水(约55.6mol )H2O中只有1×10-7 mol H2O电离,试求水的电离平衡常数。
一、水的电离
KW= c平(H+) c平(OH-)
1、水是极弱的电解质,水的电离存在电离平衡。
在一定温度下KW是常数,在不同温度下KW数值不同。水的电离是一个吸热过程,KW只与温度有关,温度越高,KW 越大。
25℃时,水的离子积KW=c平(H+) c平(OH-)=1×10-14 mol2 ·L-2。
H2O H++OH-
或 H2O+H2O H3O++OH-
2、KW叫水的离子积常数,简称水的离子积,
⑴表达式为:
⑵影响因素:温度
⑶适用范围:纯水或稀的电解质溶液
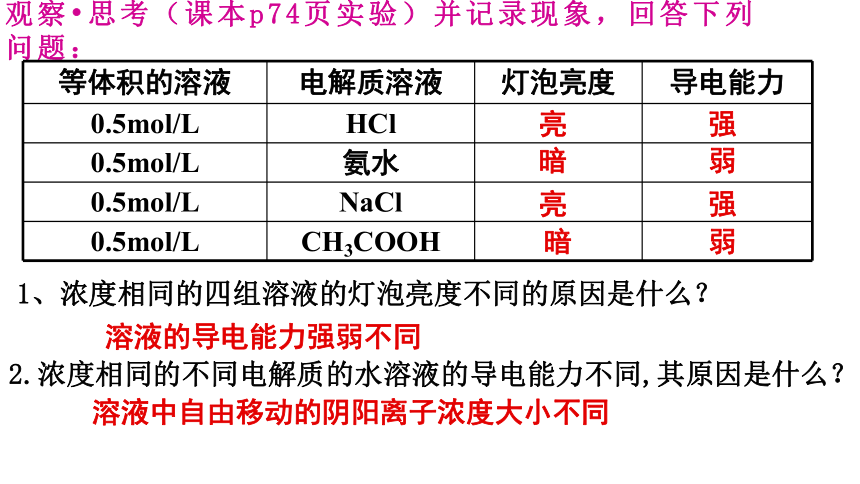
观察 思考(课本p74页实验)并记录现象,回答下列问题:
等体积的溶液 电解质溶液 灯泡亮度 导电能力
0.5mol/L HCl
0.5mol/L 氨水
0.5mol/L NaCl
0.5mol/L CH3COOH
强
弱
强
弱
亮
暗
亮
暗
2.浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?
1、浓度相同的四组溶液的灯泡亮度不同的原因是什么?
溶液的导电能力强弱不同
溶液中自由移动的阴阳离子浓度大小不同
灯泡的亮度
3.浓度相同的不同电解质的水溶液的自由离子浓度不同,其原因是什么?
←溶液的导电能力
←溶液中自由移动的阴阳离子浓度
←电解质的电离程度大小
←相同浓度的电解质的强弱
电解质的电离程度大小不同
总结:
盐酸:阴、阳离子
醋酸:分子和阴阳离子
氯化氢、醋酸等电解质在溶于水以后,都会电离,但是电解质的电离程度大小不同,氯化氢全部电离,醋酸部分电离。
4.氯化氢、醋酸等电解质在溶于水的过程中发生了哪些变化?它们最终以何种形态存在?
⑵弱电解质:在稀的水溶液里部分电离的电解质。包括弱酸、弱碱、水。
强电解质在水溶液中存在形态: 阴、阳离子(水合离子)
弱电解质在水溶液中存在形态:分子和阴阳离子(水合分子和水合离子)
⑴强电解质:在稀的水溶液里能完全电离的电解质。包括强酸、强碱、大部分盐。
1、电解质在水溶液中的存在形态
二、电解质在水溶液中的存在形态
总结:强弱电解质溶液的组成成分
电解质溶液
水
电解质
强电解质
弱电解质
全部电离
部分电离
弱电解质分子
电解质阴、阳离子
电解质阴、阳离子
水分子、少量H+、OH-
强电解质溶液
弱电解质溶液
练习
1、判断正误:
⑴强电解质溶液一定比弱电解质溶液的导电能力强。
⑵BaSO4的水溶液导电能力很弱,所以硫酸钡是弱电解质。
⑶相同条件下,浓度均为1mol/L 的HCl和CH3COOH溶液,HCl溶液的导电能力强,所以HCl是强电解质,CH3COOH是弱电解质。
×
×
×
纯水中:c(H+)=c(OH-)
2. 影响水的电离平衡的因素
H2O H+ + OH-
△H>0
升高温度,促进水的电离,Kw增大
水的电离是个吸热过程,升高温度:
平衡向 移动, [H+] ,[OH-] , Kw 。
右
增大
增大
增大
注意:水的离子积Kw只随温度的改变而改变
Kw适用于一定温度下任何稀的水溶液
(1)温度影响
H2O H++OH- ΔH>0
条件变化 移动方向 c平(H+) c平(OH-) KW 对平衡的影响
加酸
加碱
加活泼金属,如Na
向左移动
增大
减小
不变
抑制
向左移动
减小
增大
不变
抑制
向右移动
减小
增大
不变
促进
(2)加入酸或碱等物质
加入酸或碱,抑制水的电离,Kw不变。
思考:
1、酸溶液中的OH-、 H+是否都是由水电离出的?
2、碱溶液中的OH-、 H+是否都是由水电离出的?
3、盐溶液中的OH-、 H+是否都是由水电离出的?
c平(H+)=c酸(H+)+ c水(H+)
c平(OH-)=c水(OH-)
c平(OH-)=c碱(OH-)+ c水(OH-)
c平(H+)=c水(H+)
主要是酸电离的
主要是碱电离的
酸式盐和酸类似,正盐溶液中OH-、 H+都是由水电离出的。
都符合:KW= c平(H+) c平(OH-)
⑴水的离子积不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液在任何水溶液中,均存在水的电离平衡,Kw=c平(H+)·c平(OH-)
均成立。
结论:
⑵Kw只随温度变化,升高温度,Kw增大。
25℃时,Kw=1×10-14(mol/L)2。
⑶酸溶液和碱溶液中都同时存在H+和OH-,且:
水电离出的 c水(H+)=c水(OH-)。
酸溶液中:c平(H+)=c酸(H+)+c水(H+) c平(OH-)=c水(OH-)
碱溶液中: c平(OH-)=c碱(OH-)+c水(OH-) c平(H+)=c水(H+)
1、下列五种溶液中c平(H+)由大到小的排列顺序 。
A.0. 1 mol·L-1的盐酸;
B.0.1 mol·L-1的硫酸;
C. 0.1 mol·L-1的NaOH;
D. 0.1 mol·L-1的CH3COOH;
E. 0.1 mol·L-1的NaCl;
B A D E C
0.1mol/L
0.2mol/L
1×10-13mol/L
小于0.1mol/L
1×10-7mol/L
练习
2、判断正误:
⑴任何水溶液中都存在水的电离平衡。
⑵任何水溶液中(不论酸、碱或中性),都存在Kw=10-14 mol2 L-2
⑶25℃ 时,某溶液中c平(H+)= 10-7mol L-1,则该溶液一定是纯水。
⑷某温度下,纯水中H+浓度为1×10-6mol L-1,则溶液显酸性
√
×
×
×
练习
3. 0.1mol/L的盐酸溶液中, c平(H+)=? 、 c平(OH-)=? 由水电离出的c水(OH-)=?、 c水(H+)=?
练(OH-)=KW÷c平(H+)=1×10-14mol L-1÷0.1mol L-1=1×10-13mol L-1
c平(H+)=0.1mol L-1
KW= c平(H+) c平(OH-),
由水电离出的c水(OH-)=c水(H+)=c平(OH-)=1×10-13mol L-1
c水(H+)=c(OH-)水=c平(H+)=c平(OH-)=1×10-7mol L-1
5. 0.1mol/L的NaCl溶液中,c平(OH-)=?、c平(H+)=?
由水电离出的c水(OH-)=c水(H+)=c平(H+)=1×10-13mol L-1
c平(H+)=KW÷c平(OH-)=1×10-14mol L-1÷0.1mol L-1=1×10-13mol L-1
c平(OH-)=0.1mol L-1
KW= c平(H+) c平(OH-),
4. 0.1mol/L的NaOH溶液中, c平(OH-)=?、c平(H+)=?、由水电离出的c水(OH-)=?、 c水(H+)=?
练习
6、计算:
⑴在25℃ 0.01mol/L盐酸溶液中:
c平(H+) = ,c平(OH-) = ;
c平(H+)水= ,c平(OH-)水= 。
⑵在25℃ 0.01mol/L NaOH溶液中:
c平(H+)= ,c平(OH-)= ;
c平(H+)水= , c平(OH-)水= 。
⑶ 0.1mol/L的NaCl溶液中:
c平(OH-)= ,c平(H+)= 。
0.01mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
0.01mol L-1
10-7mol L-1
10-7mol L-1
第三章物质在水溶液中的行为
第1节 水与水溶液(第1课时)
学习目标
知识体系
1.了解水的电离,知道水的离子积常数。
2.通过“电解质溶液的导电能力”实验探究,认识电解质在水溶液中的存在形态,知道电解质有强、弱之分。
3.能用化学符号表征强电解质、弱电解质的电离过程。
联想质疑:
1、在石英皿中经过28次蒸馏的水的电导率为:6.3×10-8Ω-1·cm-1。这说明水是否是电解质?强弱如何?
2、写出水的电离的方程式:
H2O H++OH-
或 H2O+H2O H3O++OH-
Kw=c平(H+) c平(OH-)
3、室温下1L水(约55.6mol )H2O中只有1×10-7 mol H2O电离,试求水的电离平衡常数。
一、水的电离
KW= c平(H+) c平(OH-)
1、水是极弱的电解质,水的电离存在电离平衡。
在一定温度下KW是常数,在不同温度下KW数值不同。水的电离是一个吸热过程,KW只与温度有关,温度越高,KW 越大。
25℃时,水的离子积KW=c平(H+) c平(OH-)=1×10-14 mol2 ·L-2。
H2O H++OH-
或 H2O+H2O H3O++OH-
2、KW叫水的离子积常数,简称水的离子积,
⑴表达式为:
⑵影响因素:温度
⑶适用范围:纯水或稀的电解质溶液
观察 思考(课本p74页实验)并记录现象,回答下列问题:
等体积的溶液 电解质溶液 灯泡亮度 导电能力
0.5mol/L HCl
0.5mol/L 氨水
0.5mol/L NaCl
0.5mol/L CH3COOH
强
弱
强
弱
亮
暗
亮
暗
2.浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?
1、浓度相同的四组溶液的灯泡亮度不同的原因是什么?
溶液的导电能力强弱不同
溶液中自由移动的阴阳离子浓度大小不同
灯泡的亮度
3.浓度相同的不同电解质的水溶液的自由离子浓度不同,其原因是什么?
←溶液的导电能力
←溶液中自由移动的阴阳离子浓度
←电解质的电离程度大小
←相同浓度的电解质的强弱
电解质的电离程度大小不同
总结:
盐酸:阴、阳离子
醋酸:分子和阴阳离子
氯化氢、醋酸等电解质在溶于水以后,都会电离,但是电解质的电离程度大小不同,氯化氢全部电离,醋酸部分电离。
4.氯化氢、醋酸等电解质在溶于水的过程中发生了哪些变化?它们最终以何种形态存在?
⑵弱电解质:在稀的水溶液里部分电离的电解质。包括弱酸、弱碱、水。
强电解质在水溶液中存在形态: 阴、阳离子(水合离子)
弱电解质在水溶液中存在形态:分子和阴阳离子(水合分子和水合离子)
⑴强电解质:在稀的水溶液里能完全电离的电解质。包括强酸、强碱、大部分盐。
1、电解质在水溶液中的存在形态
二、电解质在水溶液中的存在形态
总结:强弱电解质溶液的组成成分
电解质溶液
水
电解质
强电解质
弱电解质
全部电离
部分电离
弱电解质分子
电解质阴、阳离子
电解质阴、阳离子
水分子、少量H+、OH-
强电解质溶液
弱电解质溶液
练习
1、判断正误:
⑴强电解质溶液一定比弱电解质溶液的导电能力强。
⑵BaSO4的水溶液导电能力很弱,所以硫酸钡是弱电解质。
⑶相同条件下,浓度均为1mol/L 的HCl和CH3COOH溶液,HCl溶液的导电能力强,所以HCl是强电解质,CH3COOH是弱电解质。
×
×
×
纯水中:c(H+)=c(OH-)
2. 影响水的电离平衡的因素
H2O H+ + OH-
△H>0
升高温度,促进水的电离,Kw增大
水的电离是个吸热过程,升高温度:
平衡向 移动, [H+] ,[OH-] , Kw 。
右
增大
增大
增大
注意:水的离子积Kw只随温度的改变而改变
Kw适用于一定温度下任何稀的水溶液
(1)温度影响
H2O H++OH- ΔH>0
条件变化 移动方向 c平(H+) c平(OH-) KW 对平衡的影响
加酸
加碱
加活泼金属,如Na
向左移动
增大
减小
不变
抑制
向左移动
减小
增大
不变
抑制
向右移动
减小
增大
不变
促进
(2)加入酸或碱等物质
加入酸或碱,抑制水的电离,Kw不变。
思考:
1、酸溶液中的OH-、 H+是否都是由水电离出的?
2、碱溶液中的OH-、 H+是否都是由水电离出的?
3、盐溶液中的OH-、 H+是否都是由水电离出的?
c平(H+)=c酸(H+)+ c水(H+)
c平(OH-)=c水(OH-)
c平(OH-)=c碱(OH-)+ c水(OH-)
c平(H+)=c水(H+)
主要是酸电离的
主要是碱电离的
酸式盐和酸类似,正盐溶液中OH-、 H+都是由水电离出的。
都符合:KW= c平(H+) c平(OH-)
⑴水的离子积不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液在任何水溶液中,均存在水的电离平衡,Kw=c平(H+)·c平(OH-)
均成立。
结论:
⑵Kw只随温度变化,升高温度,Kw增大。
25℃时,Kw=1×10-14(mol/L)2。
⑶酸溶液和碱溶液中都同时存在H+和OH-,且:
水电离出的 c水(H+)=c水(OH-)。
酸溶液中:c平(H+)=c酸(H+)+c水(H+) c平(OH-)=c水(OH-)
碱溶液中: c平(OH-)=c碱(OH-)+c水(OH-) c平(H+)=c水(H+)
1、下列五种溶液中c平(H+)由大到小的排列顺序 。
A.0. 1 mol·L-1的盐酸;
B.0.1 mol·L-1的硫酸;
C. 0.1 mol·L-1的NaOH;
D. 0.1 mol·L-1的CH3COOH;
E. 0.1 mol·L-1的NaCl;
B A D E C
0.1mol/L
0.2mol/L
1×10-13mol/L
小于0.1mol/L
1×10-7mol/L
练习
2、判断正误:
⑴任何水溶液中都存在水的电离平衡。
⑵任何水溶液中(不论酸、碱或中性),都存在Kw=10-14 mol2 L-2
⑶25℃ 时,某溶液中c平(H+)= 10-7mol L-1,则该溶液一定是纯水。
⑷某温度下,纯水中H+浓度为1×10-6mol L-1,则溶液显酸性
√
×
×
×
练习
3. 0.1mol/L的盐酸溶液中, c平(H+)=? 、 c平(OH-)=? 由水电离出的c水(OH-)=?、 c水(H+)=?
练(OH-)=KW÷c平(H+)=1×10-14mol L-1÷0.1mol L-1=1×10-13mol L-1
c平(H+)=0.1mol L-1
KW= c平(H+) c平(OH-),
由水电离出的c水(OH-)=c水(H+)=c平(OH-)=1×10-13mol L-1
c水(H+)=c(OH-)水=c平(H+)=c平(OH-)=1×10-7mol L-1
5. 0.1mol/L的NaCl溶液中,c平(OH-)=?、c平(H+)=?
由水电离出的c水(OH-)=c水(H+)=c平(H+)=1×10-13mol L-1
c平(H+)=KW÷c平(OH-)=1×10-14mol L-1÷0.1mol L-1=1×10-13mol L-1
c平(OH-)=0.1mol L-1
KW= c平(H+) c平(OH-),
4. 0.1mol/L的NaOH溶液中, c平(OH-)=?、c平(H+)=?、由水电离出的c水(OH-)=?、 c水(H+)=?
练习
6、计算:
⑴在25℃ 0.01mol/L盐酸溶液中:
c平(H+) = ,c平(OH-) = ;
c平(H+)水= ,c平(OH-)水= 。
⑵在25℃ 0.01mol/L NaOH溶液中:
c平(H+)= ,c平(OH-)= ;
c平(H+)水= , c平(OH-)水= 。
⑶ 0.1mol/L的NaCl溶液中:
c平(OH-)= ,c平(H+)= 。
0.01mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
10-12mol L-1
0.01mol L-1
10-7mol L-1
10-7mol L-1
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
