3.2.1 弱电解质的电离平衡(共24张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 3.2.1 弱电解质的电离平衡(共24张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 179.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:03:52 | ||
图片预览








文档简介
(共24张PPT)
第三章第3章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第1课时弱电解质的电离平衡
知识体系
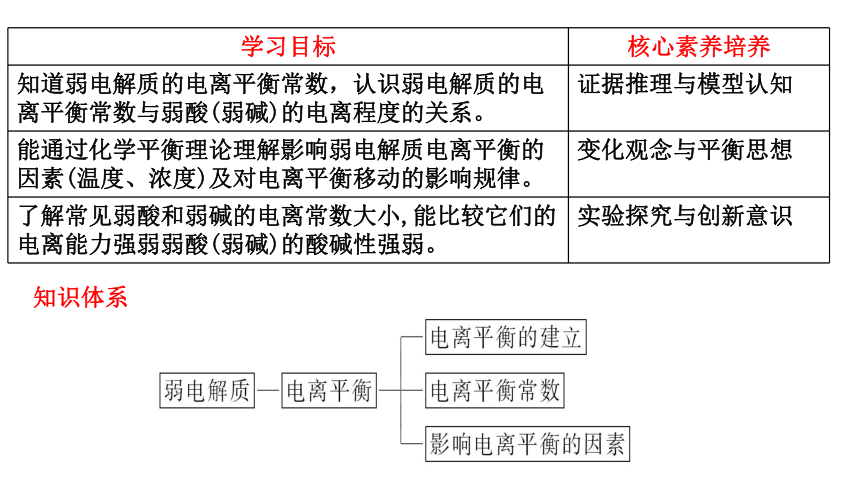
学习目标 核心素养培养
知道弱电解质的电离平衡常数,认识弱电解质的电离平衡常数与弱酸(弱碱)的电离程度的关系。 证据推理与模型认知
能通过化学平衡理论理解影响弱电解质电离平衡的因素(温度、浓度)及对电离平衡移动的影响规律。 变化观念与平衡思想
了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱弱酸(弱碱)的酸碱性强弱。 实验探究与创新意识
1、电解质和非电解质、强电解质和弱电解质
知识回顾
强电解质:在水溶液里完全电离
水溶液中只存在的电解质阴阳离子
强酸、强碱、绝大部分盐:氯化氢、硫酸、硝酸、氢氧化钠、氢氧化钾、氢氧化钡、氯化钠、氯化钙、氯化银、硫酸钡等
水溶液中存在的弱电解质分子和阴、阳离子,主要是弱电解质分子。弱电解质的电离过程是可逆的,存在电离平衡。
弱酸、弱碱、水、少部分盐:醋酸、碳酸、亚硫酸、一水合氨、氢氧化铜、醋酸铅等
弱电解质:在水溶液里部分电离
联想质疑:
以弱酸醋酸的电离为例,思考与讨论:
①电离开始后,V(电离)和V(结合)怎样变化?各离子及分子浓度如何变化
CH3COOH CH3COO - + H+
电离
结合
②当电离达到最大程度时,V(电离)和V(结合)有什么关系 溶液中分子与离子浓度是否变化
③用速率-时间(v-t)图像表示,V(电离)和 V(结合)在电离过程中的变化图像。
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
时间
弱电解质电离平衡状态建立示意图
电离平衡特征
动 电离平衡是一种动态平衡
定 条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子
变 条件改变时,电离平衡发生移动。
等 V电离=V结合≠0
逆 弱电解质的电离是可逆过程
思考: 怎样定量的比较弱电解质的相对强弱? 电离程度相对大小怎样比较?
电离平衡状态:在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,溶液中分子与离子浓度不再变化。电离过程就达到了平衡状态,叫电离平衡。
阅读课本P97(电离常数的含义和应用)
1.弱电解质的电离平衡常数(K)
温度一定时,对于一元弱酸的电离平衡: HA H++A-,
Ka=
c 平(H+) . c平 (A-)
c平 (HA)
对于一元弱碱 MOH M++OH-,
Kb=
c平 (M+) .c平 (OH-)
c 平(MOH)
一、弱电解质的电离平衡
⑴定义式:
⑵电离平衡常数受温度影响,与溶液浓度无关,电离常数表征弱电解质电离能力,根据相同温度下的电离常数的大小,可以判断弱电解质电离能力的相对强弱(酸碱性的相对强弱)
①电离平衡常数表征了弱电解质的电离能力,由数据可知,弱电解质的电离程度一般很小。
③弱酸的电离常数越大,(相同浓度的弱酸)达到电离平衡时电离出的H+越多,酸性越强,反之,酸性越弱。
②电离常数服从化学平衡常数的一般规律,受温度影响,温度一定,弱电解质具有确定的平衡常数。
阅读课本P97-98页,了解室温下HCN、HF、CH3COOH电离常数,判断三种酸的酸性强弱。
总结:
①多元弱酸分步电离,每一步电离都有各自的电离常数,各级电离常数逐级减小且一般相差很大,多元弱酸的酸性主要由第一步电离决定。电离过程分步写电离方程式。
阅读课本P98页,了解多元弱酸H3PO4、H2CO3 电离过程和电离常数,如何表示多元弱酸的电离?如何表示多元弱碱的电离?
总结:
②多元弱碱分步电离,电离过程写电离方程式一步完成。
练习1:写出下列弱酸、弱碱在水溶液中的电离方程式,并写出相应的电离平衡常数的表达式:
① H2CO3
②H2S
③Cu(OH)2
④Fe(OH)3
练习2、写出相应的电离平衡常数的表达式:
①CH3COOH ② NH3 H2O ③HF
练习3、下列关于电离平衡常数Ka说法正确的是( )
A.电离平衡常数Ka越小,表示弱电解质电离能力越强
B.电离平衡常数Ka只与温度有关
C.不同浓度的同一弱电解质,其电离平衡常数Ka不同。
D.多元弱酸各步电离平衡常数相互关系为:Ka1B
①判断弱酸(或弱碱)的相对强弱,相同温度下,电离常数越大,酸性(或碱性)越强。
⑶电离平衡常数的应用:
练习4、在相同温度下,三种弱酸的电离常数(mol·L-1)如下:HF(6.8×10-4)、CH3COOH(1.7×10-5)、HClO(4.7×10-8)。则三种酸的酸性最强的是( )
A.HF B.CH3COOH
C.HClO D.无法确定
A
②判断“强酸制弱酸”的复分解反应能否发生
练习5、25 ℃时,Ka(HCOOH)=1.77×10-4 mol·L-1,Ka(HCN)=4.9×10-10 mol·L-1,故知可以发生反应:
HCOOH+NaCN= + 。
HCN
HCOONa
练习6、已知三个数据:①7.2×10-4mol·L-1②4.6×10-4 mol·L-1③4.9×10-10 mol·L-1分别是三种酸的电离平衡常数。若这些酸可发生反应:NaCN+HNO2 = HCN+NaNO2,NaCN+HF = HCN+NaF,NaNO2+HF = HNO2+NaF,则下列叙述正确的是( )
A.HF的电离平衡常数是① B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是② D.HNO2的电离平衡常数是③
A
③利用电离常数可近似计算出弱酸、弱碱溶液中c平(H+)或c平(OH-)(忽略水的电离)。
阅读课本P100页,了解如何计算CH3COOH溶液中的c平(H+)或c平(OH-)?
阅读课本P98-99页,了解电离平衡的平衡转化率——电离度α。
2、电离度(α)
α=
已电离的弱电解质浓度
弱电解质的初始浓度
×100%
=
已电离的分子数
弱电解质分子总数
×100%
电离度α实际上是一种平衡转化率,是表征弱电解质电离能力的另一参数。
练习7: 25℃时,0.1mol/L CH3COOH溶液中的c平(H+)=0.0013mol/L,CH3COOH溶液的电离度α= ;
0.01mol/L CH3COOH溶液中的电离度α=4.2%;CH3COOH溶液的c平(H+) = ;
1.3%
0.00042 mol/L
电解质 Ka α(%)
HF 3.53×10-4 8.0
CH3COOH 1.75×10-5 1.3
HCN 4.93×10-10 <0.01
NH3·H2O 1.75×10-5 1.3
25℃时,不同浓度CH3COOH的电离度
c (mol/L) 0.1 0.05 0.01 0.001
α(%) 1.3 1.9 4.2 12
1. 分析表中数据,电离常数Ka和电离度α在数值上有怎样的联系?
2. 对比不同浓度下醋酸的电离度,有什么发现?
3. 电离常数Ka和电离度α分别受哪些因素影响?
已知在25℃时,某些弱电解质的电离常数和0.1mol/L溶液的电离度
结合课本第99页表3-2-1内容,思考以下问题:
练习8、已知25 ℃时几种物质的电离度(溶液的浓度为0.1 mol·L-1时所得数据)如下表所示(已知硫酸的第一步电离是完全的):
溶液 ①H2SO4溶液 ②NaHSO4溶液 ③CH3COOH溶液 ④HCl溶液
微粒 HSO4- HSO4- CH3COOH HCl
电离度α 10% 29% 1.33% 100%
(1)25 ℃时,0.1 mol·L-1的上述四种溶液中c平(H+)由大到小的顺序是____________(填序号)。
(2)25 ℃时,c平(H+)相同的上述四种溶液中溶质的物质的量浓度由大到小的顺序是 (填序号)。
(3)25 ℃时,将足量锌粉放入等体积、c平(H+)为0.1 mol·L-1的上述四种溶液中,产生H2的体积(同等压强下)由大到小的顺序是____________(填序号)。
①④②③
③②④①
③②①④
(4)25 ℃时,0.1 mol·L-1的H2SO4溶液中HSO4-的电离度小于0.1 mol·L-1的NaHSO4溶液中HSO4-的电离度的原因是___________________________________________。
H2SO4一级电离产生的H+抑制了其二级电离
溶液 ①H2SO4溶液 ②NaHSO4溶液 ③CH3COOH溶液 ④HCl溶液
微粒 HSO4- HSO4- CH3COOH HCl
电离度α 10% 29% 1.33% 100%
练习9、25℃时醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1的醋酸溶液中c平(H+)。
起始 0.10 mol·L-1 0 0
转化 x x x
平衡 (0.10-x)mol·L-1 x x
设生成的H+ 物质的量浓度为x。
【解析】
CH3COOH H+ + CH3COO -
Ka=
x2
(0.10-x)mol·L-1
≈
x2
0.10 mol·L-1
x=
=1.3×10-3 mol·L-1
练习10、 0.3 mol·L-1 醋酸溶液中 c平(H+)是0.1 mol·L-1醋酸溶液中 c平(H+)的三倍吗?
分析:设0.3 mol·L-1的醋酸溶液的电离度为α1 ,
0.1 mol·L-1的醋酸溶液的电离度为α2 ,则,α1< α2 ,
< 3
———— = ———— = ———
c平(H+)1
c平(H+)2
0.1α2
0.3α1
c1α1
c2α2
c平(H+)1 = c1α1 c平(H+)2 = c2α2
在0.3 mol·L-1溶液中 c平(H+)1 = 0.3α1 mol·L-1;
在0.1 mol·L-1溶液中 c平(H+)2 = 0.1α2 mol·L-1
第三章第3章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第1课时弱电解质的电离平衡
知识体系
学习目标 核心素养培养
知道弱电解质的电离平衡常数,认识弱电解质的电离平衡常数与弱酸(弱碱)的电离程度的关系。 证据推理与模型认知
能通过化学平衡理论理解影响弱电解质电离平衡的因素(温度、浓度)及对电离平衡移动的影响规律。 变化观念与平衡思想
了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱弱酸(弱碱)的酸碱性强弱。 实验探究与创新意识
1、电解质和非电解质、强电解质和弱电解质
知识回顾
强电解质:在水溶液里完全电离
水溶液中只存在的电解质阴阳离子
强酸、强碱、绝大部分盐:氯化氢、硫酸、硝酸、氢氧化钠、氢氧化钾、氢氧化钡、氯化钠、氯化钙、氯化银、硫酸钡等
水溶液中存在的弱电解质分子和阴、阳离子,主要是弱电解质分子。弱电解质的电离过程是可逆的,存在电离平衡。
弱酸、弱碱、水、少部分盐:醋酸、碳酸、亚硫酸、一水合氨、氢氧化铜、醋酸铅等
弱电解质:在水溶液里部分电离
联想质疑:
以弱酸醋酸的电离为例,思考与讨论:
①电离开始后,V(电离)和V(结合)怎样变化?各离子及分子浓度如何变化
CH3COOH CH3COO - + H+
电离
结合
②当电离达到最大程度时,V(电离)和V(结合)有什么关系 溶液中分子与离子浓度是否变化
③用速率-时间(v-t)图像表示,V(电离)和 V(结合)在电离过程中的变化图像。
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
时间
弱电解质电离平衡状态建立示意图
电离平衡特征
动 电离平衡是一种动态平衡
定 条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子
变 条件改变时,电离平衡发生移动。
等 V电离=V结合≠0
逆 弱电解质的电离是可逆过程
思考: 怎样定量的比较弱电解质的相对强弱? 电离程度相对大小怎样比较?
电离平衡状态:在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,溶液中分子与离子浓度不再变化。电离过程就达到了平衡状态,叫电离平衡。
阅读课本P97(电离常数的含义和应用)
1.弱电解质的电离平衡常数(K)
温度一定时,对于一元弱酸的电离平衡: HA H++A-,
Ka=
c 平(H+) . c平 (A-)
c平 (HA)
对于一元弱碱 MOH M++OH-,
Kb=
c平 (M+) .c平 (OH-)
c 平(MOH)
一、弱电解质的电离平衡
⑴定义式:
⑵电离平衡常数受温度影响,与溶液浓度无关,电离常数表征弱电解质电离能力,根据相同温度下的电离常数的大小,可以判断弱电解质电离能力的相对强弱(酸碱性的相对强弱)
①电离平衡常数表征了弱电解质的电离能力,由数据可知,弱电解质的电离程度一般很小。
③弱酸的电离常数越大,(相同浓度的弱酸)达到电离平衡时电离出的H+越多,酸性越强,反之,酸性越弱。
②电离常数服从化学平衡常数的一般规律,受温度影响,温度一定,弱电解质具有确定的平衡常数。
阅读课本P97-98页,了解室温下HCN、HF、CH3COOH电离常数,判断三种酸的酸性强弱。
总结:
①多元弱酸分步电离,每一步电离都有各自的电离常数,各级电离常数逐级减小且一般相差很大,多元弱酸的酸性主要由第一步电离决定。电离过程分步写电离方程式。
阅读课本P98页,了解多元弱酸H3PO4、H2CO3 电离过程和电离常数,如何表示多元弱酸的电离?如何表示多元弱碱的电离?
总结:
②多元弱碱分步电离,电离过程写电离方程式一步完成。
练习1:写出下列弱酸、弱碱在水溶液中的电离方程式,并写出相应的电离平衡常数的表达式:
① H2CO3
②H2S
③Cu(OH)2
④Fe(OH)3
练习2、写出相应的电离平衡常数的表达式:
①CH3COOH ② NH3 H2O ③HF
练习3、下列关于电离平衡常数Ka说法正确的是( )
A.电离平衡常数Ka越小,表示弱电解质电离能力越强
B.电离平衡常数Ka只与温度有关
C.不同浓度的同一弱电解质,其电离平衡常数Ka不同。
D.多元弱酸各步电离平衡常数相互关系为:Ka1
①判断弱酸(或弱碱)的相对强弱,相同温度下,电离常数越大,酸性(或碱性)越强。
⑶电离平衡常数的应用:
练习4、在相同温度下,三种弱酸的电离常数(mol·L-1)如下:HF(6.8×10-4)、CH3COOH(1.7×10-5)、HClO(4.7×10-8)。则三种酸的酸性最强的是( )
A.HF B.CH3COOH
C.HClO D.无法确定
A
②判断“强酸制弱酸”的复分解反应能否发生
练习5、25 ℃时,Ka(HCOOH)=1.77×10-4 mol·L-1,Ka(HCN)=4.9×10-10 mol·L-1,故知可以发生反应:
HCOOH+NaCN= + 。
HCN
HCOONa
练习6、已知三个数据:①7.2×10-4mol·L-1②4.6×10-4 mol·L-1③4.9×10-10 mol·L-1分别是三种酸的电离平衡常数。若这些酸可发生反应:NaCN+HNO2 = HCN+NaNO2,NaCN+HF = HCN+NaF,NaNO2+HF = HNO2+NaF,则下列叙述正确的是( )
A.HF的电离平衡常数是① B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是② D.HNO2的电离平衡常数是③
A
③利用电离常数可近似计算出弱酸、弱碱溶液中c平(H+)或c平(OH-)(忽略水的电离)。
阅读课本P100页,了解如何计算CH3COOH溶液中的c平(H+)或c平(OH-)?
阅读课本P98-99页,了解电离平衡的平衡转化率——电离度α。
2、电离度(α)
α=
已电离的弱电解质浓度
弱电解质的初始浓度
×100%
=
已电离的分子数
弱电解质分子总数
×100%
电离度α实际上是一种平衡转化率,是表征弱电解质电离能力的另一参数。
练习7: 25℃时,0.1mol/L CH3COOH溶液中的c平(H+)=0.0013mol/L,CH3COOH溶液的电离度α= ;
0.01mol/L CH3COOH溶液中的电离度α=4.2%;CH3COOH溶液的c平(H+) = ;
1.3%
0.00042 mol/L
电解质 Ka α(%)
HF 3.53×10-4 8.0
CH3COOH 1.75×10-5 1.3
HCN 4.93×10-10 <0.01
NH3·H2O 1.75×10-5 1.3
25℃时,不同浓度CH3COOH的电离度
c (mol/L) 0.1 0.05 0.01 0.001
α(%) 1.3 1.9 4.2 12
1. 分析表中数据,电离常数Ka和电离度α在数值上有怎样的联系?
2. 对比不同浓度下醋酸的电离度,有什么发现?
3. 电离常数Ka和电离度α分别受哪些因素影响?
已知在25℃时,某些弱电解质的电离常数和0.1mol/L溶液的电离度
结合课本第99页表3-2-1内容,思考以下问题:
练习8、已知25 ℃时几种物质的电离度(溶液的浓度为0.1 mol·L-1时所得数据)如下表所示(已知硫酸的第一步电离是完全的):
溶液 ①H2SO4溶液 ②NaHSO4溶液 ③CH3COOH溶液 ④HCl溶液
微粒 HSO4- HSO4- CH3COOH HCl
电离度α 10% 29% 1.33% 100%
(1)25 ℃时,0.1 mol·L-1的上述四种溶液中c平(H+)由大到小的顺序是____________(填序号)。
(2)25 ℃时,c平(H+)相同的上述四种溶液中溶质的物质的量浓度由大到小的顺序是 (填序号)。
(3)25 ℃时,将足量锌粉放入等体积、c平(H+)为0.1 mol·L-1的上述四种溶液中,产生H2的体积(同等压强下)由大到小的顺序是____________(填序号)。
①④②③
③②④①
③②①④
(4)25 ℃时,0.1 mol·L-1的H2SO4溶液中HSO4-的电离度小于0.1 mol·L-1的NaHSO4溶液中HSO4-的电离度的原因是___________________________________________。
H2SO4一级电离产生的H+抑制了其二级电离
溶液 ①H2SO4溶液 ②NaHSO4溶液 ③CH3COOH溶液 ④HCl溶液
微粒 HSO4- HSO4- CH3COOH HCl
电离度α 10% 29% 1.33% 100%
练习9、25℃时醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1的醋酸溶液中c平(H+)。
起始 0.10 mol·L-1 0 0
转化 x x x
平衡 (0.10-x)mol·L-1 x x
设生成的H+ 物质的量浓度为x。
【解析】
CH3COOH H+ + CH3COO -
Ka=
x2
(0.10-x)mol·L-1
≈
x2
0.10 mol·L-1
x=
=1.3×10-3 mol·L-1
练习10、 0.3 mol·L-1 醋酸溶液中 c平(H+)是0.1 mol·L-1醋酸溶液中 c平(H+)的三倍吗?
分析:设0.3 mol·L-1的醋酸溶液的电离度为α1 ,
0.1 mol·L-1的醋酸溶液的电离度为α2 ,则,α1< α2 ,
< 3
———— = ———— = ———
c平(H+)1
c平(H+)2
0.1α2
0.3α1
c1α1
c2α2
c平(H+)1 = c1α1 c平(H+)2 = c2α2
在0.3 mol·L-1溶液中 c平(H+)1 = 0.3α1 mol·L-1;
在0.1 mol·L-1溶液中 c平(H+)2 = 0.1α2 mol·L-1
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
