3.2.2 影响电离平衡的因素-2023-2024学年高二化学鲁科版选择性必修第一册课件(共24张PPT)
文档属性
| 名称 | 3.2.2 影响电离平衡的因素-2023-2024学年高二化学鲁科版选择性必修第一册课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 188.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:04:20 | ||
图片预览




文档简介
(共18张PPT)
第三章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第2课时 影响电离平衡的因素
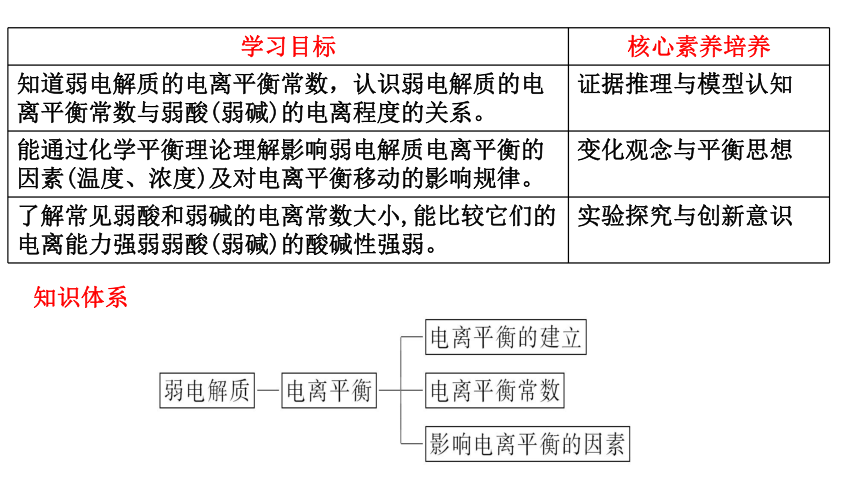
知识体系
学习目标 核心素养培养
知道弱电解质的电离平衡常数,认识弱电解质的电离平衡常数与弱酸(弱碱)的电离程度的关系。 证据推理与模型认知
能通过化学平衡理论理解影响弱电解质电离平衡的因素(温度、浓度)及对电离平衡移动的影响规律。 变化观念与平衡思想
了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱弱酸(弱碱)的酸碱性强弱。 实验探究与创新意识
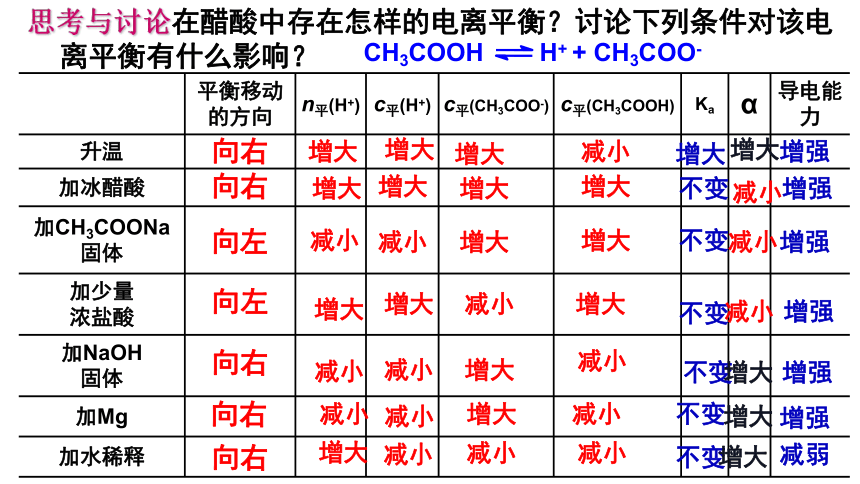
CH3COOH H+ + CH3COO-
现有0.01mol/L醋酸,如分别采取如下措施:
①升温 ②加冰醋酸 ③加CH3COONa固体 ④加少量浓盐酸 ⑤加NaOH固体 ⑥加金属镁 ⑦加水稀释。对电离平衡有何影响?
内因;电解质本身的性质;
外因;温度、浓度。
阅读课本第99页《观察与思考》不同温度下的一水合氨的电离常数了解温度对弱电解质电离的影响。
了解哪些因素会影响弱电解质的电离程度?
平衡移动的方向 n平(H+) c平(H+) c平(CH3COO-) c平(CH3COOH) Ka α 导电能力
升温
加冰醋酸
加CH3COONa 固体
加少量 浓盐酸
加NaOH 固体
加Mg
加水稀释
CH3COOH H+ + CH3COO-
思考与讨论在醋酸中存在怎样的电离平衡?讨论下列条件对该电离平衡有什么影响?
增大
向右
增大
向右
向左
向左
向右
向右
向右
增大
减小
增大
减小
减小
增大
增大
减小
增大
减小
减小
减小
增大
增大
增大
减小
增大
增大
减小
减小
增大
增大
增大
减小
减小
减小
增大
不变
不变
不变
不变
不变
不变
增大
减小
减小
减小
增大
增大
增大
增强
增强
增强
增强
增强
增强
减弱
⑴温度:升高温度能促进弱电解质的电离(电离是吸热的,升温Ka、Kb增大)
①加水稀释能促进弱电解质的电离。
②加入含有相应弱酸阴离子的盐(固体)抑制弱酸的电离。
③加入含有相应弱碱阳离子的盐(固体)抑制弱碱的电离。
④加入强酸抑制弱酸的电离。
⑤加入强碱抑制弱碱的电离。
内部因素:电解质本身的性质
外部因素(外部条件):
3.影响电离平衡的因素
⑵浓度
越稀越电离
同离子效应
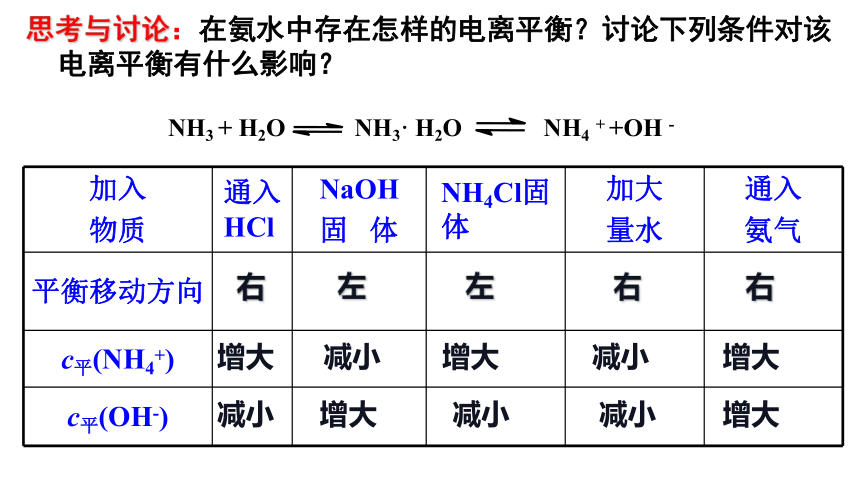
加入 物质 通入HCl NaOH 固 体 NH4Cl固 体 加大 量水 通入
氨气
平衡移动方向
c平(NH4+)
c平(OH-)
NH3 + H2O NH3· H2O NH4 + +OH -
思考与讨论:在氨水中存在怎样的电离平衡?讨论下列条件对该电离平衡有什么影响?
右
左
左
右
右
增大
减小
增大
减小
增大
减小
增大
减小
增大
减小
练习1、相同温度下,根据三种酸的电离平衡常数,下列判断正确的是( )
酸 HX HY HZ
电离平衡常数Ka 9×10-7 9×10-6 1×10-2
A.三种酸的酸性强弱关系:HX>HY>HZ
B.反应HZ+Y- = HY+Z-能够发生
C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1 mol·L-1 HX溶液的电离平衡常数大于 0.1 mol·L-1HX溶液的电离平衡常数
B
C
练习2、现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L 后,下列变化中正确的是( )
①电离程度增大 ②c平(NH3·H2O)增大
③NH4+数目增多 ④c平(OH-)增大
⑤导电性增强 ⑥
⑦
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
⑴相同物质的量浓度、相同体积的一元强酸与一元弱酸的比较
c平(H+) pH 中和碱的能力 与足量活泼金属反应产生H2的量 开始与金属反应的速率 由H2O电离出的c平(H+)
一元强酸
一元弱酸
⑵相同pH、相同体积的一元强酸与一元弱酸的比较
c平(H+) c平(酸) 中和碱的能力 与足量活泼金属反应产生H2的量 开始与金属反应的速率 由H2O电离出的c平(H+)
一元强酸
一元弱酸
大
小
小
大
相同
相同
大
小
小
大
相同
小
大
小
大
少
多
相同
相同
4.强、弱电解质的对比(以强酸、弱酸为例)
练习3、在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
⑴“O”点导电能力为0的理由是 。
⑵A、B、C三点溶液c(H+)由小到大的
顺序为 。
⑶若使C点溶液中c(CH3COO-)增大的同时
溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
⑷经实验测得C点处:c(CH3COOH)=0.1 mol·L-1,c(CH3COO-) = 0.01 mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
CH3COOH是共价化合物,无水不电离,也就无自由移动的离子,所以不导电。
C活泼金属Na
加碱NaOH
醋酸盐CH3COONa
1×10-3
练习4、下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中 c平(H+) 相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.pH=3 的两溶液稀释 100 倍后,pH都为 5
D.相同浓度时醋酸导电能力强
B
练习5、在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L 的醋酸溶液相比较,下列数值前者大于后者的是( )
A . 中和时所需NaOH的量 B. 电离度
C. H+的物质的量 D. CH3COOH的物质的量
BC
练习6、足量金属Mg和一定量的盐酸反应,为减慢反应速率,但又不影响产生H2的总量,可向盐酸中加入适量( )
A.NaOH固体 B.NaCl固体
C.水 D.CH3COONa固体
CD
练习7、已知25℃时,下列酸的电离常数如下,则相同浓度的下述溶液中 c平(H+)浓度最小的是( )
(KHF=7.2×10-4 KHCN=4.9×10-10 KHNO2=4.6×10-4 KCH3COOH=1.8×10-5)
A.HF B.HCN C.HNO2 D.CH3COOH
B
a+n
10n
弱酸
练习8、强酸 pH=a,加水稀释10n倍,则 pH?
弱酸 pH=a,加水稀释10n倍,则 pH?
弱碱 pH=b,加水稀释10n倍,则 pH?
pHpH>b-n
强酸、弱酸加水后的pH变化图像。
pH=a+n
强酸
7
1
pH
V/mL
a
试作出强碱、弱碱加水后的pH变化图像。
b-n
10n
弱碱
强碱
7
1
pH
V/mL
b
练习9、pH=2的A、B、C三种酸溶液各1mL,分别加水稀释至1000mL,其pH与溶液(V)的变化关系如下图所示,下例说法错误的是( )
A. pH=2时,A、B、C都是稀溶液
B . 稀释前的浓度大小为c(C)>c(B)>c(A)
C. 稀释后,A溶液中c(H+)最小
D. A是强酸,B和C是弱酸
A
pH
V
1000mL
4
3
1
0
5
2
A
B
C
练习10、通过那些事实(或设计哪些实验)可以证明CH3COOH是弱电解质?
一:取同浓度的HCl和CH3COOH,进行溶液导电性实验。
(观察亮度、导电能力、离子浓度)
二:测定0.1mol/L CH3COOH 的pH值>1(离子浓度、电离是否完全)
三:相同浓度的HCl和CH3COOH 和相同大小颗粒的锌粒比较反应速率。CH3COOH的反应速率较慢。
六:测定等pH等体积的HCl和CH3COOH溶液中和碱的量,CH3COOH 耗碱量大。
五:取相同pH的HCl和CH3COOH,稀释100倍,pH值变化小的是CH3COOH
四:相同pH值相同体积的HCl和CH3COOH,和足量的锌粒反应,CH3COOH在反应过程中速率较快且最终产生的氢气多。
第三章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第2课时 影响电离平衡的因素
知识体系
学习目标 核心素养培养
知道弱电解质的电离平衡常数,认识弱电解质的电离平衡常数与弱酸(弱碱)的电离程度的关系。 证据推理与模型认知
能通过化学平衡理论理解影响弱电解质电离平衡的因素(温度、浓度)及对电离平衡移动的影响规律。 变化观念与平衡思想
了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱弱酸(弱碱)的酸碱性强弱。 实验探究与创新意识
CH3COOH H+ + CH3COO-
现有0.01mol/L醋酸,如分别采取如下措施:
①升温 ②加冰醋酸 ③加CH3COONa固体 ④加少量浓盐酸 ⑤加NaOH固体 ⑥加金属镁 ⑦加水稀释。对电离平衡有何影响?
内因;电解质本身的性质;
外因;温度、浓度。
阅读课本第99页《观察与思考》不同温度下的一水合氨的电离常数了解温度对弱电解质电离的影响。
了解哪些因素会影响弱电解质的电离程度?
平衡移动的方向 n平(H+) c平(H+) c平(CH3COO-) c平(CH3COOH) Ka α 导电能力
升温
加冰醋酸
加CH3COONa 固体
加少量 浓盐酸
加NaOH 固体
加Mg
加水稀释
CH3COOH H+ + CH3COO-
思考与讨论在醋酸中存在怎样的电离平衡?讨论下列条件对该电离平衡有什么影响?
增大
向右
增大
向右
向左
向左
向右
向右
向右
增大
减小
增大
减小
减小
增大
增大
减小
增大
减小
减小
减小
增大
增大
增大
减小
增大
增大
减小
减小
增大
增大
增大
减小
减小
减小
增大
不变
不变
不变
不变
不变
不变
增大
减小
减小
减小
增大
增大
增大
增强
增强
增强
增强
增强
增强
减弱
⑴温度:升高温度能促进弱电解质的电离(电离是吸热的,升温Ka、Kb增大)
①加水稀释能促进弱电解质的电离。
②加入含有相应弱酸阴离子的盐(固体)抑制弱酸的电离。
③加入含有相应弱碱阳离子的盐(固体)抑制弱碱的电离。
④加入强酸抑制弱酸的电离。
⑤加入强碱抑制弱碱的电离。
内部因素:电解质本身的性质
外部因素(外部条件):
3.影响电离平衡的因素
⑵浓度
越稀越电离
同离子效应
加入 物质 通入HCl NaOH 固 体 NH4Cl固 体 加大 量水 通入
氨气
平衡移动方向
c平(NH4+)
c平(OH-)
NH3 + H2O NH3· H2O NH4 + +OH -
思考与讨论:在氨水中存在怎样的电离平衡?讨论下列条件对该电离平衡有什么影响?
右
左
左
右
右
增大
减小
增大
减小
增大
减小
增大
减小
增大
减小
练习1、相同温度下,根据三种酸的电离平衡常数,下列判断正确的是( )
酸 HX HY HZ
电离平衡常数Ka 9×10-7 9×10-6 1×10-2
A.三种酸的酸性强弱关系:HX>HY>HZ
B.反应HZ+Y- = HY+Z-能够发生
C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1 mol·L-1 HX溶液的电离平衡常数大于 0.1 mol·L-1HX溶液的电离平衡常数
B
C
练习2、现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L 后,下列变化中正确的是( )
①电离程度增大 ②c平(NH3·H2O)增大
③NH4+数目增多 ④c平(OH-)增大
⑤导电性增强 ⑥
⑦
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
⑴相同物质的量浓度、相同体积的一元强酸与一元弱酸的比较
c平(H+) pH 中和碱的能力 与足量活泼金属反应产生H2的量 开始与金属反应的速率 由H2O电离出的c平(H+)
一元强酸
一元弱酸
⑵相同pH、相同体积的一元强酸与一元弱酸的比较
c平(H+) c平(酸) 中和碱的能力 与足量活泼金属反应产生H2的量 开始与金属反应的速率 由H2O电离出的c平(H+)
一元强酸
一元弱酸
大
小
小
大
相同
相同
大
小
小
大
相同
小
大
小
大
少
多
相同
相同
4.强、弱电解质的对比(以强酸、弱酸为例)
练习3、在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
⑴“O”点导电能力为0的理由是 。
⑵A、B、C三点溶液c(H+)由小到大的
顺序为 。
⑶若使C点溶液中c(CH3COO-)增大的同时
溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
⑷经实验测得C点处:c(CH3COOH)=0.1 mol·L-1,c(CH3COO-) = 0.01 mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
CH3COOH是共价化合物,无水不电离,也就无自由移动的离子,所以不导电。
C
加碱NaOH
醋酸盐CH3COONa
1×10-3
练习4、下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中 c平(H+) 相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.pH=3 的两溶液稀释 100 倍后,pH都为 5
D.相同浓度时醋酸导电能力强
B
练习5、在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L 的醋酸溶液相比较,下列数值前者大于后者的是( )
A . 中和时所需NaOH的量 B. 电离度
C. H+的物质的量 D. CH3COOH的物质的量
BC
练习6、足量金属Mg和一定量的盐酸反应,为减慢反应速率,但又不影响产生H2的总量,可向盐酸中加入适量( )
A.NaOH固体 B.NaCl固体
C.水 D.CH3COONa固体
CD
练习7、已知25℃时,下列酸的电离常数如下,则相同浓度的下述溶液中 c平(H+)浓度最小的是( )
(KHF=7.2×10-4 KHCN=4.9×10-10 KHNO2=4.6×10-4 KCH3COOH=1.8×10-5)
A.HF B.HCN C.HNO2 D.CH3COOH
B
a+n
10n
弱酸
练习8、强酸 pH=a,加水稀释10n倍,则 pH?
弱酸 pH=a,加水稀释10n倍,则 pH?
弱碱 pH=b,加水稀释10n倍,则 pH?
pH
强酸、弱酸加水后的pH变化图像。
pH=a+n
强酸
7
1
pH
V/mL
a
试作出强碱、弱碱加水后的pH变化图像。
b-n
10n
弱碱
强碱
7
1
pH
V/mL
b
练习9、pH=2的A、B、C三种酸溶液各1mL,分别加水稀释至1000mL,其pH与溶液(V)的变化关系如下图所示,下例说法错误的是( )
A. pH=2时,A、B、C都是稀溶液
B . 稀释前的浓度大小为c(C)>c(B)>c(A)
C. 稀释后,A溶液中c(H+)最小
D. A是强酸,B和C是弱酸
A
pH
V
1000mL
4
3
1
0
5
2
A
B
C
练习10、通过那些事实(或设计哪些实验)可以证明CH3COOH是弱电解质?
一:取同浓度的HCl和CH3COOH,进行溶液导电性实验。
(观察亮度、导电能力、离子浓度)
二:测定0.1mol/L CH3COOH 的pH值>1(离子浓度、电离是否完全)
三:相同浓度的HCl和CH3COOH 和相同大小颗粒的锌粒比较反应速率。CH3COOH的反应速率较慢。
六:测定等pH等体积的HCl和CH3COOH溶液中和碱的量,CH3COOH 耗碱量大。
五:取相同pH的HCl和CH3COOH,稀释100倍,pH值变化小的是CH3COOH
四:相同pH值相同体积的HCl和CH3COOH,和足量的锌粒反应,CH3COOH在反应过程中速率较快且最终产生的氢气多。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
