3.2.3 盐类水解(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 3.2.3 盐类水解(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 373.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:05:00 | ||
图片预览


文档简介
(共25张PPT)
第三章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第3课时 盐类水解
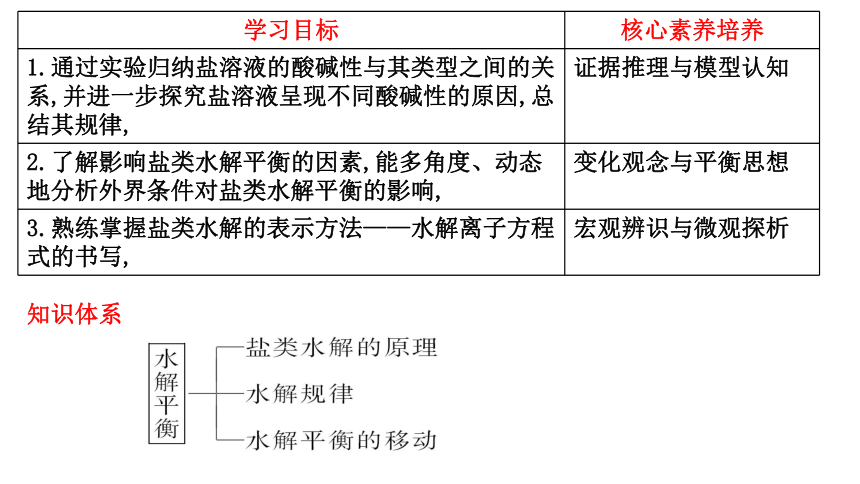
知识体系
学习目标 核心素养培养
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,并进一步探究盐溶液呈现不同酸碱性的原因,总结其规律, 证据推理与模型认知
2.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响, 变化观念与平衡思想
3.熟练掌握盐类水解的表示方法——水解离子方程式的书写, 宏观辨识与微观探析
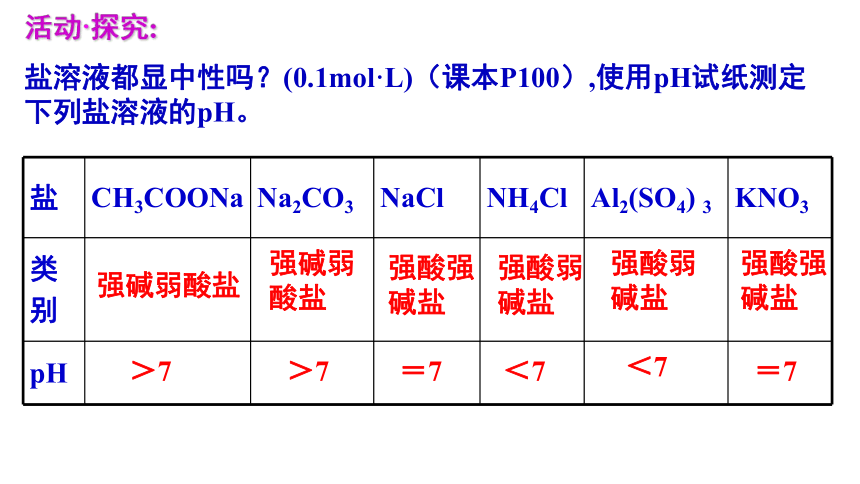
盐溶液都显中性吗?(0.1mol·L)(课本P100),使用pH试纸测定下列盐溶液的pH。
盐 CH3COONa Na2CO3 NaCl NH4Cl Al2(SO4) 3 KNO3
类 别
pH
活动·探究:
强碱弱酸盐
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
强酸弱碱盐
强酸强碱盐
>7
>7
=7
<7
<7
=7
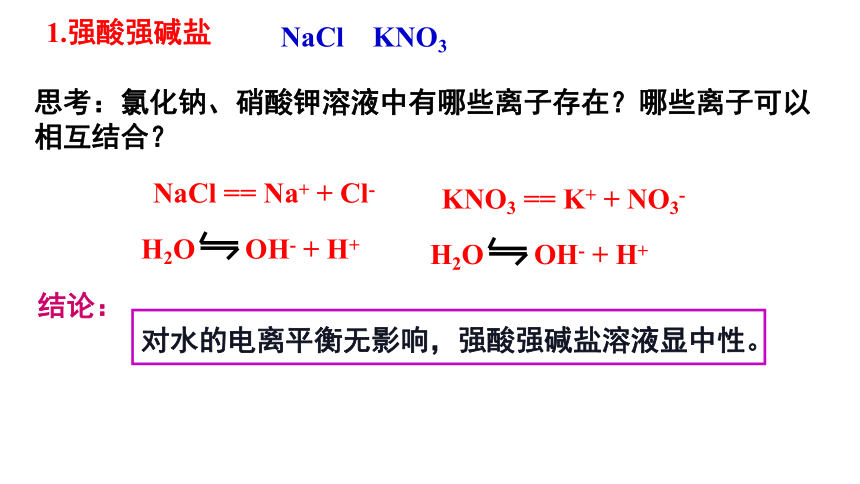
NaCl KNO3
思考:氯化钠、硝酸钾溶液中有哪些离子存在?哪些离子可以相互结合?
对水的电离平衡无影响,强酸强碱盐溶液显中性。
NaCl == Na+ + Cl-
H2O OH- + H+
1.强酸强碱盐
KNO3 == K+ + NO3-
H2O OH- + H+
结论:
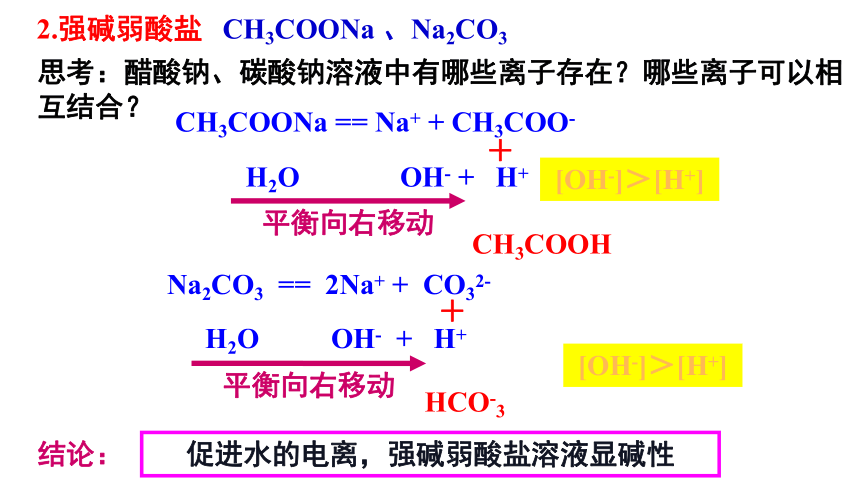
思考:醋酸钠、碳酸钠溶液中有哪些离子存在?哪些离子可以相互结合?
CH3COONa 、Na2CO3
促进水的电离,强碱弱酸盐溶液显碱性
2.强碱弱酸盐
Na2CO3 == 2Na+ + CO32-
CH3COONa == Na+ + CH3COO-
H2O OH- + H+
+
CH3COOH
平衡向右移动
H2O OH- + H+
+
HCO-3
平衡向右移动
结论:
[OH-]>[H+]
[OH-]>[H+]
+
NH3·H2O
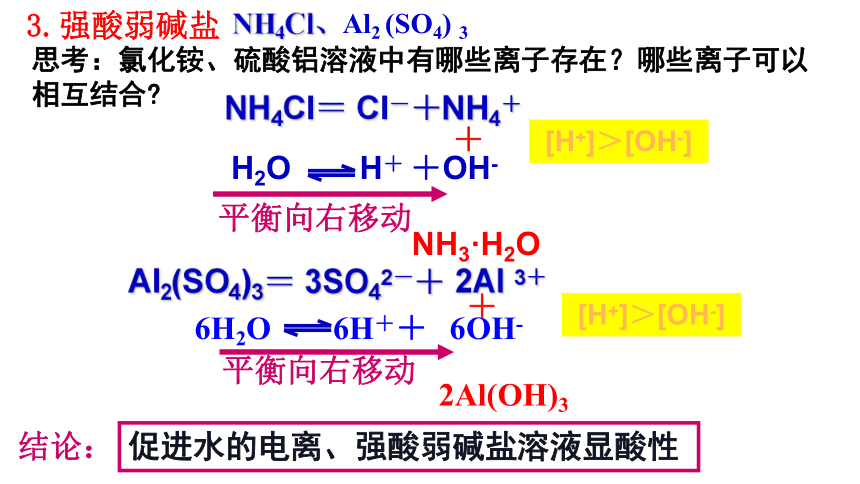
NH4Cl= Cl-+NH4+
H2O H+ +OH-
NH4Cl、Al2 (SO4) 3
促进水的电离、强酸弱碱盐溶液显酸性
思考:氯化铵、硫酸铝溶液中有哪些离子存在?哪些离子可以相互结合
3.强酸弱碱盐
Al2(SO4)3= 3SO42-+ 2Al 3+
6H2O 6H++ 6OH-
2Al(OH)3
结论:
[H+]>[OH-]
平衡向右移动
+
平衡向右移动
[H+]>[OH-]
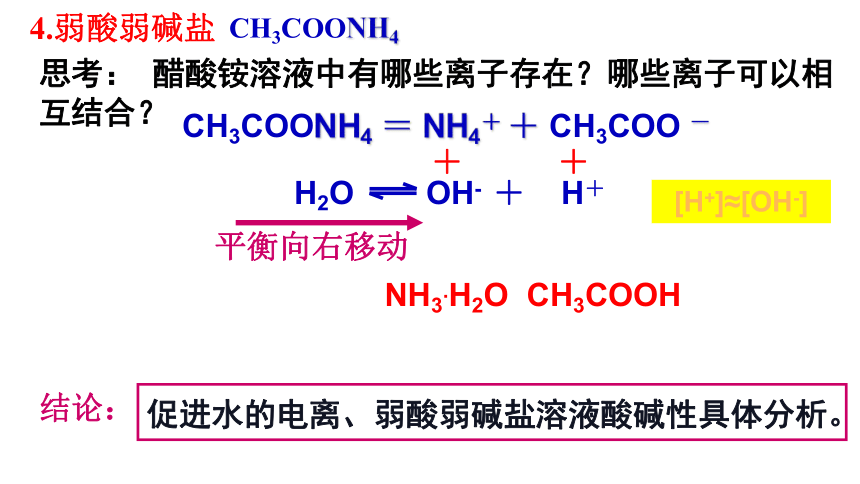
CH3COONH4
促进水的电离、弱酸弱碱盐溶液酸碱性具体分析。
思考: 醋酸铵溶液中有哪些离子存在?哪些离子可以相互结合?
4.弱酸弱碱盐
CH3COONH4 = NH4+ + CH3COO -
H2O OH- + H+
+
CH3COOH
+
NH3.H2O
结论:
平衡向右移动
[H+]≈[OH-]
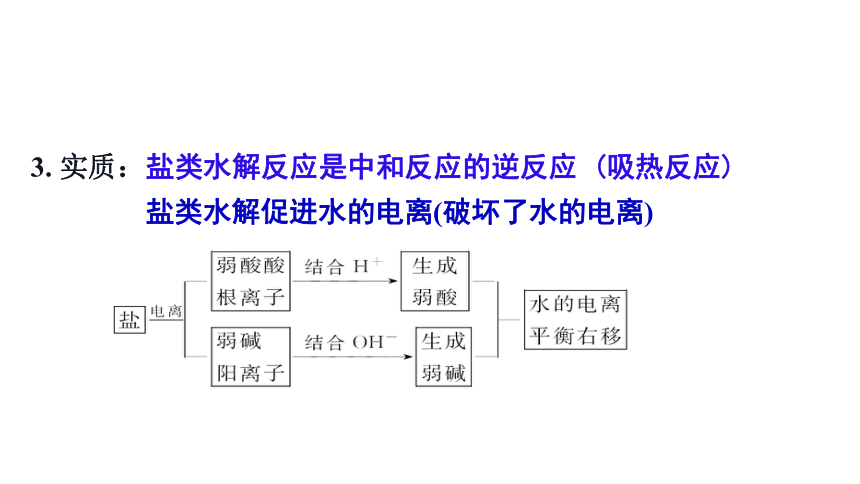
1. 定义:在溶液中由盐电离出来的弱酸根离子或弱碱阳离子与水所电离出来的H+或OH-结合生成弱电解质的过程。
2. 条件:①盐必须溶于水
②盐必须有“弱”离子(弱酸根离子或弱碱阳离子)
二、盐类的水解
3. 实质:盐类水解反应是中和反应的逆反应 (吸热反应)
盐类水解促进水的电离(破坏了水的电离)
把NH4Cl加入H2O中的变化:
+
NH3·H2O
NH4Cl = Cl- + NH4+
[H+]>[OH-]
溶液显酸性
平衡向右移动
思考:把NH4Cl加入D2O中的变化:
H2O的电离平衡
NH4Cl的电离
水解反应方程式:
NH4Cl+H2O NH3·H2O + HCl
离子方程式:
NH4++ H2O NH3·H2O + H+
H2O H+ + OH-
NH4++D2O NH3·HDO+ D+
4. 特征:盐类水解反应存在平衡、是吸热过程,是微弱的。
5.规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解,
谁强显谁性,同弱显中性。
盐类水解的规律
类型 实例 是否水解 水解的离子 生成弱电解质 溶液的酸碱性
强酸弱碱盐 FeCl3
强碱弱酸盐 NaClO
强酸强碱盐 NaNO3
弱碱弱酸盐 CH3COONH4
水解
水解
不水解
弱碱阳离子
弱酸阴离子
无
弱碱
弱酸
无
酸性
碱性
中性
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解;
-----条件
-----结果
越弱越水解;都弱双水解;
水解
弱碱阳离子弱酸阴离子
弱酸弱碱
(1)用化学方程式表示:
盐+水 酸+碱
(2)用离子方程式表示:
CH3COONa+H2O
CH3COOH+NaOH
CH3COO-+H2O CH3COOH+OH-
6、盐类水解方程式的书写
盐的弱离子+水 弱酸(或弱碱)+OH-(或H+)
NH4+ + H2O NH3·H2O + H+
NH4Cl + H2O NH3·H2O + HCl
1、书写下列盐的水解离子方程式:
①CH3COONa ②NH4Cl ③NaF
④Na2CO3 ⑤ Na2SO3 ⑥Na3PO4
⑦Na2S ⑧AlCl3 ⑨FeCl3
⑩CuSO4
⑶ 书写盐类水解方程式注意事项
①盐类水解是可逆反应,水解方程式中用可逆符号连接,而不使用等号。
②一般水解程度小,水解产物少,通常不生成 沉淀和气体,不标“↓” “↑”符号,生成物如(H2CO3、 NH3.H2O )也不写成分解产物。
③多元弱酸阴离子分步水解分步写;多元弱碱阳离子,分步水解一步写。
④相互促进水解(双水解),有的仍然很微弱,用可逆符号连接,而不使用等号;有的水解的比较彻底,要用等号,可能有气体、沉淀生成,标“↓” “↑”符号。
Al3+
与HCO3-、CO32-、HS-、S2- 、[Al(OH)4]-
Fe3+
与HCO3-、CO32- 、[Al(OH)4]-
NH4+与 SiO32-
常见能发生相互促进水解较彻底水解的离子(双水解)
思考:CH3COONH4、Al2S3 水解方程式:
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+ 3H2S↑
CH3COONH4+H2O CH3COOH+ NH3.H2O
阅读课本103页,了解《拓展视野 水解平衡常数》,了解水解平衡常数和水解关系。
越弱越水解
7. 影响水解平衡的因素
(1)内部因素:电解质本身的性质是决定性因素:
相同条件下,弱酸的酸性越弱,其形成的盐越易水解,盐溶液的碱性越强;弱碱的碱性越弱,其形成的盐越易水解,盐溶液的酸性越强。
①温度:盐的水解反应是吸热反应,升高温度水解平衡向右移动,水解程度增大。
②浓度:加水稀释盐的溶液,水解平衡向右移动,水解程度增大。
③外加酸、碱:加酸可抑制弱碱阳离子的水解,加碱可抑制弱酸酸根离子的水解。
④两种水解离子的相互影响:弱碱阳离子和弱酸酸根离子在同一溶液中,两种水解相互促进,使两种水解程度都增大,甚至反应完全。
(2)外部条件:外部条件是重要的影响因素
1.写出下列盐在水溶液中水解的离子方程式:
(1)NaF (2)AlCl3 (3)K2S (4)NH4NO3 (5)Mg3N2
2、⑴相同浓度的Na2CO3、NaHCO3、CH3COONa溶液的PH大小顺序为____________________________。
Na2CO3、NaHCO3、CH3COONa
⑵相同pH的Na2CO3、NaHCO3、CH3COONa溶液的浓度大小顺序为 ____________________________。
Na2CO3、NaHCO3、CH3COONa
⑷相同物质的量浓度的①NH4Cl ②(NH4)2SO4③CH3COONH4
④NH4HCO3⑤NH3·H2O⑥Fe(NH4)2(SO4)溶液,NH4+浓度由大到小排列正确的是 。
⑥ ② ① ③ ④ ⑤
⑶相同浓度的NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则对应三种酸的酸性强弱顺序为______________。
HX>HY>HZ
3、 物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
B
4、四种水溶液①HCI,②FeCI3,③KOH,④Na2CO3其 PH值依次为4、4、10、10,而溶液中水的电离度依次为α1、α2、α3、α4,则它们的关系正确的是( )
A.α1=α2=α3=α4 B.α1>α3>α2>α4
C.α4=α2>α3=α1 D.α1=α3>α2=α4
C
第三章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第3课时 盐类水解
知识体系
学习目标 核心素养培养
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,并进一步探究盐溶液呈现不同酸碱性的原因,总结其规律, 证据推理与模型认知
2.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响, 变化观念与平衡思想
3.熟练掌握盐类水解的表示方法——水解离子方程式的书写, 宏观辨识与微观探析
盐溶液都显中性吗?(0.1mol·L)(课本P100),使用pH试纸测定下列盐溶液的pH。
盐 CH3COONa Na2CO3 NaCl NH4Cl Al2(SO4) 3 KNO3
类 别
pH
活动·探究:
强碱弱酸盐
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
强酸弱碱盐
强酸强碱盐
>7
>7
=7
<7
<7
=7
NaCl KNO3
思考:氯化钠、硝酸钾溶液中有哪些离子存在?哪些离子可以相互结合?
对水的电离平衡无影响,强酸强碱盐溶液显中性。
NaCl == Na+ + Cl-
H2O OH- + H+
1.强酸强碱盐
KNO3 == K+ + NO3-
H2O OH- + H+
结论:
思考:醋酸钠、碳酸钠溶液中有哪些离子存在?哪些离子可以相互结合?
CH3COONa 、Na2CO3
促进水的电离,强碱弱酸盐溶液显碱性
2.强碱弱酸盐
Na2CO3 == 2Na+ + CO32-
CH3COONa == Na+ + CH3COO-
H2O OH- + H+
+
CH3COOH
平衡向右移动
H2O OH- + H+
+
HCO-3
平衡向右移动
结论:
[OH-]>[H+]
[OH-]>[H+]
+
NH3·H2O
NH4Cl= Cl-+NH4+
H2O H+ +OH-
NH4Cl、Al2 (SO4) 3
促进水的电离、强酸弱碱盐溶液显酸性
思考:氯化铵、硫酸铝溶液中有哪些离子存在?哪些离子可以相互结合
3.强酸弱碱盐
Al2(SO4)3= 3SO42-+ 2Al 3+
6H2O 6H++ 6OH-
2Al(OH)3
结论:
[H+]>[OH-]
平衡向右移动
+
平衡向右移动
[H+]>[OH-]
CH3COONH4
促进水的电离、弱酸弱碱盐溶液酸碱性具体分析。
思考: 醋酸铵溶液中有哪些离子存在?哪些离子可以相互结合?
4.弱酸弱碱盐
CH3COONH4 = NH4+ + CH3COO -
H2O OH- + H+
+
CH3COOH
+
NH3.H2O
结论:
平衡向右移动
[H+]≈[OH-]
1. 定义:在溶液中由盐电离出来的弱酸根离子或弱碱阳离子与水所电离出来的H+或OH-结合生成弱电解质的过程。
2. 条件:①盐必须溶于水
②盐必须有“弱”离子(弱酸根离子或弱碱阳离子)
二、盐类的水解
3. 实质:盐类水解反应是中和反应的逆反应 (吸热反应)
盐类水解促进水的电离(破坏了水的电离)
把NH4Cl加入H2O中的变化:
+
NH3·H2O
NH4Cl = Cl- + NH4+
[H+]>[OH-]
溶液显酸性
平衡向右移动
思考:把NH4Cl加入D2O中的变化:
H2O的电离平衡
NH4Cl的电离
水解反应方程式:
NH4Cl+H2O NH3·H2O + HCl
离子方程式:
NH4++ H2O NH3·H2O + H+
H2O H+ + OH-
NH4++D2O NH3·HDO+ D+
4. 特征:盐类水解反应存在平衡、是吸热过程,是微弱的。
5.规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解,
谁强显谁性,同弱显中性。
盐类水解的规律
类型 实例 是否水解 水解的离子 生成弱电解质 溶液的酸碱性
强酸弱碱盐 FeCl3
强碱弱酸盐 NaClO
强酸强碱盐 NaNO3
弱碱弱酸盐 CH3COONH4
水解
水解
不水解
弱碱阳离子
弱酸阴离子
无
弱碱
弱酸
无
酸性
碱性
中性
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解;
-----条件
-----结果
越弱越水解;都弱双水解;
水解
弱碱阳离子弱酸阴离子
弱酸弱碱
(1)用化学方程式表示:
盐+水 酸+碱
(2)用离子方程式表示:
CH3COONa+H2O
CH3COOH+NaOH
CH3COO-+H2O CH3COOH+OH-
6、盐类水解方程式的书写
盐的弱离子+水 弱酸(或弱碱)+OH-(或H+)
NH4+ + H2O NH3·H2O + H+
NH4Cl + H2O NH3·H2O + HCl
1、书写下列盐的水解离子方程式:
①CH3COONa ②NH4Cl ③NaF
④Na2CO3 ⑤ Na2SO3 ⑥Na3PO4
⑦Na2S ⑧AlCl3 ⑨FeCl3
⑩CuSO4
⑶ 书写盐类水解方程式注意事项
①盐类水解是可逆反应,水解方程式中用可逆符号连接,而不使用等号。
②一般水解程度小,水解产物少,通常不生成 沉淀和气体,不标“↓” “↑”符号,生成物如(H2CO3、 NH3.H2O )也不写成分解产物。
③多元弱酸阴离子分步水解分步写;多元弱碱阳离子,分步水解一步写。
④相互促进水解(双水解),有的仍然很微弱,用可逆符号连接,而不使用等号;有的水解的比较彻底,要用等号,可能有气体、沉淀生成,标“↓” “↑”符号。
Al3+
与HCO3-、CO32-、HS-、S2- 、[Al(OH)4]-
Fe3+
与HCO3-、CO32- 、[Al(OH)4]-
NH4+与 SiO32-
常见能发生相互促进水解较彻底水解的离子(双水解)
思考:CH3COONH4、Al2S3 水解方程式:
2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓+ 3H2S↑
CH3COONH4+H2O CH3COOH+ NH3.H2O
阅读课本103页,了解《拓展视野 水解平衡常数》,了解水解平衡常数和水解关系。
越弱越水解
7. 影响水解平衡的因素
(1)内部因素:电解质本身的性质是决定性因素:
相同条件下,弱酸的酸性越弱,其形成的盐越易水解,盐溶液的碱性越强;弱碱的碱性越弱,其形成的盐越易水解,盐溶液的酸性越强。
①温度:盐的水解反应是吸热反应,升高温度水解平衡向右移动,水解程度增大。
②浓度:加水稀释盐的溶液,水解平衡向右移动,水解程度增大。
③外加酸、碱:加酸可抑制弱碱阳离子的水解,加碱可抑制弱酸酸根离子的水解。
④两种水解离子的相互影响:弱碱阳离子和弱酸酸根离子在同一溶液中,两种水解相互促进,使两种水解程度都增大,甚至反应完全。
(2)外部条件:外部条件是重要的影响因素
1.写出下列盐在水溶液中水解的离子方程式:
(1)NaF (2)AlCl3 (3)K2S (4)NH4NO3 (5)Mg3N2
2、⑴相同浓度的Na2CO3、NaHCO3、CH3COONa溶液的PH大小顺序为____________________________。
Na2CO3、NaHCO3、CH3COONa
⑵相同pH的Na2CO3、NaHCO3、CH3COONa溶液的浓度大小顺序为 ____________________________。
Na2CO3、NaHCO3、CH3COONa
⑷相同物质的量浓度的①NH4Cl ②(NH4)2SO4③CH3COONH4
④NH4HCO3⑤NH3·H2O⑥Fe(NH4)2(SO4)溶液,NH4+浓度由大到小排列正确的是 。
⑥ ② ① ③ ④ ⑤
⑶相同浓度的NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则对应三种酸的酸性强弱顺序为______________。
HX>HY>HZ
3、 物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
B
4、四种水溶液①HCI,②FeCI3,③KOH,④Na2CO3其 PH值依次为4、4、10、10,而溶液中水的电离度依次为α1、α2、α3、α4,则它们的关系正确的是( )
A.α1=α2=α3=α4 B.α1>α3>α2>α4
C.α4=α2>α3=α1 D.α1=α3>α2=α4
C
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
