3.2.4 水解原理的应用(共19张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 3.2.4 水解原理的应用(共19张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 468.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第三章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第4课时 水解原理的应用
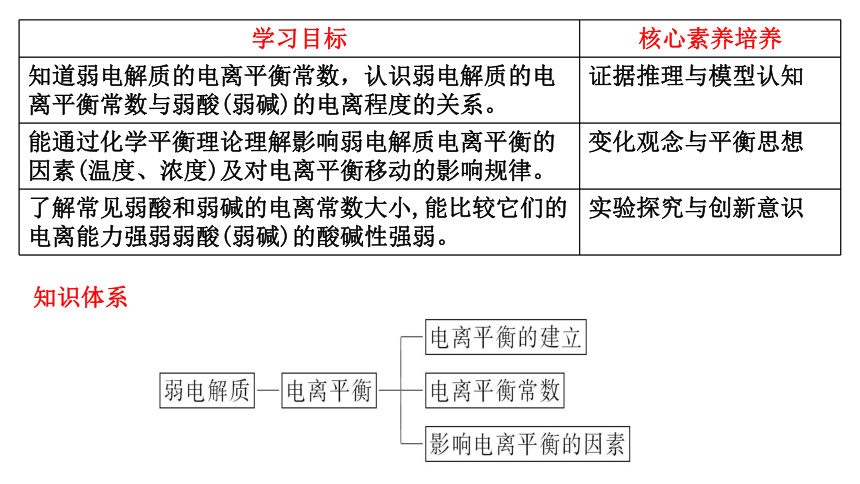
知识体系
学习目标 核心素养培养
知道弱电解质的电离平衡常数,认识弱电解质的电离平衡常数与弱酸(弱碱)的电离程度的关系。 证据推理与模型认知
能通过化学平衡理论理解影响弱电解质电离平衡的因素(温度、浓度)及对电离平衡移动的影响规律。 变化观念与平衡思想
了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱弱酸(弱碱)的酸碱性强弱。 实验探究与创新意识
二、盐类水解的应用
如:硫酸铵溶液:
氟化钠溶液:
1、判断盐溶液的酸碱性
显酸性
显碱性
强碱酸式盐
(1) 强酸酸式盐只电离,不水解,一定显酸性。如:HSO4-
(2) 弱酸酸式盐既电离又水解。
电离强于水解,显酸性,如 H2PO4-、HSO3-
水解强于电离,显碱性,如 HCO3-、 HPO42-
思考:金属镁与水反应比较困难,若加一些 NH4Cl 马上产生大量气体?为什么?写出相应的方程式。
铵根离子水解,使溶液显酸性,H+浓度增大,金属镁和H+作用,生成氢气。
2H2O+ Mg = Mg(OH)2 + H2 ↑
NH4++H2O NH3·H2O + H+
金属焊接时,可以利用NH4Cl溶液做除锈剂。
2、配制和储存易水解的盐溶液时,需加入酸或碱抑制盐的水解。
如:配制FeCl3溶液?
配制CuSO4溶液?
将CuSO4溶于稀硫酸,再加入水,抑制Cu2+的水解
将FeCl3粉末溶于稀盐酸,再加入水,抑制Fe3+的水解。FeCl3溶于水时,Fe3+易发生水解产生浑浊,加适量的盐酸可以抑制Fe3+发生水解。Fe3++3H2O Fe(OH)3 +3H+
3、比较盐溶液酸碱性的强弱
(1)pH NaA大于 NaB
酸性 HA HB
(2)pH MgCl2大于AlCl3,
碱性 Mg(OH)2 Al(OH)3
(3)用一个盐的性质证明Cu(OH)2是弱碱
<
>
CuSO4溶液显酸性
当有弱碱阳离子和弱酸阴离子之间能发生完全双水解,则不能在溶液中大量共存。
Al3+
与HCO3-、CO32-、HS-、S2-、[Al(OH)4]-
Fe3+
与HCO3-、CO32- 、[Al(OH)4]-
NH4+与 SiO32-
4、判断溶液中离子能否大量共存或除杂质离子。
通过调节溶液的酸碱性使某些离子的水解程度变大,沉淀而过滤除去。如除去KNO3溶液中少量的Fe3+离子可用什么方法?
加KOH调节溶液的 pH≥4,使Fe3+较彻底水解并沉淀,然后经过滤而除去Fe3+。Fe3++3H2O Fe(OH)3+3H+
5、选择制备某些盐的方法时,需考虑盐的水解。
实验室用FeCl3制备Fe(OH)3胶体
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
如制备Al2S3、Mg3N2时,因无法在溶液中制取,会完全水解,只能由干态法直接反应制取。
可以利用TiCl4水解制备TiO2。
TiCl4+(x+2)H2O=TiO2 xH2O↓+4HCl
Fe3++3H2O Fe(OH)3(胶体)+3H+
思考:说明盛放Na2S 、Na2CO3的试剂瓶不能用玻璃塞的原因。
6、某些试剂的实验室存放,需要考虑盐的水解。
Na2CO3溶液、Na2SiO3溶液等碱性溶液不能使用磨口试剂瓶和玻璃塞
S2-和CO32-水解使溶液显碱性,CO32-+H2O HCO3-+OH-
产生大量的OH-,和玻璃中的SiO2反应生成Na2SiO3,使瓶口和瓶塞粘结在一起,不易打开。
Al2(SO4)3
7、某些盐溶液加热蒸干产物
NaCl溶液、Na2CO3溶液、FeCl3溶液、Al2(SO4)3溶液分别加热蒸干、灼烧、后最终产物是什么
Fe2O3
NaCl
Na2CO3
思考:将FeCl3溶液加热蒸干,最终析出的固体是什么?为什么?如果是蒸干Fe2(SO4)3呢?
FeCl3溶液中存在Fe3+水解平衡,FeCl3+3H2O Fe(OH)3↓+3HCl,加热蒸发时,促进Fe3+水解,生成的HCl挥发,导致水解不断进行,最后得到Fe(OH)3固体。灼烧后Fe(OH)3固体分解得到Fe2O3。
Fe2(SO4)3加热蒸发时,Fe3+水解,生成的H2SO4不挥发,导致水解不能继续进行,最后得到Fe2(SO4)3固体。
⑴加热蒸发结晶:带结晶水的(明矾KAl2(SO4)3 12H2O)、受热易分解的(如NaHCO3)
⑶加热蒸干焙烧(灼烧):分解产物或氧化产物(NaHCO3、KMnO4)
⑵加热蒸干:
①电解质本身:不水解的盐(如NaCl)、水解但不能持续水解的盐(如Na2CO3、Al2(SO4)3 )
②水解产物:水解且能持续水解的盐(如FeCl3、AlCl3、Fe(NO3)3 )
③氧化产物:具有较强的还原性,加热易被氧化或水解产物易被氧化的物质(Na2SO3、FeCl2)
④分解产物:受热易分解(如NaHCO3部分分解)
盐溶液中离子种类多少的判断,需考虑到盐类的水解
8、分析盐溶液中的离子浓度大小关系
如:0.1mol L-1氯化铵溶液中存在:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
c(Cl-) + c(OH-)=c(NH4+)+ c(H+)
c(Cl-) = c(NH4+) + c(NH3 H2O)=0.1mol L-1
电荷守恒
原子守恒(元素质量守恒)
9、缓冲溶液
被蚂蚁、黄蜂或蜜蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为黄蜂分泌物中含有的是一种碱性物质(主要成分为组胺、五羟色胺),而蚂蚁、蜜蜂分泌物中含有的是一种酸性物质(主要成分是蚁酸、甲酸、HCOOH)。
处理方法:
被黄蜂叮咬:在患处涂抹食醋可减轻疼痛。
被蚂蚁、蜜蜂叮咬:在患处涂抹纯碱、小苏打或肥皂水溶液可减轻疼痛。
①蚂蚁、蜂蜇处理办法
9、解释生产生活中的问题
②明矾[KAl(SO4)2·12H2O]的净水原理(课本第106页)
FeCl3也能净水,原理与明矾相同.
明矾溶于水后,明矾在水中发生电离产生Al3+,Al3+发生水解,生成胶状的Al(OH)3,Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体具有吸附作用,能吸附水中的固体悬浮物,并沉淀下来,起到净水作用。
Fe3++3H2O Fe(OH)3(胶体)+3H+
(人教版课本第106页)
③纯碱溶液和肥皂水洗涤油污的原理。
Na2CO3+H2O NaHCO3+NaOH
C17H35COONa+H2O C17H35COOH+NaOH
碳酸钠水解,CO32-+H2O HCO3-+OH-
升高温度,可以促进水解,使溶液碱性更强,有利于油脂的水解,洗涤时去污效果更好。
肥皂、高级脂肪酸的钠盐(如硬脂酸钠)、C17H35COONa
④草木灰和铵态肥混合损失肥效
草木灰的成分:K2CO3,水解呈碱性。
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+
NH4+ 和 CO32-相互促进水解,CO32-+H2O HCO3-+OH-,NH4++H2O NH3·H2O+H+ ,使NH4+水解程度增大,生成的NH3·H2O分解生成氨气挥发,降低肥效。
NH3·H2O NH3↑+H2O
⑤灭火器原理.
实际使用的灭火器是铁桶中放一个塑料筒,两桶中放不同溶液,塑料筒里面放入的什么是溶液?铁桶中放的是什么溶液?为什么?
NaHCO3溶液和Al2(SO4)3溶液
Al3++3H2O Al(OH)3+3H+、 HCO3-+H2O H2CO3 +OH-
总反应:Al3+ +3HCO3- =Al(OH)3↓+ 3CO2↑
NaHCO3溶液
Al2(SO4)3溶液
NaHCO3溶液、Na2CO3溶液哪种较好?
⑥某些商家在制作油炸食品(油条或油饼)时放明矾与纯碱,可以使食品的外观更好看,显得蓬松。
Al3++3H2O Al(OH)3+3H+
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
长期食用含铝的膨松剂的食品,有害健康(影响智力、易患老年痴呆。
第三章物质在水溶液中的行为
第2节弱电解质的电离 盐类的水解
第4课时 水解原理的应用
知识体系
学习目标 核心素养培养
知道弱电解质的电离平衡常数,认识弱电解质的电离平衡常数与弱酸(弱碱)的电离程度的关系。 证据推理与模型认知
能通过化学平衡理论理解影响弱电解质电离平衡的因素(温度、浓度)及对电离平衡移动的影响规律。 变化观念与平衡思想
了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱弱酸(弱碱)的酸碱性强弱。 实验探究与创新意识
二、盐类水解的应用
如:硫酸铵溶液:
氟化钠溶液:
1、判断盐溶液的酸碱性
显酸性
显碱性
强碱酸式盐
(1) 强酸酸式盐只电离,不水解,一定显酸性。如:HSO4-
(2) 弱酸酸式盐既电离又水解。
电离强于水解,显酸性,如 H2PO4-、HSO3-
水解强于电离,显碱性,如 HCO3-、 HPO42-
思考:金属镁与水反应比较困难,若加一些 NH4Cl 马上产生大量气体?为什么?写出相应的方程式。
铵根离子水解,使溶液显酸性,H+浓度增大,金属镁和H+作用,生成氢气。
2H2O+ Mg = Mg(OH)2 + H2 ↑
NH4++H2O NH3·H2O + H+
金属焊接时,可以利用NH4Cl溶液做除锈剂。
2、配制和储存易水解的盐溶液时,需加入酸或碱抑制盐的水解。
如:配制FeCl3溶液?
配制CuSO4溶液?
将CuSO4溶于稀硫酸,再加入水,抑制Cu2+的水解
将FeCl3粉末溶于稀盐酸,再加入水,抑制Fe3+的水解。FeCl3溶于水时,Fe3+易发生水解产生浑浊,加适量的盐酸可以抑制Fe3+发生水解。Fe3++3H2O Fe(OH)3 +3H+
3、比较盐溶液酸碱性的强弱
(1)pH NaA大于 NaB
酸性 HA HB
(2)pH MgCl2大于AlCl3,
碱性 Mg(OH)2 Al(OH)3
(3)用一个盐的性质证明Cu(OH)2是弱碱
<
>
CuSO4溶液显酸性
当有弱碱阳离子和弱酸阴离子之间能发生完全双水解,则不能在溶液中大量共存。
Al3+
与HCO3-、CO32-、HS-、S2-、[Al(OH)4]-
Fe3+
与HCO3-、CO32- 、[Al(OH)4]-
NH4+与 SiO32-
4、判断溶液中离子能否大量共存或除杂质离子。
通过调节溶液的酸碱性使某些离子的水解程度变大,沉淀而过滤除去。如除去KNO3溶液中少量的Fe3+离子可用什么方法?
加KOH调节溶液的 pH≥4,使Fe3+较彻底水解并沉淀,然后经过滤而除去Fe3+。Fe3++3H2O Fe(OH)3+3H+
5、选择制备某些盐的方法时,需考虑盐的水解。
实验室用FeCl3制备Fe(OH)3胶体
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
如制备Al2S3、Mg3N2时,因无法在溶液中制取,会完全水解,只能由干态法直接反应制取。
可以利用TiCl4水解制备TiO2。
TiCl4+(x+2)H2O=TiO2 xH2O↓+4HCl
Fe3++3H2O Fe(OH)3(胶体)+3H+
思考:说明盛放Na2S 、Na2CO3的试剂瓶不能用玻璃塞的原因。
6、某些试剂的实验室存放,需要考虑盐的水解。
Na2CO3溶液、Na2SiO3溶液等碱性溶液不能使用磨口试剂瓶和玻璃塞
S2-和CO32-水解使溶液显碱性,CO32-+H2O HCO3-+OH-
产生大量的OH-,和玻璃中的SiO2反应生成Na2SiO3,使瓶口和瓶塞粘结在一起,不易打开。
Al2(SO4)3
7、某些盐溶液加热蒸干产物
NaCl溶液、Na2CO3溶液、FeCl3溶液、Al2(SO4)3溶液分别加热蒸干、灼烧、后最终产物是什么
Fe2O3
NaCl
Na2CO3
思考:将FeCl3溶液加热蒸干,最终析出的固体是什么?为什么?如果是蒸干Fe2(SO4)3呢?
FeCl3溶液中存在Fe3+水解平衡,FeCl3+3H2O Fe(OH)3↓+3HCl,加热蒸发时,促进Fe3+水解,生成的HCl挥发,导致水解不断进行,最后得到Fe(OH)3固体。灼烧后Fe(OH)3固体分解得到Fe2O3。
Fe2(SO4)3加热蒸发时,Fe3+水解,生成的H2SO4不挥发,导致水解不能继续进行,最后得到Fe2(SO4)3固体。
⑴加热蒸发结晶:带结晶水的(明矾KAl2(SO4)3 12H2O)、受热易分解的(如NaHCO3)
⑶加热蒸干焙烧(灼烧):分解产物或氧化产物(NaHCO3、KMnO4)
⑵加热蒸干:
①电解质本身:不水解的盐(如NaCl)、水解但不能持续水解的盐(如Na2CO3、Al2(SO4)3 )
②水解产物:水解且能持续水解的盐(如FeCl3、AlCl3、Fe(NO3)3 )
③氧化产物:具有较强的还原性,加热易被氧化或水解产物易被氧化的物质(Na2SO3、FeCl2)
④分解产物:受热易分解(如NaHCO3部分分解)
盐溶液中离子种类多少的判断,需考虑到盐类的水解
8、分析盐溶液中的离子浓度大小关系
如:0.1mol L-1氯化铵溶液中存在:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
c(Cl-) + c(OH-)=c(NH4+)+ c(H+)
c(Cl-) = c(NH4+) + c(NH3 H2O)=0.1mol L-1
电荷守恒
原子守恒(元素质量守恒)
9、缓冲溶液
被蚂蚁、黄蜂或蜜蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为黄蜂分泌物中含有的是一种碱性物质(主要成分为组胺、五羟色胺),而蚂蚁、蜜蜂分泌物中含有的是一种酸性物质(主要成分是蚁酸、甲酸、HCOOH)。
处理方法:
被黄蜂叮咬:在患处涂抹食醋可减轻疼痛。
被蚂蚁、蜜蜂叮咬:在患处涂抹纯碱、小苏打或肥皂水溶液可减轻疼痛。
①蚂蚁、蜂蜇处理办法
9、解释生产生活中的问题
②明矾[KAl(SO4)2·12H2O]的净水原理(课本第106页)
FeCl3也能净水,原理与明矾相同.
明矾溶于水后,明矾在水中发生电离产生Al3+,Al3+发生水解,生成胶状的Al(OH)3,Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体具有吸附作用,能吸附水中的固体悬浮物,并沉淀下来,起到净水作用。
Fe3++3H2O Fe(OH)3(胶体)+3H+
(人教版课本第106页)
③纯碱溶液和肥皂水洗涤油污的原理。
Na2CO3+H2O NaHCO3+NaOH
C17H35COONa+H2O C17H35COOH+NaOH
碳酸钠水解,CO32-+H2O HCO3-+OH-
升高温度,可以促进水解,使溶液碱性更强,有利于油脂的水解,洗涤时去污效果更好。
肥皂、高级脂肪酸的钠盐(如硬脂酸钠)、C17H35COONa
④草木灰和铵态肥混合损失肥效
草木灰的成分:K2CO3,水解呈碱性。
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+
NH4+ 和 CO32-相互促进水解,CO32-+H2O HCO3-+OH-,NH4++H2O NH3·H2O+H+ ,使NH4+水解程度增大,生成的NH3·H2O分解生成氨气挥发,降低肥效。
NH3·H2O NH3↑+H2O
⑤灭火器原理.
实际使用的灭火器是铁桶中放一个塑料筒,两桶中放不同溶液,塑料筒里面放入的什么是溶液?铁桶中放的是什么溶液?为什么?
NaHCO3溶液和Al2(SO4)3溶液
Al3++3H2O Al(OH)3+3H+、 HCO3-+H2O H2CO3 +OH-
总反应:Al3+ +3HCO3- =Al(OH)3↓+ 3CO2↑
NaHCO3溶液
Al2(SO4)3溶液
NaHCO3溶液、Na2CO3溶液哪种较好?
⑥某些商家在制作油炸食品(油条或油饼)时放明矾与纯碱,可以使食品的外观更好看,显得蓬松。
Al3++3H2O Al(OH)3+3H+
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
长期食用含铝的膨松剂的食品,有害健康(影响智力、易患老年痴呆。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
