3.3.2 沉淀平衡的应用(共21张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 3.3.2 沉淀平衡的应用(共21张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 554.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:07:48 | ||
图片预览







文档简介
(共21张PPT)
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
第2课时 沉淀平衡的应用
知识体系
学习目标 核心素养培养
1.知道难溶电解质的沉淀溶解平衡及其影响因素以及沉淀溶解平衡的移动,能多角度、动态地分析难溶电解质的溶解平衡。 变化观念与平衡思想
知道溶度积的意义,建立根据溶度积和离子积的大小关系判断反应进行方向的思维模型。 证据推理与模型认知
学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。 科学态度与社会责任
①分别向Mg(OH)2悬浊液中滴加盐酸、NH4Cl溶液。观察并记录象。 , 。
1、沉淀的溶解与生成
⑴沉淀的溶解(Q < Ksp )
实验探究:
沉淀溶解溶液澄清
沉淀溶解溶液澄清
二、沉淀溶解平衡的应用
加入NH4Cl溶液后,NH4+ + OH— NH3 · H2O,c(OH—) ,Q < Ksp,平衡向 方向移动,Mg(OH)2沉淀溶解。
溶解(正)
减小
Mg(OH)2在溶液中存在溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),加入盐酸,使c(OH-) ,Q < Ksp,平衡向 方向移动,Mg(OH)2沉淀溶解。
减小
溶解(正)
②利用沉淀溶解平衡的移动来解释现象的产生。
为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
BaCO3 Ba2+ + CO32-
所以,不能用BaCO3作为内服造影剂“钡餐”。
SO42-是强酸的酸根离子,很难与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡基本没有影响,Ba2+浓度保持在安全浓度标准内,所以用BaSO4 作为内服造影剂“钡餐”。
分析
+
H+
H2O+CO2↑
平衡向右移动,Q < Ksp,BaCO3溶解,Ba2+浓度增大
胃酸中的H+浓度较大
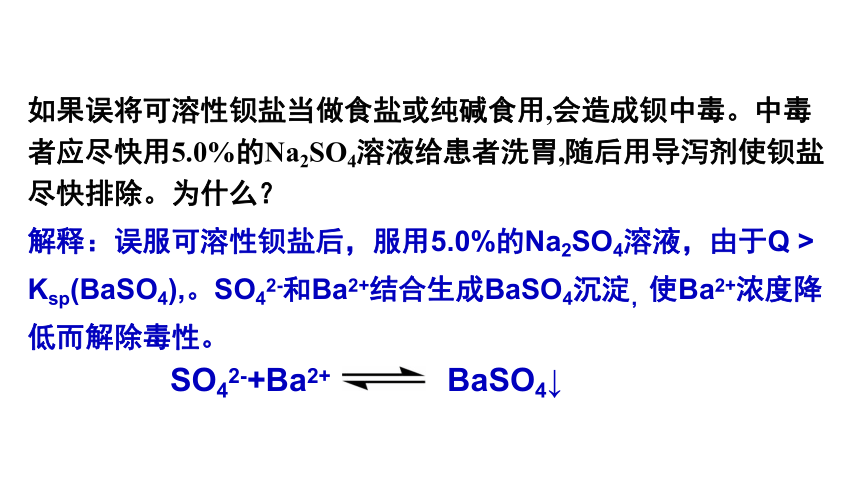
如果误将可溶性钡盐当做食盐或纯碱食用,会造成钡中毒。中毒者应尽快用5.0%的Na2SO4溶液给患者洗胃,随后用导泻剂使钡盐尽快排除。为什么?
SO42-+Ba2+ BaSO4↓
解释:误服可溶性钡盐后,服用5.0%的Na2SO4溶液,由于Q > Ksp(BaSO4),。SO42-和Ba2+结合生成BaSO4沉淀,使Ba2+浓度降低而解除毒性。
CaCO3 Ca2+ + CO32-
2HCO3-
+
H2O+CO2
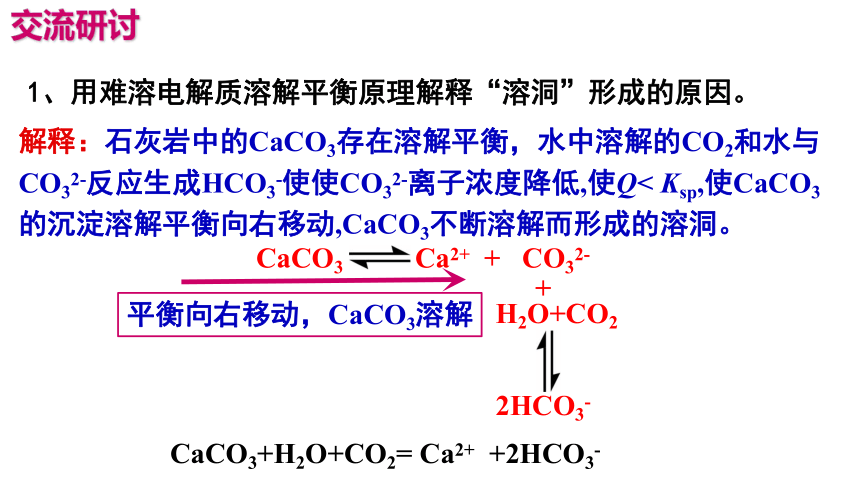
1、用难溶电解质溶解平衡原理解释“溶洞”形成的原因。
交流研讨
解释:石灰岩中的CaCO3存在溶解平衡,水中溶解的CO2和水与CO32-反应生成HCO3-使使CO32-离子浓度降低,使Q< Ksp,使CaCO3的沉淀溶解平衡向右移动,CaCO3不断溶解而形成的溶洞。
平衡向右移动,CaCO3溶解
CaCO3+H2O+CO2= Ca2+ +2HCO3-
2、利用沉淀溶解平衡的原理解释人类活动造成珊瑚虫的死亡、影响珊瑚生长的原因?
解释:珊瑚是珊瑚虫从周围海水中获取Ca2+和HCO3-生成CaCO3而不断生长。CaCO3存在溶解平衡,人类活动使空气中的CO2浓度增大,海水水中溶解的CO2增多,与更多的CO32-反应生成HCO3-,使Q < Ksp(CaCO3),CaCO3的沉淀溶解平衡向右移动,CaCO3不断溶解而造成的珊瑚减少,珊瑚虫死亡。
CaCO3 Ca2+ + CO32-
c(CO32-)减小,平衡向右移动。
①通过调节pH,使弱碱阳离子生成沉淀
工业原料氯化铵中含有杂质氯化铁,使其溶于水,再加入 来调节pH至4~5,可使Fe3+转变为 沉淀而除去。
氨水
Fe(OH)3
Fe3+ + 3NH3 H2O=Fe(OH)3↓+3NH4+
⑵沉淀的生成(Q > Ksp)
如沉淀Cu2+、Hg2+等,以Na2S、H2S作沉淀剂。
Cu2+ + S2— = CuS↓
Cu2+ + H2S = CuS↓+ 2H+
②加沉淀剂
溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀有先后顺序,叫分步沉淀。离子浓度相等时,需要沉淀剂的浓度小(先符合Qc > Ksp)的先沉淀。
③ 分步沉淀
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值(<10—5 mol/L)
Fe2+ 6.95 8.95
Cu2+ 4.67 6.67
Fe3+ 1.87 3.2
⑴根据上表的数据,如何除去CuCl2中混有的Fe3+ (不引入其他杂质,不能将主体离子除去)
练习1、分析下表中的数据,回答下列问题:
⑵根据上表的数据,如何除去CuCl2中混有的Fe2+?
加入Cu(OH)2或CuO或Cu2(OH)2CO3调节pH至3 - 4范围,使 Fe3+ 全部转化为 Fe(OH)3沉淀,过滤除去。
先使用氧化剂(Cl2、氯水、H2O2)把Fe2+氧化成Fe3+,再加入Cu(OH)2或CuO或Cu2(OH)2CO3 ,调节pH至3 ~ 4,使 Fe3+ 全部转化为 Fe(OH)3沉淀,过滤除去。
2、常温下,在某溶液中,Fe2+的浓度为0.1mol/L,使得 Fe2+ 刚好开始沉淀为Fe(OH)2 时的 c(OH-)= ;完全沉淀为Fe(OH)2 时的 c (OH-)= 。
(常温下Fe(OH)2的Ksp为8.0 X 10—16)
8.94 ×10-8mol/L
8.94 ×10-6mol/L
3、已知AgI的Ksp=8.5×10—17,AgCl的Ksp=1.8×10—10。在含有0.01mol/L NaI 和 0.01mol/L NaCl 的溶液中,逐滴加入 AgNO3溶液,先析出 沉淀。
AgI
4.己知Ksp(AgCl)=1.56×10-10 、Ksp(AgBr)= 7.7 ×10-11、Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有Cl-, Br-和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl- 、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br- 、CrO42-、Cl-
C
观察与思考:
⑶白色沉淀转化成为黑色沉淀
⑴有白色沉淀出现
ZnS转化为CuS
白色的ZnS沉淀会转化成为黑色的CuS沉淀。
实验过程:
实验现象:
实验结论:
实验分析:
阅读课本第112-113页对白色的ZnS沉淀会转化成为黑色的CuS沉淀的分析与解释。
ZnS与CuS是同类难溶物,Ksp(CuS) Ksp(ZnS) , CuS的溶解度远小于ZnS的溶解度。
2、沉淀的转化
①通常,溶解度( 或Ksp )小的沉淀可向溶解度 (或Ksp)更小的沉淀转化;
②溶解度差别越大,转化越容易;若相差不大,则可相互转化。
⑴沉淀的转化一般规律:
①存在沉淀A的溶解平衡,写方程式;
②加入B的离子,对于B,Q > Ksp(B),生成沉淀B;
③ 对于A,Q④沉淀A转化为沉淀B,反应的方程式。
⑵沉淀转化解释:
了解沉淀转化的实质和在生产生活中的应用“工业废水中,重金属离子Cu2+、Hg2+、Pb2+的处理方法”。
写出FeS(s)与废水中的Cu2+、Hg2+、Pb2+的反应离子方程式。
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+(aq)
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+(aq)
FeS(s) + Hg2+(aq)= HgS(s) + Fe2+(aq)
锅炉水垢生成和去除
水垢成分CaCO3
Mg(OH)2
CaSO4
MgCO3(s) Mg2+(aq) + CO32-(aq)
Mg2++2OH-=Mg(OH)2↓
Ca(HCO3)2
Mg(HCO3)2
MgSO4
CaSO4
MgCl2
CaCl2
水垢成分CaCO3
MgCO3
CaSO4
加热
长期烧煮
化学法除锅炉水垢的流程:
用饱和Na2CO3
溶液浸泡数天
疏松的水垢CaCO3
Mg(OH)2
除去水垢
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
用盐酸或饱和氯化铵液
CaSO4(s)+CO32- (aq) = CaCO3(s)+SO42-(aq)
水垢成分CaCO3
MgCO3
CaSO4
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
第2课时 沉淀平衡的应用
知识体系
学习目标 核心素养培养
1.知道难溶电解质的沉淀溶解平衡及其影响因素以及沉淀溶解平衡的移动,能多角度、动态地分析难溶电解质的溶解平衡。 变化观念与平衡思想
知道溶度积的意义,建立根据溶度积和离子积的大小关系判断反应进行方向的思维模型。 证据推理与模型认知
学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。 科学态度与社会责任
①分别向Mg(OH)2悬浊液中滴加盐酸、NH4Cl溶液。观察并记录象。 , 。
1、沉淀的溶解与生成
⑴沉淀的溶解(Q < Ksp )
实验探究:
沉淀溶解溶液澄清
沉淀溶解溶液澄清
二、沉淀溶解平衡的应用
加入NH4Cl溶液后,NH4+ + OH— NH3 · H2O,c(OH—) ,Q < Ksp,平衡向 方向移动,Mg(OH)2沉淀溶解。
溶解(正)
减小
Mg(OH)2在溶液中存在溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),加入盐酸,使c(OH-) ,Q < Ksp,平衡向 方向移动,Mg(OH)2沉淀溶解。
减小
溶解(正)
②利用沉淀溶解平衡的移动来解释现象的产生。
为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
BaCO3 Ba2+ + CO32-
所以,不能用BaCO3作为内服造影剂“钡餐”。
SO42-是强酸的酸根离子,很难与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡基本没有影响,Ba2+浓度保持在安全浓度标准内,所以用BaSO4 作为内服造影剂“钡餐”。
分析
+
H+
H2O+CO2↑
平衡向右移动,Q < Ksp,BaCO3溶解,Ba2+浓度增大
胃酸中的H+浓度较大
如果误将可溶性钡盐当做食盐或纯碱食用,会造成钡中毒。中毒者应尽快用5.0%的Na2SO4溶液给患者洗胃,随后用导泻剂使钡盐尽快排除。为什么?
SO42-+Ba2+ BaSO4↓
解释:误服可溶性钡盐后,服用5.0%的Na2SO4溶液,由于Q > Ksp(BaSO4),。SO42-和Ba2+结合生成BaSO4沉淀,使Ba2+浓度降低而解除毒性。
CaCO3 Ca2+ + CO32-
2HCO3-
+
H2O+CO2
1、用难溶电解质溶解平衡原理解释“溶洞”形成的原因。
交流研讨
解释:石灰岩中的CaCO3存在溶解平衡,水中溶解的CO2和水与CO32-反应生成HCO3-使使CO32-离子浓度降低,使Q< Ksp,使CaCO3的沉淀溶解平衡向右移动,CaCO3不断溶解而形成的溶洞。
平衡向右移动,CaCO3溶解
CaCO3+H2O+CO2= Ca2+ +2HCO3-
2、利用沉淀溶解平衡的原理解释人类活动造成珊瑚虫的死亡、影响珊瑚生长的原因?
解释:珊瑚是珊瑚虫从周围海水中获取Ca2+和HCO3-生成CaCO3而不断生长。CaCO3存在溶解平衡,人类活动使空气中的CO2浓度增大,海水水中溶解的CO2增多,与更多的CO32-反应生成HCO3-,使Q < Ksp(CaCO3),CaCO3的沉淀溶解平衡向右移动,CaCO3不断溶解而造成的珊瑚减少,珊瑚虫死亡。
CaCO3 Ca2+ + CO32-
c(CO32-)减小,平衡向右移动。
①通过调节pH,使弱碱阳离子生成沉淀
工业原料氯化铵中含有杂质氯化铁,使其溶于水,再加入 来调节pH至4~5,可使Fe3+转变为 沉淀而除去。
氨水
Fe(OH)3
Fe3+ + 3NH3 H2O=Fe(OH)3↓+3NH4+
⑵沉淀的生成(Q > Ksp)
如沉淀Cu2+、Hg2+等,以Na2S、H2S作沉淀剂。
Cu2+ + S2— = CuS↓
Cu2+ + H2S = CuS↓+ 2H+
②加沉淀剂
溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀有先后顺序,叫分步沉淀。离子浓度相等时,需要沉淀剂的浓度小(先符合Qc > Ksp)的先沉淀。
③ 分步沉淀
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值(<10—5 mol/L)
Fe2+ 6.95 8.95
Cu2+ 4.67 6.67
Fe3+ 1.87 3.2
⑴根据上表的数据,如何除去CuCl2中混有的Fe3+ (不引入其他杂质,不能将主体离子除去)
练习1、分析下表中的数据,回答下列问题:
⑵根据上表的数据,如何除去CuCl2中混有的Fe2+?
加入Cu(OH)2或CuO或Cu2(OH)2CO3调节pH至3 - 4范围,使 Fe3+ 全部转化为 Fe(OH)3沉淀,过滤除去。
先使用氧化剂(Cl2、氯水、H2O2)把Fe2+氧化成Fe3+,再加入Cu(OH)2或CuO或Cu2(OH)2CO3 ,调节pH至3 ~ 4,使 Fe3+ 全部转化为 Fe(OH)3沉淀,过滤除去。
2、常温下,在某溶液中,Fe2+的浓度为0.1mol/L,使得 Fe2+ 刚好开始沉淀为Fe(OH)2 时的 c(OH-)= ;完全沉淀为Fe(OH)2 时的 c (OH-)= 。
(常温下Fe(OH)2的Ksp为8.0 X 10—16)
8.94 ×10-8mol/L
8.94 ×10-6mol/L
3、已知AgI的Ksp=8.5×10—17,AgCl的Ksp=1.8×10—10。在含有0.01mol/L NaI 和 0.01mol/L NaCl 的溶液中,逐滴加入 AgNO3溶液,先析出 沉淀。
AgI
4.己知Ksp(AgCl)=1.56×10-10 、Ksp(AgBr)= 7.7 ×10-11、Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有Cl-, Br-和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl- 、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br- 、CrO42-、Cl-
C
观察与思考:
⑶白色沉淀转化成为黑色沉淀
⑴有白色沉淀出现
ZnS转化为CuS
白色的ZnS沉淀会转化成为黑色的CuS沉淀。
实验过程:
实验现象:
实验结论:
实验分析:
阅读课本第112-113页对白色的ZnS沉淀会转化成为黑色的CuS沉淀的分析与解释。
ZnS与CuS是同类难溶物,Ksp(CuS) Ksp(ZnS) , CuS的溶解度远小于ZnS的溶解度。
2、沉淀的转化
①通常,溶解度( 或Ksp )小的沉淀可向溶解度 (或Ksp)更小的沉淀转化;
②溶解度差别越大,转化越容易;若相差不大,则可相互转化。
⑴沉淀的转化一般规律:
①存在沉淀A的溶解平衡,写方程式;
②加入B的离子,对于B,Q > Ksp(B),生成沉淀B;
③ 对于A,Q
⑵沉淀转化解释:
了解沉淀转化的实质和在生产生活中的应用“工业废水中,重金属离子Cu2+、Hg2+、Pb2+的处理方法”。
写出FeS(s)与废水中的Cu2+、Hg2+、Pb2+的反应离子方程式。
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+(aq)
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+(aq)
FeS(s) + Hg2+(aq)= HgS(s) + Fe2+(aq)
锅炉水垢生成和去除
水垢成分CaCO3
Mg(OH)2
CaSO4
MgCO3(s) Mg2+(aq) + CO32-(aq)
Mg2++2OH-=Mg(OH)2↓
Ca(HCO3)2
Mg(HCO3)2
MgSO4
CaSO4
MgCl2
CaCl2
水垢成分CaCO3
MgCO3
CaSO4
加热
长期烧煮
化学法除锅炉水垢的流程:
用饱和Na2CO3
溶液浸泡数天
疏松的水垢CaCO3
Mg(OH)2
除去水垢
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
用盐酸或饱和氯化铵液
CaSO4(s)+CO32- (aq) = CaCO3(s)+SO42-(aq)
水垢成分CaCO3
MgCO3
CaSO4
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
