3.4.3 离子反应的应用2(共23张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件
文档属性
| 名称 | 3.4.3 离子反应的应用2(共23张PPT)-2023-2024学年高二化学鲁科版选择性必修第一册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 692.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 15:11:52 | ||
图片预览



文档简介
(共23张PPT)
第3章 物质在水溶液中的行为
第4节 离子反应
第3课时 离子反应的应用2
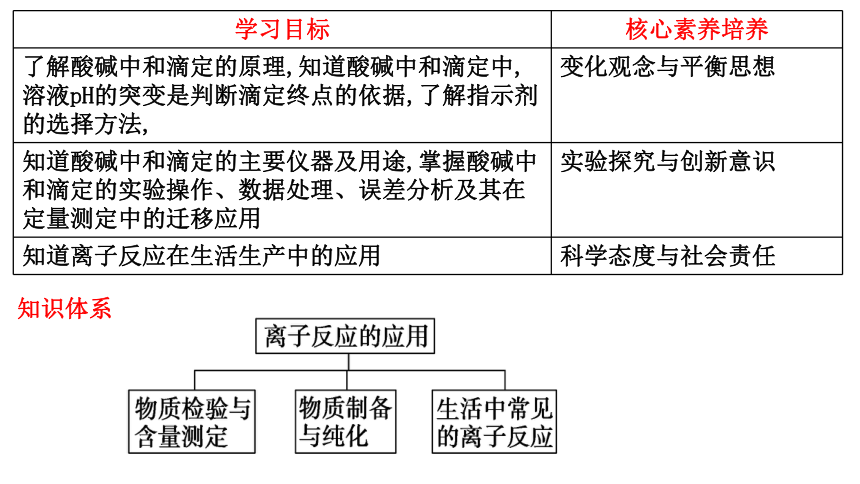
学习目标 核心素养培养
了解酸碱中和滴定的原理,知道酸碱中和滴定中,溶液pH的突变是判断滴定终点的依据,了解指示剂的选择方法, 变化观念与平衡思想
知道酸碱中和滴定的主要仪器及用途,掌握酸碱中和滴定的实验操作、数据处理、误差分析及其在定量测定中的迁移应用 实验探究与创新意识
知道离子反应在生活生产中的应用 科学态度与社会责任
知识体系
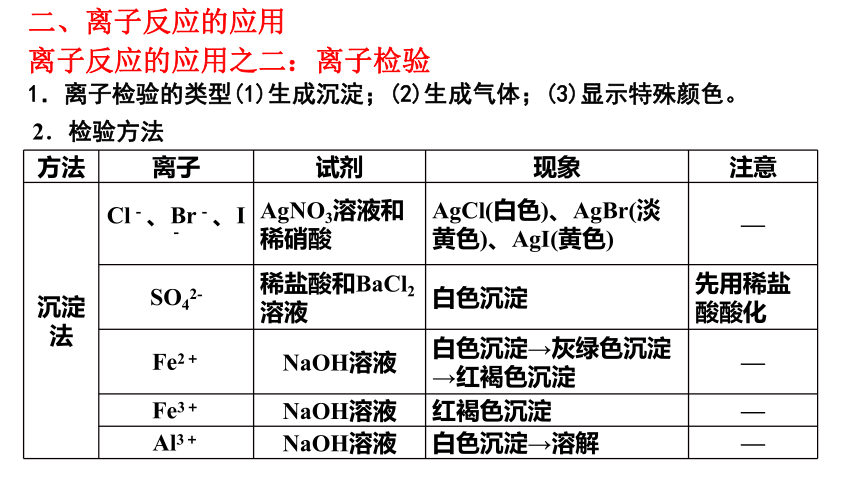
方法 离子 试剂 现象 注意
沉淀法 Cl-、Br-、I- AgNO3溶液和稀硝酸 AgCl(白色)、AgBr(淡黄色)、AgI(黄色) —
SO42- 稀盐酸和BaCl2溶液 白色沉淀 先用稀盐酸酸化
Fe2+ NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀 —
Fe3+ NaOH溶液 红褐色沉淀 —
Al3+ NaOH溶液 白色沉淀→溶解 —
2.检验方法
1.离子检验的类型(1)生成沉淀;(2)生成气体;(3)显示特殊颜色。
离子反应的应用之二:离子检验
二、离子反应的应用
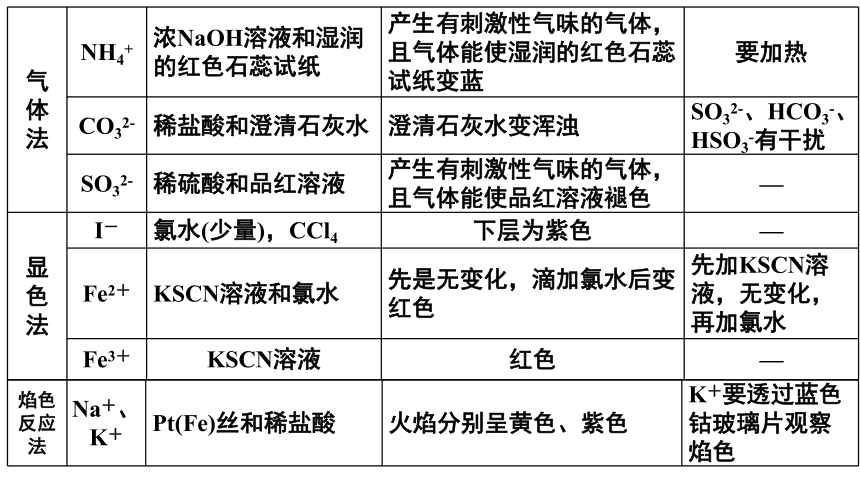
气 体 法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝 要加热
CO32- 稀盐酸和澄清石灰水 澄清石灰水变浑浊 SO32-、HCO3-、HSO3-有干扰
SO32- 稀硫酸和品红溶液 产生有刺激性气味的气体,且气体能使品红溶液褪色 —
显 色 法 I- 氯水(少量),CCl4 下层为紫色 —
Fe2+ KSCN溶液和氯水 先是无变化,滴加氯水后变红色 先加KSCN溶液,无变化,再加氯水
Fe3+ KSCN溶液 红色 —
焰色反应法 Na+、K+ Pt(Fe)丝和稀盐酸 火焰分别呈黄色、紫色 K+要透过蓝色钴玻璃片观察焰色
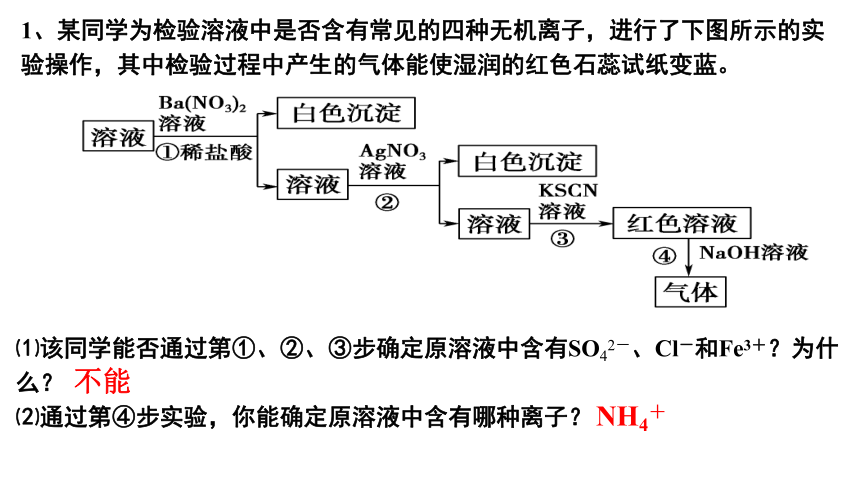
1、某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。
⑴该同学能否通过第①、②、③步确定原溶液中含有SO42-、Cl-和Fe3+?为什么?
⑵通过第④步实验,你能确定原溶液中含有哪种离子?
不能
NH4+
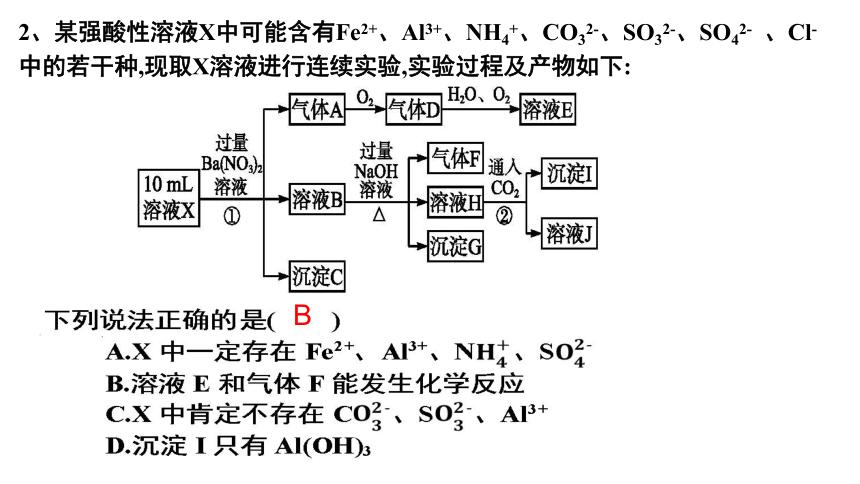
2、某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42- 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
B
3、离子反应是中学化学中重要的反应类型,回答下列问题:
Ⅰ.在发生离子反应的反应物或生成物中,一定存在有 (填序号)。
①单质;②氧化物;③电解质;④盐;⑤化合物
Ⅱ.有一瓶溶液只含Cl-、CO32-、SO42-、Na+、Mg2+、Cu2+六种离子中的某几种。通过实验:①原溶液中加足量NaOH溶液只产生白色沉淀;②原溶液中加BaCl2溶液不产生沉淀;③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
(1)试分析原溶液中一定含有的离子是_ _ _,一定不含有的离子是 ,可能含有的离子是 。
(2)实验③说明原溶液中含有___。有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)___,理由是___。
溶液呈电中性,必须同时含有阴、阳离子
③⑤
Mg2+、Cl-
Cu2+、CO32-、SO42-
Na+
Cl-
是
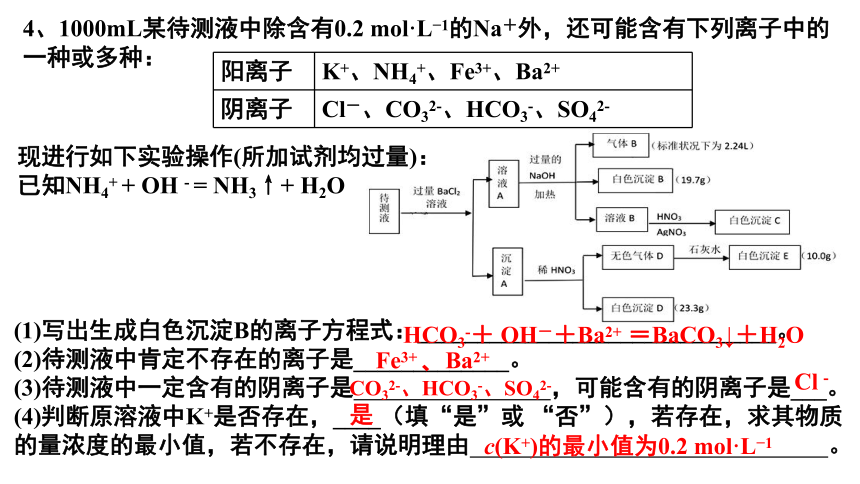
4、1000mL某待测液中除含有0.2 mol·L 1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 K+、NH4+、Fe3+、Ba2+
阴离子 Cl-、CO32-、HCO3-、SO42-
现进行如下实验操作(所加试剂均过量):
已知NH4+ + OH - = NH3↑+ H2O
(1)写出生成白色沉淀B的离子方程式:______________________________。
(2)待测液中肯定不存在的离子是_____________。
(3)待测液中一定含有的阴离子是 ,可能含有的阴离子是___。
(4)判断原溶液中K+是否存在,____(填“是”或 “否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由 。
HCO3-+ OH-+Ba2+ =BaCO3↓+H2O
Fe3+ 、Ba2+
CO32-、HCO3-、SO42-
Cl-
是
c(K+)的最小值为0.2 mol·L 1
1.物质的制备
(1)氯碱工业生产烧碱和氯气: 。
(2)实验室制取CO2发生的离子反应: 。
2.物质的纯化
(1)制高纯度的氯化钠:除去其中少量的 SO42-、Mg2+、Ca2+,需要的试剂及加入的正确顺序一般是 。
(2)除去污水中的重金属离子:用 将重金属离子转化为沉淀而除去,达到净水的目的。
NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
沉淀剂
离子反应的应用之三:物质制备与纯化
(3)从海水中提取CO2。
利用如图所示装置从海水中提取CO2,有利于减少温室气体含量。a室为阳极,发生氧化反应,电极反应为 ,
氢离子通过阳离子交换膜进入b室,发生反应: ,
达到从b室中提取CO2的目的,c室是阴极,电极反应为 ,得到的气体是氢气,得到的溶液中含有NaOH,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH。
2.硬水的形成及软化
(1)硬水:自然界里含有 较多的水。
(2)硬水的形成(暂时硬水)。
水中的二氧化碳与岩石中的碳酸钙和碳酸镁发生反应生成碳酸氢盐,使Ca2+、Mg2+进入水中而形成,主要反应的离子方程式为:
。
Ca2+、Mg2+
离子反应的应用之四:生活中常见的离子反应
1.胃酸过多的治疗
(1)服用小苏打片:反应的离子方程式为 。
(2)服用胃舒平:反应的离子方程式为 。
(3)硬水的软化。
①加热法:加热可以使 HCO3-分解,生成的CO32-与Mg2+、Ca2+结合成沉淀,从而降低这种硬水的Ca2+、Mg2+浓度,起到软化硬水的作用。
②沉淀法:在硬水中加入Na2CO3等沉淀剂也可以降低其中Mg2+、Ca2+浓度,起到软化硬水的作用。
三、化学平衡常数、水的离子积、电离平衡常数及溶度积的比较
5、化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数。下列关于这些常数的说法正确的是( )
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
D
6、5 ℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是( )
A.HB的酸性强于HA
B.a点溶液的导电性大于b点溶液
C.同浓度的NaA与NaB溶液中,c平(A-)=c平(B-)
D.加水稀释到pH相同时,酸HA、HB用到的水
的体积V(A)小于V(B)
四、电解质溶液中的常见图像题
D
(1)相同体积、相同浓度的盐酸、醋酸溶液稀释时的图像
1、酸、碱溶液稀释的图像
分别加水稀释到体积为原来相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸中加入的水多
(2)相同体积、相同pH的盐酸、醋酸溶液稀释时的图像
分别加水稀释到体积为原来相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸中加入的水多
解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、恰好反应点、中性点、反应一半点和过量点,先判断出各个点对应的溶质及溶液的酸碱性,然后再进行相关的分析和判断。下面以室温时用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HA溶液为例(如图),总结如何抓住滴定曲线的5个关键点:
2.酸、碱中和滴定的图像
关键点 离子浓度的关系
点① 起点 起点为HA的单一溶液,0.1 mol·L-1 HA溶液的pH>1说明HA是弱酸;溶液中c平(HA)>c平(H+)>c平(A-)>c平(OH-)
点② 反应一半点 点②溶液是等物质的量的NaA和HA的混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,
溶液中c平(A-)>c平(Na+)>c平(HA)>c平(H+)>c平(OH-)
点③ 中性点 此时溶液的pH=7,溶液呈中性,酸没有完全被中和,
此时溶液中c平(Na+)=c平(A-)>c平(HA)>c平(H+)=c平(OH-)
点④ 恰好完全 反应点 此时二者恰好完全反应生成NaA,NaA为强碱弱酸盐,溶液呈碱性,
c平(Na+)>c平(A-)>c平(OH-)>c平(HA)>c平(H+)
点⑤ 过量点 此时,NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,溶液显碱性,溶液中c平(Na+)>c平(OH-)>c平(A-)>c平(H+)
7、25 ℃时,将pH均为2的盐酸与HX溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.a、b两点:c平(X-)B.溶液的导电性:a>b
C.稀释前,c平(HX)>0.01 mol·L-1
D.溶液体积稀释到原来的10倍,HX溶
液的pH<3
AB
规律总结
(1)电中性原则。电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,也就是所谓的电荷守恒规律。
(2)物料守恒原则。电解质溶液中由于电离或水解因素,离子会发生变化,变成其他离子或分子等,离子种类增多了,但离子或分子中某种特定元素的原子总数是不会改变的。物料守恒的另外一种重要形式是水电离出的H+的浓度与水电离出的OH-浓度相等(即质子守恒)。
(3)电离程度小原则。该原则主要是指弱酸、弱碱溶液的电离程度小,产生的离子浓度也就小。适用弱电解质的溶液中离子浓度大小比较的题型。
(4)水解程度小原则。该原则主要是指含一种弱酸酸根离子或弱碱阳离子的盐溶液水解程度一般很小,水解产生的离子浓度一般较小,此原则适用于含一种弱酸酸根离子或弱碱阳离子的盐溶液中离子浓度大小比较的题型。
(5)以电离为主原则。该原则是指一元弱酸(HA)与该弱酸的强碱盐(NaA)等体积等浓度混合时,因HA的电离程度大于A-的水解程度,溶液呈酸性。
(6)以水解为主原则。当某弱酸很弱,该弱酸与其强碱盐等体积等浓度混合时,以水解为主,溶液显碱性。也指除NaHSO3、NaH2PO4、NaHC2O4等以外的多元弱酸强碱的酸式盐以水解为主,溶液显碱性。
(7)物料、电荷守恒结合原则。该原则是指同时运用电荷守恒、物料守恒比较溶液中复杂的离子、分子浓度关系的题型。可通过两守恒式加减得新的关系式。
第3章 物质在水溶液中的行为
第4节 离子反应
第3课时 离子反应的应用2
学习目标 核心素养培养
了解酸碱中和滴定的原理,知道酸碱中和滴定中,溶液pH的突变是判断滴定终点的依据,了解指示剂的选择方法, 变化观念与平衡思想
知道酸碱中和滴定的主要仪器及用途,掌握酸碱中和滴定的实验操作、数据处理、误差分析及其在定量测定中的迁移应用 实验探究与创新意识
知道离子反应在生活生产中的应用 科学态度与社会责任
知识体系
方法 离子 试剂 现象 注意
沉淀法 Cl-、Br-、I- AgNO3溶液和稀硝酸 AgCl(白色)、AgBr(淡黄色)、AgI(黄色) —
SO42- 稀盐酸和BaCl2溶液 白色沉淀 先用稀盐酸酸化
Fe2+ NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀 —
Fe3+ NaOH溶液 红褐色沉淀 —
Al3+ NaOH溶液 白色沉淀→溶解 —
2.检验方法
1.离子检验的类型(1)生成沉淀;(2)生成气体;(3)显示特殊颜色。
离子反应的应用之二:离子检验
二、离子反应的应用
气 体 法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝 要加热
CO32- 稀盐酸和澄清石灰水 澄清石灰水变浑浊 SO32-、HCO3-、HSO3-有干扰
SO32- 稀硫酸和品红溶液 产生有刺激性气味的气体,且气体能使品红溶液褪色 —
显 色 法 I- 氯水(少量),CCl4 下层为紫色 —
Fe2+ KSCN溶液和氯水 先是无变化,滴加氯水后变红色 先加KSCN溶液,无变化,再加氯水
Fe3+ KSCN溶液 红色 —
焰色反应法 Na+、K+ Pt(Fe)丝和稀盐酸 火焰分别呈黄色、紫色 K+要透过蓝色钴玻璃片观察焰色
1、某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。
⑴该同学能否通过第①、②、③步确定原溶液中含有SO42-、Cl-和Fe3+?为什么?
⑵通过第④步实验,你能确定原溶液中含有哪种离子?
不能
NH4+
2、某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42- 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
B
3、离子反应是中学化学中重要的反应类型,回答下列问题:
Ⅰ.在发生离子反应的反应物或生成物中,一定存在有 (填序号)。
①单质;②氧化物;③电解质;④盐;⑤化合物
Ⅱ.有一瓶溶液只含Cl-、CO32-、SO42-、Na+、Mg2+、Cu2+六种离子中的某几种。通过实验:①原溶液中加足量NaOH溶液只产生白色沉淀;②原溶液中加BaCl2溶液不产生沉淀;③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
(1)试分析原溶液中一定含有的离子是_ _ _,一定不含有的离子是 ,可能含有的离子是 。
(2)实验③说明原溶液中含有___。有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)___,理由是___。
溶液呈电中性,必须同时含有阴、阳离子
③⑤
Mg2+、Cl-
Cu2+、CO32-、SO42-
Na+
Cl-
是
4、1000mL某待测液中除含有0.2 mol·L 1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 K+、NH4+、Fe3+、Ba2+
阴离子 Cl-、CO32-、HCO3-、SO42-
现进行如下实验操作(所加试剂均过量):
已知NH4+ + OH - = NH3↑+ H2O
(1)写出生成白色沉淀B的离子方程式:______________________________。
(2)待测液中肯定不存在的离子是_____________。
(3)待测液中一定含有的阴离子是 ,可能含有的阴离子是___。
(4)判断原溶液中K+是否存在,____(填“是”或 “否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由 。
HCO3-+ OH-+Ba2+ =BaCO3↓+H2O
Fe3+ 、Ba2+
CO32-、HCO3-、SO42-
Cl-
是
c(K+)的最小值为0.2 mol·L 1
1.物质的制备
(1)氯碱工业生产烧碱和氯气: 。
(2)实验室制取CO2发生的离子反应: 。
2.物质的纯化
(1)制高纯度的氯化钠:除去其中少量的 SO42-、Mg2+、Ca2+,需要的试剂及加入的正确顺序一般是 。
(2)除去污水中的重金属离子:用 将重金属离子转化为沉淀而除去,达到净水的目的。
NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
沉淀剂
离子反应的应用之三:物质制备与纯化
(3)从海水中提取CO2。
利用如图所示装置从海水中提取CO2,有利于减少温室气体含量。a室为阳极,发生氧化反应,电极反应为 ,
氢离子通过阳离子交换膜进入b室,发生反应: ,
达到从b室中提取CO2的目的,c室是阴极,电极反应为 ,得到的气体是氢气,得到的溶液中含有NaOH,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH。
2.硬水的形成及软化
(1)硬水:自然界里含有 较多的水。
(2)硬水的形成(暂时硬水)。
水中的二氧化碳与岩石中的碳酸钙和碳酸镁发生反应生成碳酸氢盐,使Ca2+、Mg2+进入水中而形成,主要反应的离子方程式为:
。
Ca2+、Mg2+
离子反应的应用之四:生活中常见的离子反应
1.胃酸过多的治疗
(1)服用小苏打片:反应的离子方程式为 。
(2)服用胃舒平:反应的离子方程式为 。
(3)硬水的软化。
①加热法:加热可以使 HCO3-分解,生成的CO32-与Mg2+、Ca2+结合成沉淀,从而降低这种硬水的Ca2+、Mg2+浓度,起到软化硬水的作用。
②沉淀法:在硬水中加入Na2CO3等沉淀剂也可以降低其中Mg2+、Ca2+浓度,起到软化硬水的作用。
三、化学平衡常数、水的离子积、电离平衡常数及溶度积的比较
5、化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数。下列关于这些常数的说法正确的是( )
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
D
6、5 ℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是( )
A.HB的酸性强于HA
B.a点溶液的导电性大于b点溶液
C.同浓度的NaA与NaB溶液中,c平(A-)=c平(B-)
D.加水稀释到pH相同时,酸HA、HB用到的水
的体积V(A)小于V(B)
四、电解质溶液中的常见图像题
D
(1)相同体积、相同浓度的盐酸、醋酸溶液稀释时的图像
1、酸、碱溶液稀释的图像
分别加水稀释到体积为原来相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸中加入的水多
(2)相同体积、相同pH的盐酸、醋酸溶液稀释时的图像
分别加水稀释到体积为原来相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸中加入的水多
解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、恰好反应点、中性点、反应一半点和过量点,先判断出各个点对应的溶质及溶液的酸碱性,然后再进行相关的分析和判断。下面以室温时用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HA溶液为例(如图),总结如何抓住滴定曲线的5个关键点:
2.酸、碱中和滴定的图像
关键点 离子浓度的关系
点① 起点 起点为HA的单一溶液,0.1 mol·L-1 HA溶液的pH>1说明HA是弱酸;溶液中c平(HA)>c平(H+)>c平(A-)>c平(OH-)
点② 反应一半点 点②溶液是等物质的量的NaA和HA的混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,
溶液中c平(A-)>c平(Na+)>c平(HA)>c平(H+)>c平(OH-)
点③ 中性点 此时溶液的pH=7,溶液呈中性,酸没有完全被中和,
此时溶液中c平(Na+)=c平(A-)>c平(HA)>c平(H+)=c平(OH-)
点④ 恰好完全 反应点 此时二者恰好完全反应生成NaA,NaA为强碱弱酸盐,溶液呈碱性,
c平(Na+)>c平(A-)>c平(OH-)>c平(HA)>c平(H+)
点⑤ 过量点 此时,NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,溶液显碱性,溶液中c平(Na+)>c平(OH-)>c平(A-)>c平(H+)
7、25 ℃时,将pH均为2的盐酸与HX溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.a、b两点:c平(X-)
C.稀释前,c平(HX)>0.01 mol·L-1
D.溶液体积稀释到原来的10倍,HX溶
液的pH<3
AB
规律总结
(1)电中性原则。电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,也就是所谓的电荷守恒规律。
(2)物料守恒原则。电解质溶液中由于电离或水解因素,离子会发生变化,变成其他离子或分子等,离子种类增多了,但离子或分子中某种特定元素的原子总数是不会改变的。物料守恒的另外一种重要形式是水电离出的H+的浓度与水电离出的OH-浓度相等(即质子守恒)。
(3)电离程度小原则。该原则主要是指弱酸、弱碱溶液的电离程度小,产生的离子浓度也就小。适用弱电解质的溶液中离子浓度大小比较的题型。
(4)水解程度小原则。该原则主要是指含一种弱酸酸根离子或弱碱阳离子的盐溶液水解程度一般很小,水解产生的离子浓度一般较小,此原则适用于含一种弱酸酸根离子或弱碱阳离子的盐溶液中离子浓度大小比较的题型。
(5)以电离为主原则。该原则是指一元弱酸(HA)与该弱酸的强碱盐(NaA)等体积等浓度混合时,因HA的电离程度大于A-的水解程度,溶液呈酸性。
(6)以水解为主原则。当某弱酸很弱,该弱酸与其强碱盐等体积等浓度混合时,以水解为主,溶液显碱性。也指除NaHSO3、NaH2PO4、NaHC2O4等以外的多元弱酸强碱的酸式盐以水解为主,溶液显碱性。
(7)物料、电荷守恒结合原则。该原则是指同时运用电荷守恒、物料守恒比较溶液中复杂的离子、分子浓度关系的题型。可通过两守恒式加减得新的关系式。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
