化学人教版九上讲义:第11讲 化学方程式(含答案)
文档属性
| 名称 | 化学人教版九上讲义:第11讲 化学方程式(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 234.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 20:41:57 | ||
图片预览




文档简介
化学方程式
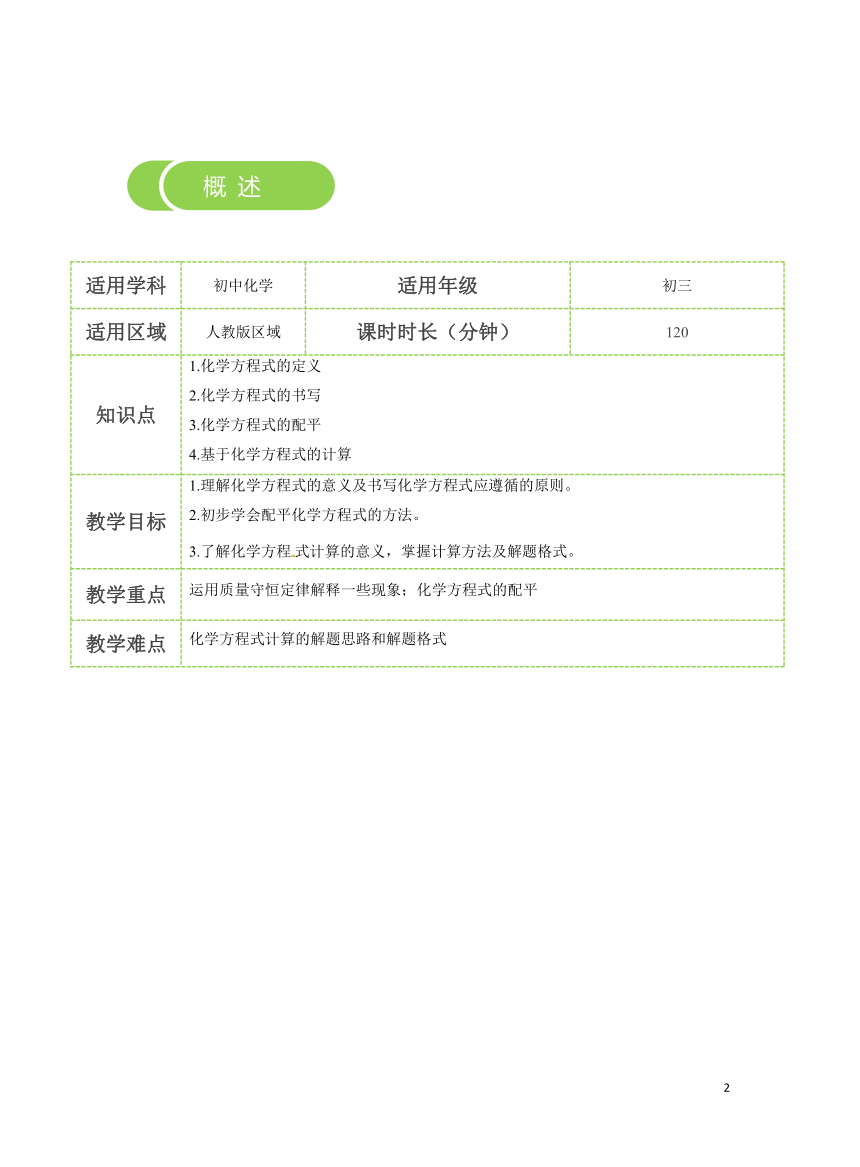
适用学科 初中化学 适用年级 初三
适用区域 人教版区域 课时时长(分钟) 120
知识点 1.化学方程式的定义 2.化学方程式的书写 3.化学方程式的配平 4.基于化学方程式的计算
教学目标 1.理解化学方程式的意义及书写化学方程式应遵循的原则。 2.初步学会配平化学方程式的方法。 3.了解化学方程式计算的意义,掌握计算方法及解题格式。
教学重点 运用质量守恒定律解释一些现象;化学方程式的配平
教学难点 化学方程式计算的解题思路和解题格式
1、质量守恒定律
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
这个规律就叫做质量守恒定律。
2、质量守恒的原因:从微观上看,在化学反应前后,原子的种类、数目、质量不变。
小结:化学反应前后。
一定不变——(宏观)反应物和生成物的总质量、元素的种类和质量;
一定不变——(微观)原子的种类、数目、质量;
一定改变——(宏观)物质的种类;
一定改变——(微观)分子的种类;
可能改变——分子总数。
使用建议说明:化学方程式的定义和书写时初三学生最头疼的部分,尤其是关于化学方程式的所表示的相关概念的理解部分。对于化学方程式,建议在理解反应变化的实质后,加强对于化学反应方程式的记忆和背诵。
1、化学方程式的定义:用化学式来表示化学反应的式子。
2、化学方程式提供的信息(意义)
(1)哪些物质参加了反应(反应物是什么)
(2)生成了哪些物质(生成物是什么)
(3)反应条件
(4)反应物与生成物之间的质量比
(5)反应物与生成物之间的粒子数量比
3、化学方程式的读法(以C + O2 CO2为例)
(1)物质:碳和氧气在点燃的条件下反应生成二氧化碳
(2)质量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳
(3)粒子:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子
使用建议说明:化学方程式的书写中,文字表达式的书写是学生比较熟悉的内容,但是联系到化学式的表达时,学生的问题普遍较大,尤其是化学方程式的配平等内容。注意的方面有两个,其一化学式的书写,其二方程式的配平。
1、书写原则:(1)以客观事实为基础;(2)要遵守质量守恒定律
2、书写步骤
(1)写:根据事实写出反应物和生成物的化学式,中间用短横线相连
(2)配:配平化学方程式
(3)改;将短横线改为等号
(4)注:注明反应条件以及生成物的状态“↑”或“↓”
(5)查:检查化学式是否写错.是否配平.条件和生成物状态是否标了,标了是否恰当
3、书写化学方程式的“四要四不”
(1)要以事实为依据,不能臆造
(2)要分清反应物和生成物,不能将反应物和生成物“调位”
(3)要遵循质量守恒定律,不能忘记配平
(4)要正确使用“↑” “↓” “Δ”等符号,不能忽视反应条件,值得注意的是,只有当反应物为固态或液态物质。生成物中有气态物质时,一般才可用“↑”标明。“Δ”符号表示加热而不是点燃
使用建议说明:此部分内容是中考化学必考点,尤其是建立在质量守恒定律的基础上的考查,而且考察的形式新颖,技巧性很强。可以多给学生归纳总结题型逐一解决问题。
1、最小公倍数法
方法:①找出化学方程式左.右两边各出现一次,且原子个数既不相等又相对较多的元素,求出最小公倍数。
②用最小公倍数分别除以含有该元素的原子个数,其商就是化学式前的化学计量数。
③由已有的化学计量数,确定其他化学式的化学计量数。
2、奇数配偶法
方法:找出式子左右两边出现次数较多(三次以上)的元素,观察该元素的原子的总数在式子两端是否为一奇一偶,若是,则变奇数为偶数
3、设“1”法
方法:符合下列特点的反应采用此方法,配平时只要按C →H →O 顺序用最小公倍数法依次配平即可。
具体配平步骤:
将化学方程式中最复杂的化学式的化学计量数定为1,作为配平起点;
根据原子守恒确定其他物质的化学计量数(可为分数);
(3)去分母,使配平后的化学计量数为整数。
例:配平C2H2 + O2 → CO2 + H2O
第一步:配平化合物中的碳原子和氢原子 C2H2 + O2 → 2CO2 + H2O
第二步:利用分数配平氧原子 C2H2 + O2 → 2CO2 + H2O
第三步:去分母,即全部乘2。得配平的化学方程式: 2C2H2 + 5O2 4CO2 + 2H2O
使用建议说明:基于化学方程式的计算,有简单有复杂题型。复杂题型常见于含有杂质的类型。需要学生进行整体分析。
1、解题步骤及格式(步骤:解、设、写、找、列、算、答)
一般分为以下七步:
(1)解设未知量,一般情况下,求什么设什么
(2)写出相应的正确的化学方程式
(3)根据化学方程式找出相关物质的相对分子质量,列在相应的化学式下面
(4)标出已知量和未知量
(5)列比例式
(6)求解
(7)答题
2、计算中常用的关系式
(1)m= ρv
(2)单位换算:1L=1000mL,1mL=1cm3
(3)物质的纯度=
变型:纯物质的质量=不纯物质的质量×物质的纯度
不纯物质的质量=
(4)物质的纯度(纯物质的质量分数)=1 - 杂质的质量分数
3、常见的计算类型
(1)利用化学方程式的简单计算;
(2)有关含杂质物质的化学方程式的计算;
(3)质量守恒定律结合化学方程式的综合计算。
使用建议说明:此处内容主要用于教师课堂的精讲,每个题目结合试题本身、答案和解析部分,教师有的放矢的进行讲授或与学生互动练习。
化学方程式不能表示的是( )
A、反应条件 B、反应物和生成物 C、反应的快慢 D、各物质的质量比
【答案】C
【解析】分析:从化学方程式获得的信息主要有:反应物、生成物、反应条件、各物质间质量的关系,据此结合题意进行分析判断。A、由化学式方程式可以表明该反应的反应条件,故选项不符合题意;B、由化学式方程式可以确定该反应的反应物、生成物,故选项不符合题意;C、根据化学方程式不能判断化学反应的快慢,故选项符合题意;D、由化学式方程式可以表示参加反应的物质与生成物的物之间的质量比,故选项不符合题。
化学方程式是表示化学变化的化学用语,关于化学方程式3Fe+2O2 Fe3O4的说法错误的是( )
A、反应物都是单质 B、生成物属于一种混合物
C、属于氧化反应 D、反应后固体物质质量增加
【答案】B
【解析】分析:该反应属于化学反应基本类型之一的化合反应;本题涉及到物质的分类;质量守恒定律的应用和理解。A、其中反应物为铁和氧气属于单质,故A正确;B、生成物属于一种纯净物,而非混合物,故B错误;C、该过程是物质与氧发生的反应,是氧化反应,故C正确;D、反应后固体的质量在原有固体质量的基础上增加了氧气的质量,故D正确。
如图,四位同学正在讨论某一个化学方程式表示的意义,根据他们描述的内容,试判断他们所指的化学方程式是( )
A、S+O2SO2 B、2CO+O2 2CO2
C、2H2+O2 H2O D、CH4+2O2 CO2+2H2O
【答案】C
【解析】从给出的限制中可以得到如下信息:是化合反应,且反应物与生成物的质量关系是1:8:9,分子个数比为2:1:2,反应条件为点燃的反应。
A、硫燃烧的反应的分子个数比不是2:1:2
B、一氧化碳燃烧的反应,物质的质量比不是1:8:9
C、氢气燃烧的反应满足以上要求
D、甲烷燃烧不是化合反应
对于化学反应2X+Y═2Z的叙述,不正确的是( )
A、Z一定是化合物,并且可能是氧化物
B、在反应中X、Y、Z三种物质的粒子数目比为2:1:2
C、若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
D、反应属于化合反应类型
【答案】C
【解析】分析:化学方程式可以表达的含义包括反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等。
A、Z一定是化合物,并且可能是氧化物,正确;
B、在反应中X.Y.Z三种物质的粒子数目比为2:1:2,正确;
C、若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为(2M+N)÷2,不正确;
D、反应属于化合反应类型,正确。
右图是密闭体系中某反应的微观示意图,若用“○”和“●”表示不同的原子,则
(1)依据质量守恒定律,反应后方框内应再填入一个_________粒子(填序号);
(2)该反应中的物质属于单质的有_________(填序号);
(3)符合该微观示意图的一个具体反应的化学方程式为________________________。
【答案】(1)C (2)AB (3)2H2+O2= 2H2O
【解析】分析:这是一道以图示的形式从微观角度考察质量守恒的试题,具有一定的开放性。化学反应质量守恒是因为在反应前后原子的种类、原子的数目、原子的质量没有变化,变化的是分子的种类,解题时可以从上述方面进行叙述。微观角度认识物质的组成和物质的化学变化是解答本题的关键,看懂示意图是解题前提。看图时要注意分子的种类、原子的种类、分子的变化、原子的组合等情况。
(1)根据质量守恒定律,填入一个C微粒后正好遵循质量守恒定律。
(2)该反应中,反应物是两种,都有同种元素组成,属于单质。
(3)氢气燃烧的化学方程式符合该反应类型,故填:2H2+O22H2O
写出下列反应的文字表达式:
(1)铁丝在氧气中燃烧:_______________________________________;
(2)水通电分解:_______________________________________;
(3)木炭燃烧:_______________________________________ ;
(4)红磷燃烧:_______________________________________.
【答案】(1)铁+氧气四氧化三铁;(2)水氢气+氧气;(3)碳+氧气二氧化碳;(4)磷+氧气五氧化二磷。
【解析】(1)铁丝在氧气中燃烧生成四氧化三铁,反应的文字表达式为:铁+氧气四氧化三铁;
(2)水在通电条件下分解生成氢气和氧气,反应的文字表达式为:水氢气+氧气;
(3)木炭燃烧生成二氧化碳,反应的文字表达式为:碳+氧气二氧化碳;
(4)红磷燃烧生成五氧化二磷,反应的文字表达式为:磷+氧气五氧化二磷。
使用建议说明:在对课堂知识讲解完,把握了重点突破了难点以及练习精讲了之后,再用练习马上进行课堂检测,根据学生情况建议分3个难度层次:易,中,难。
1、化学方程式是重要的化学用语.下列化学方程式书写正确的是( )
A、Mg+O2=MgO2 B、Cu+2HCl=CuCl2+H2↑
C、NaOH+KCl=NaCl+KOH D、3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
2、判断下列化学方程式中,属于分解反应的是( )
A、H2SO4+2NaOH═Na2SO4+2H2O B、2H2O2H2↑+O2↑
C、2CO+O22CO2 D、Fe+CuSO4═FeSO4+Cu
3、用稀盐酸除去铁锈主要成分的原理是( )
A、FeO+2HCl═FeCl2+H2O B、FeO+2HCl═FeCl3+H2O
C、Fe2O3+6HCl═2FeCl2+3H2O D、Fe2O3+6HCl═2FeCl3+3H2O
【答案】
1、D 2、B 3、D
【解析】
A选项违背了客观事实,生成氧化镁不是过氧化镁;B选项违背了客观事实,金属铜不能与稀盐酸
反应;C选项是错误的叙述,氢氧化钠与氯化钾不反应,生成物不符合复分解反应的条件;D选项是正确的表示;故答案选D
A、H2SO4+2NaOH═Na2SO4+2H2O,该反应是两种化合物相互交换成分生成两种新的化合物的反应,
属于复分解反应,故选项错误;
B、2H2O2H2↑+O2↑,该反应符合“一变多”的特征,属于分解反应,故选项正确;
C、2CO+O22CO2,该反应符合“多变一”的特征,属于化合反应,故选项错误;
Fe+CuSO4═FeSO4+Cu,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反
应,属于置换反应,故选项错误;
故答案选B。
3、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═ 2FeCl3
+3H2O故答案选D。
4、“纳米材料”特指粒径在lnm-100nm(1nm=10-9m)的颗粒,纳米材料和纳米技术的应用几乎涉及现代工业的各个领域.用纳米级的某种氧化物作催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体.这两种气体是 _________ ,写出CO与NO反应的化学方程式 _______________________________________
5、下列关于化学反应“X2十3Y2=2Z”的叙述错误的是( )
A、Z的化学式为XY3
B、若mgX2和ngY2恰好完全反应,则生成(m+n)gZ
C、若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
D、若ag X2完全反应生成bg Z,则同时消耗(b-a)g Y2
6、根据碳在氧气中燃烧的化学方程式判断,下列说法正确的是( )
A、3gC和8gO2生成11gCO2
B、2gC和4gO2生成6gCO2
C、4gC和5gO2生成9gCO2
D、5gC和9gO2生成14gCO2
7、(1)完成下列反应的方程式,并注明反应的基本类型。
①铁丝在氧气中燃烧__________________________________;
②加热氯酸钾和二氧化锰混合物制氧气__________________________________;
(2)在下列物质中:
①过氧化氢 ②氯化钾 ③二氧化硫 ④空气
含有氧分子的是________(填序号,下同)含有氧元素的有________,不是纯净物的是________,属于氧化物的是________。
8、配平下列化学方程式(化学计量数为“1”也要填入“ ”内)
(1) NaOH + H2SO4 ═ Na2SO4+ H2O;
(2) Fe2O3 + C 高温 Fe+ CO2↑;
(3) C2H4 + O2 = H2O+ CO2.
【答案】
4、(1)CO2、N2,2CO+2NO2CO2+N2。
5、C 。
6、A 。
7、(1)①3Fe+2O2=点燃=Fe3O4;化合反应;②2KClO32KCl+3O2↑;分解反应;(2)④;①③④;④;①③。
8、(1)2、1、1、2;(2)2、3、4、3;(3)1、3、2、2。
【解析】
4、由题意可知:汽车尾气中的CO跟NO反应转化成两种气体,其中一种可参与植物的光合作用,另
一种是空气中含量最多的气体。所以这两种气体是因而CO与NO反应的化学方程式为2CO+2NO2CO2+N2。
5、A、化学反应前后原子的个数不变,正确;
B、参加反应的物质的质量总和等于生成物的质量总和,正确;
C、若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+3N),不正确;
D、若agX2完全反应生成bgZ,则同时消耗(b-a)gY2,正确。
6、根据题干信息可知,碳在完全燃烧时,生成二氧化碳.由它们反应的化学方程式各种物质的比例关系应用于质量守恒定律判断选项正误.由化学方程式C + O2 CO2能够可知:每有12份质量的碳和32份质量的氧在点燃的条件下完全化合生成44份质量的二氧化碳.即参加反应的碳、氧气和生成的二氧化碳质量之比=3:8:11;
A、由3gC和8gO2恰好完全反应,根据质量守恒定律可知生成11gCO2,故A正确;
B、由于2g碳与4g氧气反应时,碳过量,所以生成二氧化碳质量不能直接相加,故B错误;
C、由于4g碳与5g氧气反应时,碳过量,所以生成二氧化碳质量不能直接相加,故C错误;
D、由于5g碳与9g氧气反应时,碳过量,所以生成二氧化碳质量不能直接相加,故D错误。
7、(1)①铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2Fe3O4;该反应符合“多变一”的特征,属于化合反应。
②氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO32KCl+3O2↑;该反应符合“一变多”的特征,属于分解反应.
(2)④空气中含有氧气,氧气是由氧分子构成的,则空气中含有氧分子;①过氧化氢,③二氧化硫中均含有氧元素,④空气中含有氧气,氧气是由氧元素组成的。④空气中含有氮气、氧气、二氧化碳等多种物质,属于混合物。①过氧化氢,③二氧化硫均是由两种元素组成且有一种是氧元素,均属于氧化物。
8、根据化学方程式配平的标志:反应前后各原子的数目相等,可将上述方程式配平。
(1)本题可利用“定一法”进行配平,把Na2SO4的计量数定为1,则NaOH、H2SO4、H2O前面的化学
计量数分别为:2、1、2。
(2)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe2O3、CO2前面的化学计量数分别为:
2、3,最后调整C、Fe前面的化学计量数为3、4。
(3)本题可利用“定一法”进行配平,把C2H4的计量数定为1,则O2、H2O、CO2前面的化学计量数分
别为:3、2、2。
铁酸钠是污水处理过程中使用的一种新型净水剂,制取铁酸钠(M)的化学方程式如下:
2Fe(NO3)3+16NaOH+3C12═2M+6NaNO3+6NaCl+8H2O则M的化学式为( )
A、Na2Fe2O8 B、NaFeO4 C、Fe2NaO4 D、Na2FeO4
10、如图是某化学反应的微观示意图.请结合图示回答下列问题:
(1)产物C.D中,属于单质的是_____。
(2)该反应属于_____反应(填基本反应类型)。
(3)在该反应的化学方程式中,A.C的计量数(即化学方程式中的系数)之比为_____。
11、24g碳在80g氧气中充分燃烧,生成二氧化碳的质量为( )
A、88g B、72g C、104g D、110g
【答案】
9、D
10、C;置换;2:1
11、A
【解析】
9、根据原子在化学反应前后种类与数目均不变可得:反应前有2个铁原子,反应后其他物质中无铁原子,故“2M中”含有2个铁原子,得M中含有1个铁原子;反应前有16个钠原子,反应后氯化钠中共含6个钠原子,硝酸钠中共含6个钠原子,故“2M中”含有16-6-6=4个钠原子,得M中含有2个钠原子;反应前有2×3×3+16=34个氧原子,反应后水中共含8个氧原子,硝酸钠中共含3×6=18个氧原子,故“2M中”含有34-8-18=8个氧原子,得M中含有4个氧原子,即其化学式为:Na2FeO4。
10、(1)产物C.D中,C是由同种元素组成的纯净物,属于单质。故填:C;
(2)A是由不同种元素组成的纯净物,属于化合物。B是由同种元素组成的纯净物,属于单质。C属
于单质。D是由不同种元素组成的纯净物,属于化合物。属于置换反应,故填置换。
(3)配平后ABCD的系数分别是2、3、1、6。A、C的计量数(即化学方程式中的系数)之比为2:
1。故填:2:1。
11、根据化学方程式由碳的质量可计算出生成二氧化碳的质量。碳与氧气反应时质量比是3:8,则可知反应时氧气有剩余。
设生成二氧化碳的质量为x,
C+O2 =点燃=CO2
12 44
24g x
12/44=24g/x,
x=88g
故选A。
使用建议说明:此处内容主要用于教师对本节课重点内容进行总结,一方面是对本节课的重点难点内容的回顾,更重要的是针对这节课学生出现的问题再次进行复习提问等,以达到让学生课上掌握的目的,同时可以对下节课内容进行简单的铺垫,以体现出本节课内容与下节课内容之间的关系。
1、化学方程式的书写;
2、化学方程式的配平;
3、基于化学方程式的计算;
使用建议说明:此处内容主要用于教师根据学生掌握情况有针对性的进行课后作业的布置,掌握好的同学可以适当的布置难度大一些的作业,成绩一般的同学可以以基础题和巩固题目为主,但是一定要控制作业的数量,给学生布置的作业一般不要超过5题,这样学生才能保证做题的质量。
1、在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥原子的种类
A、①③④⑤ B、①③④⑥ C、①④⑥ D、 ①③⑤
2、化学方程式3Fe + 2O2 Fe3O4可读作( )
A、铁加氧气等于四氧化三铁 B、三个铁加两个氧气等于一个四氧化三铁
C、铁和氧气点燃后生成四氧化三铁 D、铁加氧气点燃等于四氧化三铁
3、某物质在纯氧中燃烧生成了氮气和水蒸气,该物质一定含有( )
A、氮元素和氧元素 B、 氢元素和氧元素 C、 氮元素和碳元素 D、 氮元素和氢元素
4、下列化学方程式正确的是( )
A、 S + O2 SO2↑ B、4Al +3O2 2Al2O3
C、P + O2 PO2 D、 Mg + O2 MgO2
5、红磷在密闭容器(含有空气)内燃烧,容器内有关的量随时间变化的图象正确的是( )
【答案】
1、B 2、C 3、D 4、B 5、D
6、在化学反应X + 2Y ==== Z中,3g X和足量Y充分反应后生成8g Z,则参加反应的Y的质量为( )
A、2.5 g B、3 g C、 5 g D、 6 g
7、下列各式中,正确表示铝与稀硫酸反应的化学方程式是( )
A、Al + H2SO4 ==== AlSO4 + H2↑
B、2Al+ 3H2SO4 ==== Al2(SO4)3 + 3H2↑
C、 Al + 2H2SO4 ==== Al(SO4)2 + 2H2↑
D、 2Al + H2SO4 ==== Al2SO4 + H2↑
8、在2A+B == 2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为( )
A、 16 g B、 32 g C、16 D、32
9、下列说法能用质量守恒定律解释的是( )
A、mg水受热变为mg的水蒸气 B、62g磷和80g的氧反应生成142g五氧化二磷
C、20g食盐溶于80g水得到100g的食盐水 D、拧开盛酒精的瓶盖一段时间后质量变小
【答案】
6、C 7、B 8、D 9、B
距今两千多年前,我国劳动人民就已经掌握了炼铁的技术,他们将炭不完全燃烧,产生一氧化碳,在
高温条件下利用一氧化碳将铁矿石中的三氧化二铁还原为铁并同时生成了二氧化碳。请写出上述两个反应的化学方程式。
(1) ,此反应类型: 。
(2) 。
11、配平下列化学方程式。(化学计量数为1也要填入空白处)
(1) P + O2 点燃 P2O5
(2) Fe2O3 + C 高温 Fe + CO2↑
(3) KClO3 △ KCl + O2 ↑
(4) C2H4 + O2 点燃 H2O + CO2
12、我国采用食盐中加入碘酸钾的方法防止缺碘引起的疾病。
(1)在人体中,碘属于 (选填“常量”或“微量”)元素。
(2)碘酸钾(KIO3)中钾.碘.氧三种元素质量比为 ;它受热易分解,烹饪时,
添加碘食盐应注意 。
我国规定加碘食盐含碘量为20~50 mg/kg。为测定某加碘食盐是否为合格产品。在酸性条件下用
足量KI溶液将其中KIO3全部转化成I2。反应方程式为KIO3+5KI+6HCl6KCl+3I2+3H2O。称取1000 g 某品牌加碘盐样品进行测定,经测定反应获得的I2的质量为152.4 mg,试通过计算说明该加碘食盐是否为合格产品。
13、已知碳酸钙在高温下可分解生成氧化钙和二氧化碳。同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
反应时间∕s t0 t1 t2 t3 t4 t5 t6
反应后固体的质量∕g 80 75 70 66 62 58 58
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为__________;
(2)求该石灰石中含CaCO3的质量分数(写出计算过程)。
【答案】
10、(1) 2C +O2 点燃 2CO 化合反应
(2) 3CO + Fe2O3 高温 2Fe + 3CO2
11、(1) 4 P + 5 O2 点燃 2 P2O5
(2) 2 Fe2O3 + 3 C 高温 4 Fe + 3 CO2↑
(3) 2 KClO3 △ 2 KCl + 3 O2↑
(4) 1 C2H4 + 3 O2 点燃 2 H2O + 2 CO2
12、(1)微量 (2) 39︰127 ︰48 不宜过早加入
(3)解:设KIO3的质量为x。
KIO3 + 5KI + 6HCl6KCl + 3I2 + 3H2O
214 762
x 152.4 mg
x=42.8 mg
1000 g 加碘盐中的碘元素质量为42.8 mg25.4 mg。
因为20 mg/kg <25.4 mg/kg <50 mg/kg,所以该加碘盐合格。
答:略。
13、(1) 22g
(2)解:设样品中含CaCO3的质量为x
CaCO3高温 CaO + CO2 ↑
100 44
x 22g
=
x = =50g
样品中的质量分数=×100%=62.5%
答:样品中CaCO3的质量分数为62.5%。
此处内容主要是针对教师在这节课上的比较成功的地方和比较失败的地方进行反思总结,同时也可以利用问卷星或调研表等对学生进行调研,以便于更好的总结和反思自己的教学。
1
适用学科 初中化学 适用年级 初三
适用区域 人教版区域 课时时长(分钟) 120
知识点 1.化学方程式的定义 2.化学方程式的书写 3.化学方程式的配平 4.基于化学方程式的计算
教学目标 1.理解化学方程式的意义及书写化学方程式应遵循的原则。 2.初步学会配平化学方程式的方法。 3.了解化学方程式计算的意义,掌握计算方法及解题格式。
教学重点 运用质量守恒定律解释一些现象;化学方程式的配平
教学难点 化学方程式计算的解题思路和解题格式
1、质量守恒定律
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
这个规律就叫做质量守恒定律。
2、质量守恒的原因:从微观上看,在化学反应前后,原子的种类、数目、质量不变。
小结:化学反应前后。
一定不变——(宏观)反应物和生成物的总质量、元素的种类和质量;
一定不变——(微观)原子的种类、数目、质量;
一定改变——(宏观)物质的种类;
一定改变——(微观)分子的种类;
可能改变——分子总数。
使用建议说明:化学方程式的定义和书写时初三学生最头疼的部分,尤其是关于化学方程式的所表示的相关概念的理解部分。对于化学方程式,建议在理解反应变化的实质后,加强对于化学反应方程式的记忆和背诵。
1、化学方程式的定义:用化学式来表示化学反应的式子。
2、化学方程式提供的信息(意义)
(1)哪些物质参加了反应(反应物是什么)
(2)生成了哪些物质(生成物是什么)
(3)反应条件
(4)反应物与生成物之间的质量比
(5)反应物与生成物之间的粒子数量比
3、化学方程式的读法(以C + O2 CO2为例)
(1)物质:碳和氧气在点燃的条件下反应生成二氧化碳
(2)质量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳
(3)粒子:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子
使用建议说明:化学方程式的书写中,文字表达式的书写是学生比较熟悉的内容,但是联系到化学式的表达时,学生的问题普遍较大,尤其是化学方程式的配平等内容。注意的方面有两个,其一化学式的书写,其二方程式的配平。
1、书写原则:(1)以客观事实为基础;(2)要遵守质量守恒定律
2、书写步骤
(1)写:根据事实写出反应物和生成物的化学式,中间用短横线相连
(2)配:配平化学方程式
(3)改;将短横线改为等号
(4)注:注明反应条件以及生成物的状态“↑”或“↓”
(5)查:检查化学式是否写错.是否配平.条件和生成物状态是否标了,标了是否恰当
3、书写化学方程式的“四要四不”
(1)要以事实为依据,不能臆造
(2)要分清反应物和生成物,不能将反应物和生成物“调位”
(3)要遵循质量守恒定律,不能忘记配平
(4)要正确使用“↑” “↓” “Δ”等符号,不能忽视反应条件,值得注意的是,只有当反应物为固态或液态物质。生成物中有气态物质时,一般才可用“↑”标明。“Δ”符号表示加热而不是点燃
使用建议说明:此部分内容是中考化学必考点,尤其是建立在质量守恒定律的基础上的考查,而且考察的形式新颖,技巧性很强。可以多给学生归纳总结题型逐一解决问题。
1、最小公倍数法
方法:①找出化学方程式左.右两边各出现一次,且原子个数既不相等又相对较多的元素,求出最小公倍数。
②用最小公倍数分别除以含有该元素的原子个数,其商就是化学式前的化学计量数。
③由已有的化学计量数,确定其他化学式的化学计量数。
2、奇数配偶法
方法:找出式子左右两边出现次数较多(三次以上)的元素,观察该元素的原子的总数在式子两端是否为一奇一偶,若是,则变奇数为偶数
3、设“1”法
方法:符合下列特点的反应采用此方法,配平时只要按C →H →O 顺序用最小公倍数法依次配平即可。
具体配平步骤:
将化学方程式中最复杂的化学式的化学计量数定为1,作为配平起点;
根据原子守恒确定其他物质的化学计量数(可为分数);
(3)去分母,使配平后的化学计量数为整数。
例:配平C2H2 + O2 → CO2 + H2O
第一步:配平化合物中的碳原子和氢原子 C2H2 + O2 → 2CO2 + H2O
第二步:利用分数配平氧原子 C2H2 + O2 → 2CO2 + H2O
第三步:去分母,即全部乘2。得配平的化学方程式: 2C2H2 + 5O2 4CO2 + 2H2O
使用建议说明:基于化学方程式的计算,有简单有复杂题型。复杂题型常见于含有杂质的类型。需要学生进行整体分析。
1、解题步骤及格式(步骤:解、设、写、找、列、算、答)
一般分为以下七步:
(1)解设未知量,一般情况下,求什么设什么
(2)写出相应的正确的化学方程式
(3)根据化学方程式找出相关物质的相对分子质量,列在相应的化学式下面
(4)标出已知量和未知量
(5)列比例式
(6)求解
(7)答题
2、计算中常用的关系式
(1)m= ρv
(2)单位换算:1L=1000mL,1mL=1cm3
(3)物质的纯度=
变型:纯物质的质量=不纯物质的质量×物质的纯度
不纯物质的质量=
(4)物质的纯度(纯物质的质量分数)=1 - 杂质的质量分数
3、常见的计算类型
(1)利用化学方程式的简单计算;
(2)有关含杂质物质的化学方程式的计算;
(3)质量守恒定律结合化学方程式的综合计算。
使用建议说明:此处内容主要用于教师课堂的精讲,每个题目结合试题本身、答案和解析部分,教师有的放矢的进行讲授或与学生互动练习。
化学方程式不能表示的是( )
A、反应条件 B、反应物和生成物 C、反应的快慢 D、各物质的质量比
【答案】C
【解析】分析:从化学方程式获得的信息主要有:反应物、生成物、反应条件、各物质间质量的关系,据此结合题意进行分析判断。A、由化学式方程式可以表明该反应的反应条件,故选项不符合题意;B、由化学式方程式可以确定该反应的反应物、生成物,故选项不符合题意;C、根据化学方程式不能判断化学反应的快慢,故选项符合题意;D、由化学式方程式可以表示参加反应的物质与生成物的物之间的质量比,故选项不符合题。
化学方程式是表示化学变化的化学用语,关于化学方程式3Fe+2O2 Fe3O4的说法错误的是( )
A、反应物都是单质 B、生成物属于一种混合物
C、属于氧化反应 D、反应后固体物质质量增加
【答案】B
【解析】分析:该反应属于化学反应基本类型之一的化合反应;本题涉及到物质的分类;质量守恒定律的应用和理解。A、其中反应物为铁和氧气属于单质,故A正确;B、生成物属于一种纯净物,而非混合物,故B错误;C、该过程是物质与氧发生的反应,是氧化反应,故C正确;D、反应后固体的质量在原有固体质量的基础上增加了氧气的质量,故D正确。
如图,四位同学正在讨论某一个化学方程式表示的意义,根据他们描述的内容,试判断他们所指的化学方程式是( )
A、S+O2SO2 B、2CO+O2 2CO2
C、2H2+O2 H2O D、CH4+2O2 CO2+2H2O
【答案】C
【解析】从给出的限制中可以得到如下信息:是化合反应,且反应物与生成物的质量关系是1:8:9,分子个数比为2:1:2,反应条件为点燃的反应。
A、硫燃烧的反应的分子个数比不是2:1:2
B、一氧化碳燃烧的反应,物质的质量比不是1:8:9
C、氢气燃烧的反应满足以上要求
D、甲烷燃烧不是化合反应
对于化学反应2X+Y═2Z的叙述,不正确的是( )
A、Z一定是化合物,并且可能是氧化物
B、在反应中X、Y、Z三种物质的粒子数目比为2:1:2
C、若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
D、反应属于化合反应类型
【答案】C
【解析】分析:化学方程式可以表达的含义包括反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等。
A、Z一定是化合物,并且可能是氧化物,正确;
B、在反应中X.Y.Z三种物质的粒子数目比为2:1:2,正确;
C、若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为(2M+N)÷2,不正确;
D、反应属于化合反应类型,正确。
右图是密闭体系中某反应的微观示意图,若用“○”和“●”表示不同的原子,则
(1)依据质量守恒定律,反应后方框内应再填入一个_________粒子(填序号);
(2)该反应中的物质属于单质的有_________(填序号);
(3)符合该微观示意图的一个具体反应的化学方程式为________________________。
【答案】(1)C (2)AB (3)2H2+O2= 2H2O
【解析】分析:这是一道以图示的形式从微观角度考察质量守恒的试题,具有一定的开放性。化学反应质量守恒是因为在反应前后原子的种类、原子的数目、原子的质量没有变化,变化的是分子的种类,解题时可以从上述方面进行叙述。微观角度认识物质的组成和物质的化学变化是解答本题的关键,看懂示意图是解题前提。看图时要注意分子的种类、原子的种类、分子的变化、原子的组合等情况。
(1)根据质量守恒定律,填入一个C微粒后正好遵循质量守恒定律。
(2)该反应中,反应物是两种,都有同种元素组成,属于单质。
(3)氢气燃烧的化学方程式符合该反应类型,故填:2H2+O22H2O
写出下列反应的文字表达式:
(1)铁丝在氧气中燃烧:_______________________________________;
(2)水通电分解:_______________________________________;
(3)木炭燃烧:_______________________________________ ;
(4)红磷燃烧:_______________________________________.
【答案】(1)铁+氧气四氧化三铁;(2)水氢气+氧气;(3)碳+氧气二氧化碳;(4)磷+氧气五氧化二磷。
【解析】(1)铁丝在氧气中燃烧生成四氧化三铁,反应的文字表达式为:铁+氧气四氧化三铁;
(2)水在通电条件下分解生成氢气和氧气,反应的文字表达式为:水氢气+氧气;
(3)木炭燃烧生成二氧化碳,反应的文字表达式为:碳+氧气二氧化碳;
(4)红磷燃烧生成五氧化二磷,反应的文字表达式为:磷+氧气五氧化二磷。
使用建议说明:在对课堂知识讲解完,把握了重点突破了难点以及练习精讲了之后,再用练习马上进行课堂检测,根据学生情况建议分3个难度层次:易,中,难。
1、化学方程式是重要的化学用语.下列化学方程式书写正确的是( )
A、Mg+O2=MgO2 B、Cu+2HCl=CuCl2+H2↑
C、NaOH+KCl=NaCl+KOH D、3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
2、判断下列化学方程式中,属于分解反应的是( )
A、H2SO4+2NaOH═Na2SO4+2H2O B、2H2O2H2↑+O2↑
C、2CO+O22CO2 D、Fe+CuSO4═FeSO4+Cu
3、用稀盐酸除去铁锈主要成分的原理是( )
A、FeO+2HCl═FeCl2+H2O B、FeO+2HCl═FeCl3+H2O
C、Fe2O3+6HCl═2FeCl2+3H2O D、Fe2O3+6HCl═2FeCl3+3H2O
【答案】
1、D 2、B 3、D
【解析】
A选项违背了客观事实,生成氧化镁不是过氧化镁;B选项违背了客观事实,金属铜不能与稀盐酸
反应;C选项是错误的叙述,氢氧化钠与氯化钾不反应,生成物不符合复分解反应的条件;D选项是正确的表示;故答案选D
A、H2SO4+2NaOH═Na2SO4+2H2O,该反应是两种化合物相互交换成分生成两种新的化合物的反应,
属于复分解反应,故选项错误;
B、2H2O2H2↑+O2↑,该反应符合“一变多”的特征,属于分解反应,故选项正确;
C、2CO+O22CO2,该反应符合“多变一”的特征,属于化合反应,故选项错误;
Fe+CuSO4═FeSO4+Cu,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反
应,属于置换反应,故选项错误;
故答案选B。
3、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═ 2FeCl3
+3H2O故答案选D。
4、“纳米材料”特指粒径在lnm-100nm(1nm=10-9m)的颗粒,纳米材料和纳米技术的应用几乎涉及现代工业的各个领域.用纳米级的某种氧化物作催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体.这两种气体是 _________ ,写出CO与NO反应的化学方程式 _______________________________________
5、下列关于化学反应“X2十3Y2=2Z”的叙述错误的是( )
A、Z的化学式为XY3
B、若mgX2和ngY2恰好完全反应,则生成(m+n)gZ
C、若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
D、若ag X2完全反应生成bg Z,则同时消耗(b-a)g Y2
6、根据碳在氧气中燃烧的化学方程式判断,下列说法正确的是( )
A、3gC和8gO2生成11gCO2
B、2gC和4gO2生成6gCO2
C、4gC和5gO2生成9gCO2
D、5gC和9gO2生成14gCO2
7、(1)完成下列反应的方程式,并注明反应的基本类型。
①铁丝在氧气中燃烧__________________________________;
②加热氯酸钾和二氧化锰混合物制氧气__________________________________;
(2)在下列物质中:
①过氧化氢 ②氯化钾 ③二氧化硫 ④空气
含有氧分子的是________(填序号,下同)含有氧元素的有________,不是纯净物的是________,属于氧化物的是________。
8、配平下列化学方程式(化学计量数为“1”也要填入“ ”内)
(1) NaOH + H2SO4 ═ Na2SO4+ H2O;
(2) Fe2O3 + C 高温 Fe+ CO2↑;
(3) C2H4 + O2 = H2O+ CO2.
【答案】
4、(1)CO2、N2,2CO+2NO2CO2+N2。
5、C 。
6、A 。
7、(1)①3Fe+2O2=点燃=Fe3O4;化合反应;②2KClO32KCl+3O2↑;分解反应;(2)④;①③④;④;①③。
8、(1)2、1、1、2;(2)2、3、4、3;(3)1、3、2、2。
【解析】
4、由题意可知:汽车尾气中的CO跟NO反应转化成两种气体,其中一种可参与植物的光合作用,另
一种是空气中含量最多的气体。所以这两种气体是因而CO与NO反应的化学方程式为2CO+2NO2CO2+N2。
5、A、化学反应前后原子的个数不变,正确;
B、参加反应的物质的质量总和等于生成物的质量总和,正确;
C、若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+3N),不正确;
D、若agX2完全反应生成bgZ,则同时消耗(b-a)gY2,正确。
6、根据题干信息可知,碳在完全燃烧时,生成二氧化碳.由它们反应的化学方程式各种物质的比例关系应用于质量守恒定律判断选项正误.由化学方程式C + O2 CO2能够可知:每有12份质量的碳和32份质量的氧在点燃的条件下完全化合生成44份质量的二氧化碳.即参加反应的碳、氧气和生成的二氧化碳质量之比=3:8:11;
A、由3gC和8gO2恰好完全反应,根据质量守恒定律可知生成11gCO2,故A正确;
B、由于2g碳与4g氧气反应时,碳过量,所以生成二氧化碳质量不能直接相加,故B错误;
C、由于4g碳与5g氧气反应时,碳过量,所以生成二氧化碳质量不能直接相加,故C错误;
D、由于5g碳与9g氧气反应时,碳过量,所以生成二氧化碳质量不能直接相加,故D错误。
7、(1)①铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2Fe3O4;该反应符合“多变一”的特征,属于化合反应。
②氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO32KCl+3O2↑;该反应符合“一变多”的特征,属于分解反应.
(2)④空气中含有氧气,氧气是由氧分子构成的,则空气中含有氧分子;①过氧化氢,③二氧化硫中均含有氧元素,④空气中含有氧气,氧气是由氧元素组成的。④空气中含有氮气、氧气、二氧化碳等多种物质,属于混合物。①过氧化氢,③二氧化硫均是由两种元素组成且有一种是氧元素,均属于氧化物。
8、根据化学方程式配平的标志:反应前后各原子的数目相等,可将上述方程式配平。
(1)本题可利用“定一法”进行配平,把Na2SO4的计量数定为1,则NaOH、H2SO4、H2O前面的化学
计量数分别为:2、1、2。
(2)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe2O3、CO2前面的化学计量数分别为:
2、3,最后调整C、Fe前面的化学计量数为3、4。
(3)本题可利用“定一法”进行配平,把C2H4的计量数定为1,则O2、H2O、CO2前面的化学计量数分
别为:3、2、2。
铁酸钠是污水处理过程中使用的一种新型净水剂,制取铁酸钠(M)的化学方程式如下:
2Fe(NO3)3+16NaOH+3C12═2M+6NaNO3+6NaCl+8H2O则M的化学式为( )
A、Na2Fe2O8 B、NaFeO4 C、Fe2NaO4 D、Na2FeO4
10、如图是某化学反应的微观示意图.请结合图示回答下列问题:
(1)产物C.D中,属于单质的是_____。
(2)该反应属于_____反应(填基本反应类型)。
(3)在该反应的化学方程式中,A.C的计量数(即化学方程式中的系数)之比为_____。
11、24g碳在80g氧气中充分燃烧,生成二氧化碳的质量为( )
A、88g B、72g C、104g D、110g
【答案】
9、D
10、C;置换;2:1
11、A
【解析】
9、根据原子在化学反应前后种类与数目均不变可得:反应前有2个铁原子,反应后其他物质中无铁原子,故“2M中”含有2个铁原子,得M中含有1个铁原子;反应前有16个钠原子,反应后氯化钠中共含6个钠原子,硝酸钠中共含6个钠原子,故“2M中”含有16-6-6=4个钠原子,得M中含有2个钠原子;反应前有2×3×3+16=34个氧原子,反应后水中共含8个氧原子,硝酸钠中共含3×6=18个氧原子,故“2M中”含有34-8-18=8个氧原子,得M中含有4个氧原子,即其化学式为:Na2FeO4。
10、(1)产物C.D中,C是由同种元素组成的纯净物,属于单质。故填:C;
(2)A是由不同种元素组成的纯净物,属于化合物。B是由同种元素组成的纯净物,属于单质。C属
于单质。D是由不同种元素组成的纯净物,属于化合物。属于置换反应,故填置换。
(3)配平后ABCD的系数分别是2、3、1、6。A、C的计量数(即化学方程式中的系数)之比为2:
1。故填:2:1。
11、根据化学方程式由碳的质量可计算出生成二氧化碳的质量。碳与氧气反应时质量比是3:8,则可知反应时氧气有剩余。
设生成二氧化碳的质量为x,
C+O2 =点燃=CO2
12 44
24g x
12/44=24g/x,
x=88g
故选A。
使用建议说明:此处内容主要用于教师对本节课重点内容进行总结,一方面是对本节课的重点难点内容的回顾,更重要的是针对这节课学生出现的问题再次进行复习提问等,以达到让学生课上掌握的目的,同时可以对下节课内容进行简单的铺垫,以体现出本节课内容与下节课内容之间的关系。
1、化学方程式的书写;
2、化学方程式的配平;
3、基于化学方程式的计算;
使用建议说明:此处内容主要用于教师根据学生掌握情况有针对性的进行课后作业的布置,掌握好的同学可以适当的布置难度大一些的作业,成绩一般的同学可以以基础题和巩固题目为主,但是一定要控制作业的数量,给学生布置的作业一般不要超过5题,这样学生才能保证做题的质量。
1、在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥原子的种类
A、①③④⑤ B、①③④⑥ C、①④⑥ D、 ①③⑤
2、化学方程式3Fe + 2O2 Fe3O4可读作( )
A、铁加氧气等于四氧化三铁 B、三个铁加两个氧气等于一个四氧化三铁
C、铁和氧气点燃后生成四氧化三铁 D、铁加氧气点燃等于四氧化三铁
3、某物质在纯氧中燃烧生成了氮气和水蒸气,该物质一定含有( )
A、氮元素和氧元素 B、 氢元素和氧元素 C、 氮元素和碳元素 D、 氮元素和氢元素
4、下列化学方程式正确的是( )
A、 S + O2 SO2↑ B、4Al +3O2 2Al2O3
C、P + O2 PO2 D、 Mg + O2 MgO2
5、红磷在密闭容器(含有空气)内燃烧,容器内有关的量随时间变化的图象正确的是( )
【答案】
1、B 2、C 3、D 4、B 5、D
6、在化学反应X + 2Y ==== Z中,3g X和足量Y充分反应后生成8g Z,则参加反应的Y的质量为( )
A、2.5 g B、3 g C、 5 g D、 6 g
7、下列各式中,正确表示铝与稀硫酸反应的化学方程式是( )
A、Al + H2SO4 ==== AlSO4 + H2↑
B、2Al+ 3H2SO4 ==== Al2(SO4)3 + 3H2↑
C、 Al + 2H2SO4 ==== Al(SO4)2 + 2H2↑
D、 2Al + H2SO4 ==== Al2SO4 + H2↑
8、在2A+B == 2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为( )
A、 16 g B、 32 g C、16 D、32
9、下列说法能用质量守恒定律解释的是( )
A、mg水受热变为mg的水蒸气 B、62g磷和80g的氧反应生成142g五氧化二磷
C、20g食盐溶于80g水得到100g的食盐水 D、拧开盛酒精的瓶盖一段时间后质量变小
【答案】
6、C 7、B 8、D 9、B
距今两千多年前,我国劳动人民就已经掌握了炼铁的技术,他们将炭不完全燃烧,产生一氧化碳,在
高温条件下利用一氧化碳将铁矿石中的三氧化二铁还原为铁并同时生成了二氧化碳。请写出上述两个反应的化学方程式。
(1) ,此反应类型: 。
(2) 。
11、配平下列化学方程式。(化学计量数为1也要填入空白处)
(1) P + O2 点燃 P2O5
(2) Fe2O3 + C 高温 Fe + CO2↑
(3) KClO3 △ KCl + O2 ↑
(4) C2H4 + O2 点燃 H2O + CO2
12、我国采用食盐中加入碘酸钾的方法防止缺碘引起的疾病。
(1)在人体中,碘属于 (选填“常量”或“微量”)元素。
(2)碘酸钾(KIO3)中钾.碘.氧三种元素质量比为 ;它受热易分解,烹饪时,
添加碘食盐应注意 。
我国规定加碘食盐含碘量为20~50 mg/kg。为测定某加碘食盐是否为合格产品。在酸性条件下用
足量KI溶液将其中KIO3全部转化成I2。反应方程式为KIO3+5KI+6HCl6KCl+3I2+3H2O。称取1000 g 某品牌加碘盐样品进行测定,经测定反应获得的I2的质量为152.4 mg,试通过计算说明该加碘食盐是否为合格产品。
13、已知碳酸钙在高温下可分解生成氧化钙和二氧化碳。同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
反应时间∕s t0 t1 t2 t3 t4 t5 t6
反应后固体的质量∕g 80 75 70 66 62 58 58
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为__________;
(2)求该石灰石中含CaCO3的质量分数(写出计算过程)。
【答案】
10、(1) 2C +O2 点燃 2CO 化合反应
(2) 3CO + Fe2O3 高温 2Fe + 3CO2
11、(1) 4 P + 5 O2 点燃 2 P2O5
(2) 2 Fe2O3 + 3 C 高温 4 Fe + 3 CO2↑
(3) 2 KClO3 △ 2 KCl + 3 O2↑
(4) 1 C2H4 + 3 O2 点燃 2 H2O + 2 CO2
12、(1)微量 (2) 39︰127 ︰48 不宜过早加入
(3)解:设KIO3的质量为x。
KIO3 + 5KI + 6HCl6KCl + 3I2 + 3H2O
214 762
x 152.4 mg
x=42.8 mg
1000 g 加碘盐中的碘元素质量为42.8 mg25.4 mg。
因为20 mg/kg <25.4 mg/kg <50 mg/kg,所以该加碘盐合格。
答:略。
13、(1) 22g
(2)解:设样品中含CaCO3的质量为x
CaCO3高温 CaO + CO2 ↑
100 44
x 22g
=
x = =50g
样品中的质量分数=×100%=62.5%
答:样品中CaCO3的质量分数为62.5%。
此处内容主要是针对教师在这节课上的比较成功的地方和比较失败的地方进行反思总结,同时也可以利用问卷星或调研表等对学生进行调研,以便于更好的总结和反思自己的教学。
1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
