1.1.2 原子结构模型第2课时(共21张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 1.1.2 原子结构模型第2课时(共21张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 18:58:21 | ||
图片预览






文档简介
(共21张PPT)
第一章 原子结构与元素性质
第1节 原子结构模型第2课时
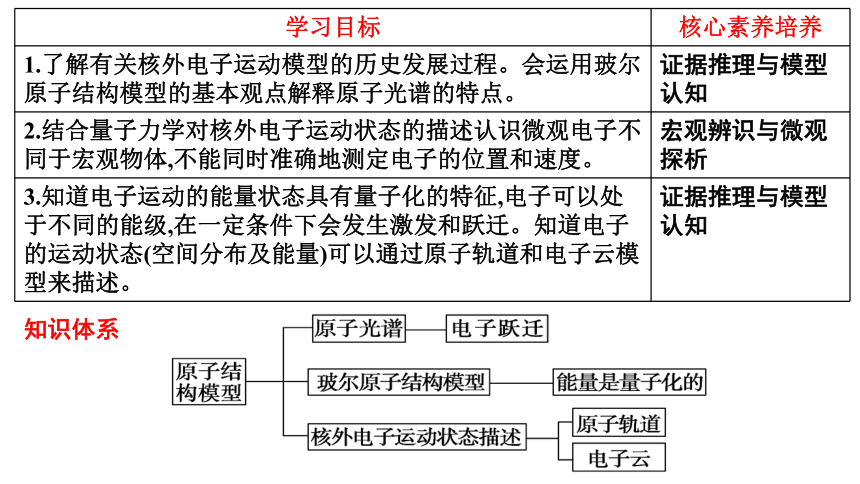
学习目标 核心素养培养
1.了解有关核外电子运动模型的历史发展过程。会运用玻尔原子结构模型的基本观点解释原子光谱的特点。 证据推理与模型认知
2.结合量子力学对核外电子运动状态的描述认识微观电子不同于宏观物体,不能同时准确地测定电子的位置和速度。 宏观辨识与微观探析
3.知道电子运动的能量状态具有量子化的特征,电子可以处于不同的能级,在一定条件下会发生激发和跃迁。知道电子的运动状态(空间分布及能量)可以通过原子轨道和电子云模型来描述。 证据推理与模型认知
知识体系
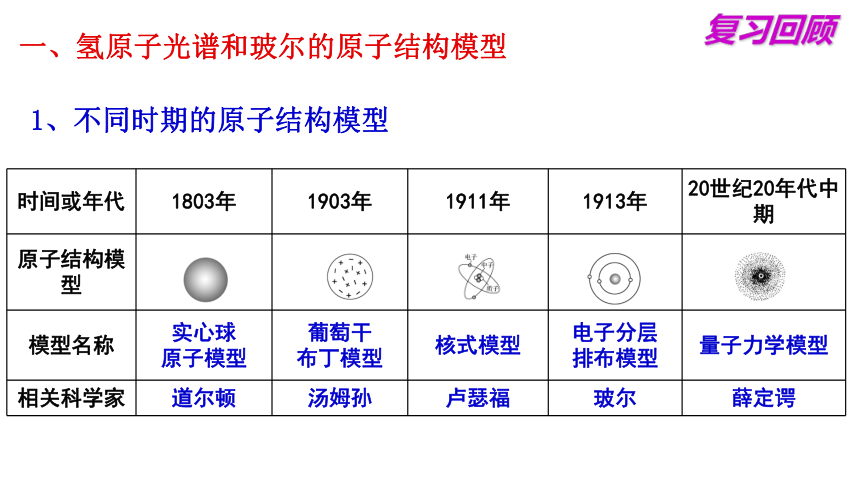
一、氢原子光谱和玻尔的原子结构模型
1、不同时期的原子结构模型
时间或年代 1803年 1903年 1911年 1913年 20世纪20年代中期
原子结构模型
模型名称 实心球 原子模型 葡萄干 布丁模型 核式模型 电子分层 排布模型 量子力学模型
相关科学家 道尔顿 汤姆孙 卢瑟福 玻尔 薛定谔
复习回顾
2、玻尔核外电子分层排布的原子结构模型的观点:
⑴原子中的电子具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量;
⑵在不同轨道上的电子具有不同能量,而且能量值是不连续的,是量子化的,轨道能量依量子数n 的值增大而升高,(n=1、2、3、4、5、6、7),电子能量最低的状态叫基态,电子能量高于基态的状态叫激发态。
⑶只有当电子从一个轨道跃迁到另一个轨道时,才会辐射(或吸收)能量,当以光的形式表现并不记录时,就形成了光谱。
3、光谱的分类和氢原子光谱
4、几组概念
⑴基态与激发态原子
①基态:最低能量状态。处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
③基态、激发态相互转化与能量的关系:
激发态原子
基态原子
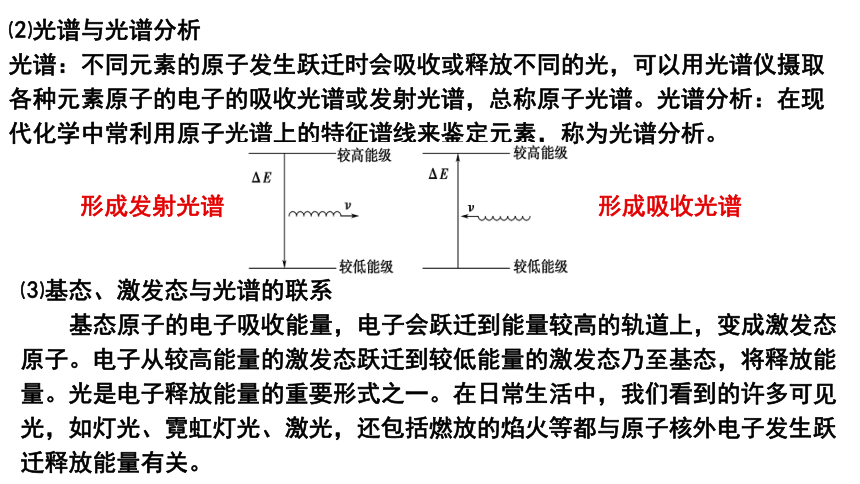
⑵光谱与光谱分析
光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的电子的吸收光谱或发射光谱,总称原子光谱。光谱分析:在现代化学中常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
形成吸收光谱
⑶基态、激发态与光谱的联系
基态原子的电子吸收能量,电子会跃迁到能量较高的轨道上,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态,将释放能量。光是电子释放能量的重要形式之一。在日常生活中,我们看到的许多可见光,如灯光、霓虹灯光、激光,还包括燃放的焰火等都与原子核外电子发生跃迁释放能量有关。
形成发射光谱
二.量子力学对原子核外电子运动状态的描述
1、核外电子的运动状态和原子轨道:电子层、能级、原子轨道、自旋状态
总结:原子中电子的能量高低关系
在多电子原子中,电子填充原子轨道时,原子轨道能量的高低存在如下规律:
(1)相同电子层上原子轨道能量的高低:ns(2)不同电子层形状相同的原子轨道能量的高低:1s<2s<3s;
2p<3p<4p。
(3)相同电子层形状相同的原子轨道能量的高低:2px=2py=2pz。
2.原子轨道的图形描述
s能级电子的原子轨道呈球形,即该原子轨道具有球对称性,电子层(能层)序数越大,原子轨道的半径越大。
(1)s电子的原子轨道
⑵p电子的原子轨道
P电子的原子轨道是纺锤形(哑铃形)形的,每个P原子轨道有3
个轨道(伸展方向),它们互相垂直, P轨道在空间的分布特点是分别相对于x、y、z轴对称, P原子轨道在空间的分布分别沿x、y、z方向。P原子轨道的平均半径也随电子层序数增大而增大。
S能级的原子轨道
P能级的原子轨道
d能级原子轨道有5个
f能级原子轨道有7个
大开眼界
宏观物体与微观粒子的运动状态有什么区别?
宏观物体 微观粒子
质量 很大 很小
速度 较小 很大(接近光速)
位移 可测 位置、动量不可同时测定
能量 可测 轨迹 可描述(画图或函数描述) 不可确定
联想质疑
原子核外电子的运动特点:
(1)电子的质量很小(9.109 5×10-31 kg),带负电荷。
(2)相对于原子和电子的体积而言,电子运动的空间很大。
(3)电子运动的速度很快,接近光速(3.0×108 m·s-1)。
现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
电子云图:描述核外电子空间单位体积内出现的概率大小的图形。
电子云中的小黑点:并不是表示原子核外的一个电子,而是表示电子在核外单位体积内空间出现的机率的多少(电子曾经出现过)。
电子云中小黑点的密度:电子云密度大的地方说明电子出现的机会多,而电子云密度小的地方说明电子出现的机会少。
氢原子的1s电子在原子核外出现的概率分布图
把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。
电子云和原子轨道的关系:
(1)电子云图:描述电子在核外空间某处单位体积内的概率分布的图形。
3.电子在核外的空间分布
⑶量子力学中轨道的含义与玻尔轨道的含义不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
(2)意义:点密集的地方,表示电子在此处单位体积内出现的概率大;点稀疏的地方,表示电子在此处单位体积内出现的概率小。
1、在多电子原子中,决定轨道能量的是( )
A.电子层 B.电子层和能级
C.电子层、能级和原子轨道空间分布
D.原子轨道空间分布和电子自旋方向
B
2、K层有____个能级,用符号分别表示为_____,L层有____个能级,用符号分别表示为_________,M层有______个能级,用符号分别表示为________________。
由此可推知n电子层最多可能有____个能级,能量最低的两个能级其符号分别表示为________,它们的原子轨道电子云形状各为________、________。
练习
1
1s
2
2s、2p
3
3s、3p、3d
n
ns、np
球形
哑铃形
3、下列关于核外电子的运动状态的说法错误的是( )
A.核外电子是分层运动的
B.只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,电子运动状态才能被确定
C.只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,才能确定每一个电子层的最多轨道数
D.电子云的空间伸展方向与电子的能量大小无关
C
5、下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A、核外电子是分层运动的
B、所有电子在同一区域里运动
C、能量高的电子在离核近的区域运动
D、能量低的电子在离核近的区域运动
AD
4、关于“电子云”的描述中,正确的是( )
A、一个小黑点表示一个电子
B、一个小黑点代表电子在此出现过一次
C、电子云是带正电的云雾
D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少
D
6、下列关于电子云的叙述不正确的是( )
A.电子云是用单位体积内小点的疏密程度来表示电子在原子核外某处单位体积内出现概率大小的图形
B.电子云实际上是电子运动形成的类似云一样的图形
C.电子云图说明电子离核越近,单位体积内出现的概率越大;电子离核越远,单位体积内出现的概率越小
D.相同电子层不同能级的原子轨道,其电子云的形状不同
B
THANKS
第一章 原子结构与元素性质
第1节 原子结构模型第2课时
学习目标 核心素养培养
1.了解有关核外电子运动模型的历史发展过程。会运用玻尔原子结构模型的基本观点解释原子光谱的特点。 证据推理与模型认知
2.结合量子力学对核外电子运动状态的描述认识微观电子不同于宏观物体,不能同时准确地测定电子的位置和速度。 宏观辨识与微观探析
3.知道电子运动的能量状态具有量子化的特征,电子可以处于不同的能级,在一定条件下会发生激发和跃迁。知道电子的运动状态(空间分布及能量)可以通过原子轨道和电子云模型来描述。 证据推理与模型认知
知识体系
一、氢原子光谱和玻尔的原子结构模型
1、不同时期的原子结构模型
时间或年代 1803年 1903年 1911年 1913年 20世纪20年代中期
原子结构模型
模型名称 实心球 原子模型 葡萄干 布丁模型 核式模型 电子分层 排布模型 量子力学模型
相关科学家 道尔顿 汤姆孙 卢瑟福 玻尔 薛定谔
复习回顾
2、玻尔核外电子分层排布的原子结构模型的观点:
⑴原子中的电子具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量;
⑵在不同轨道上的电子具有不同能量,而且能量值是不连续的,是量子化的,轨道能量依量子数n 的值增大而升高,(n=1、2、3、4、5、6、7),电子能量最低的状态叫基态,电子能量高于基态的状态叫激发态。
⑶只有当电子从一个轨道跃迁到另一个轨道时,才会辐射(或吸收)能量,当以光的形式表现并不记录时,就形成了光谱。
3、光谱的分类和氢原子光谱
4、几组概念
⑴基态与激发态原子
①基态:最低能量状态。处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
③基态、激发态相互转化与能量的关系:
激发态原子
基态原子
⑵光谱与光谱分析
光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的电子的吸收光谱或发射光谱,总称原子光谱。光谱分析:在现代化学中常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
形成吸收光谱
⑶基态、激发态与光谱的联系
基态原子的电子吸收能量,电子会跃迁到能量较高的轨道上,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态,将释放能量。光是电子释放能量的重要形式之一。在日常生活中,我们看到的许多可见光,如灯光、霓虹灯光、激光,还包括燃放的焰火等都与原子核外电子发生跃迁释放能量有关。
形成发射光谱
二.量子力学对原子核外电子运动状态的描述
1、核外电子的运动状态和原子轨道:电子层、能级、原子轨道、自旋状态
总结:原子中电子的能量高低关系
在多电子原子中,电子填充原子轨道时,原子轨道能量的高低存在如下规律:
(1)相同电子层上原子轨道能量的高低:ns
2p<3p<4p。
(3)相同电子层形状相同的原子轨道能量的高低:2px=2py=2pz。
2.原子轨道的图形描述
s能级电子的原子轨道呈球形,即该原子轨道具有球对称性,电子层(能层)序数越大,原子轨道的半径越大。
(1)s电子的原子轨道
⑵p电子的原子轨道
P电子的原子轨道是纺锤形(哑铃形)形的,每个P原子轨道有3
个轨道(伸展方向),它们互相垂直, P轨道在空间的分布特点是分别相对于x、y、z轴对称, P原子轨道在空间的分布分别沿x、y、z方向。P原子轨道的平均半径也随电子层序数增大而增大。
S能级的原子轨道
P能级的原子轨道
d能级原子轨道有5个
f能级原子轨道有7个
大开眼界
宏观物体与微观粒子的运动状态有什么区别?
宏观物体 微观粒子
质量 很大 很小
速度 较小 很大(接近光速)
位移 可测 位置、动量不可同时测定
能量 可测 轨迹 可描述(画图或函数描述) 不可确定
联想质疑
原子核外电子的运动特点:
(1)电子的质量很小(9.109 5×10-31 kg),带负电荷。
(2)相对于原子和电子的体积而言,电子运动的空间很大。
(3)电子运动的速度很快,接近光速(3.0×108 m·s-1)。
现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
电子云图:描述核外电子空间单位体积内出现的概率大小的图形。
电子云中的小黑点:并不是表示原子核外的一个电子,而是表示电子在核外单位体积内空间出现的机率的多少(电子曾经出现过)。
电子云中小黑点的密度:电子云密度大的地方说明电子出现的机会多,而电子云密度小的地方说明电子出现的机会少。
氢原子的1s电子在原子核外出现的概率分布图
把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。
电子云和原子轨道的关系:
(1)电子云图:描述电子在核外空间某处单位体积内的概率分布的图形。
3.电子在核外的空间分布
⑶量子力学中轨道的含义与玻尔轨道的含义不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
(2)意义:点密集的地方,表示电子在此处单位体积内出现的概率大;点稀疏的地方,表示电子在此处单位体积内出现的概率小。
1、在多电子原子中,决定轨道能量的是( )
A.电子层 B.电子层和能级
C.电子层、能级和原子轨道空间分布
D.原子轨道空间分布和电子自旋方向
B
2、K层有____个能级,用符号分别表示为_____,L层有____个能级,用符号分别表示为_________,M层有______个能级,用符号分别表示为________________。
由此可推知n电子层最多可能有____个能级,能量最低的两个能级其符号分别表示为________,它们的原子轨道电子云形状各为________、________。
练习
1
1s
2
2s、2p
3
3s、3p、3d
n
ns、np
球形
哑铃形
3、下列关于核外电子的运动状态的说法错误的是( )
A.核外电子是分层运动的
B.只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,电子运动状态才能被确定
C.只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,才能确定每一个电子层的最多轨道数
D.电子云的空间伸展方向与电子的能量大小无关
C
5、下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A、核外电子是分层运动的
B、所有电子在同一区域里运动
C、能量高的电子在离核近的区域运动
D、能量低的电子在离核近的区域运动
AD
4、关于“电子云”的描述中,正确的是( )
A、一个小黑点表示一个电子
B、一个小黑点代表电子在此出现过一次
C、电子云是带正电的云雾
D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少
D
6、下列关于电子云的叙述不正确的是( )
A.电子云是用单位体积内小点的疏密程度来表示电子在原子核外某处单位体积内出现概率大小的图形
B.电子云实际上是电子运动形成的类似云一样的图形
C.电子云图说明电子离核越近,单位体积内出现的概率越大;电子离核越远,单位体积内出现的概率越小
D.相同电子层不同能级的原子轨道,其电子云的形状不同
B
THANKS
