2024人教版高中化学必修第二册同步练习题--第六章 化学反应与能量复习提升(含解析)
文档属性
| 名称 | 2024人教版高中化学必修第二册同步练习题--第六章 化学反应与能量复习提升(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 19:15:18 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024人教版高中化学必修第二册同步
本章复习提升
易混易错练
易错点1 错误理解化学反应中的能量变化
1.(2023河南洛宁一中期中)对于化学反应中的能量变化,表述不正确的是( )
A.需要加热的化学反应不一定是吸热反应
B.中和反应都是放热反应
C.浓硫酸溶于水为放热反应
D.反应中旧键断裂吸收的能量大于新键形成放出的能量时,反应为吸热反应
2.(2023黑龙江牡丹江一中期中)如下图所示,有关化学反应和能量变化的说法正确的是( )
图a图b
A.图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
B.图a表示吸热反应,图b表示放热反应
C.图b中反应物的总键能大于生成物的总键能
D.图b可以表示Mg与盐酸反应的能量变化
易错点2 对原电池的工作原理认识不透彻
3.(2023河南焦作期中)PbCl2是一种难溶于冷水和稀盐酸的白色固体。某化学兴趣小组根据反应Pb+Cl2PbCl2设计的原电池的工作原理如图所示,下列说法错误的是( )
A.该装置主要是将化学能转化为电能
B.Pb电极为原电池的负极
C.电池工作时,Pb电极上有白色沉淀生成
D.电池工作时,溶液中H+向Pb电极区域移动
4.(2022广东十五校联盟月考)如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法中,正确的是( )
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向为a→b
D.反应后a极质量减小
易错点3 错误理解化学反应速率和反应限度的概念
5.(2022黑龙江黑河期中联考)下列有关化学反应速率及限度的描述错误的是( )
A.催化剂能改变化学反应的速率
B.一定条件下的可逆反应,反应物的转化率不可能达到100%
C.有气体参加的反应,通过压缩体积增大压强,可以使反应速率增大
D.当化学反应达到其最大限度时,反应就停止了
6.(2023浙江9+1高中联盟联考)某温度下,在1 L恒容真空密闭容器中充入5.0 mol块状X,发生反应:2X(s)Y(g)+2Z(g),测得如表数据,下列说法不正确的是( )
时间段/s 产物Z的平均生成速率/mol·L-1·s-1
0~20 0.10
0~40 0.075
0~60 0.05
A.第10秒时,Y的浓度小于0.50 mol·L-1
B.第30秒时,Z的体积分数约为66.7%
C.将块状X改为粉末状,化学反应速率加快
D.容器内压强不再变化时,达到化学反应的限度
思想方法练
运用“数形结合”思想解答能量图像题及速率平衡图像题
方法概述
使用数形结合思想解答分析问题,可以使复杂的问题简单化、抽象的问题具体化,兼有“数”的严谨与“形”的直观,是优化解题过程的重要途径。在解答化学反应与能量的习题中有巧妙地应用。
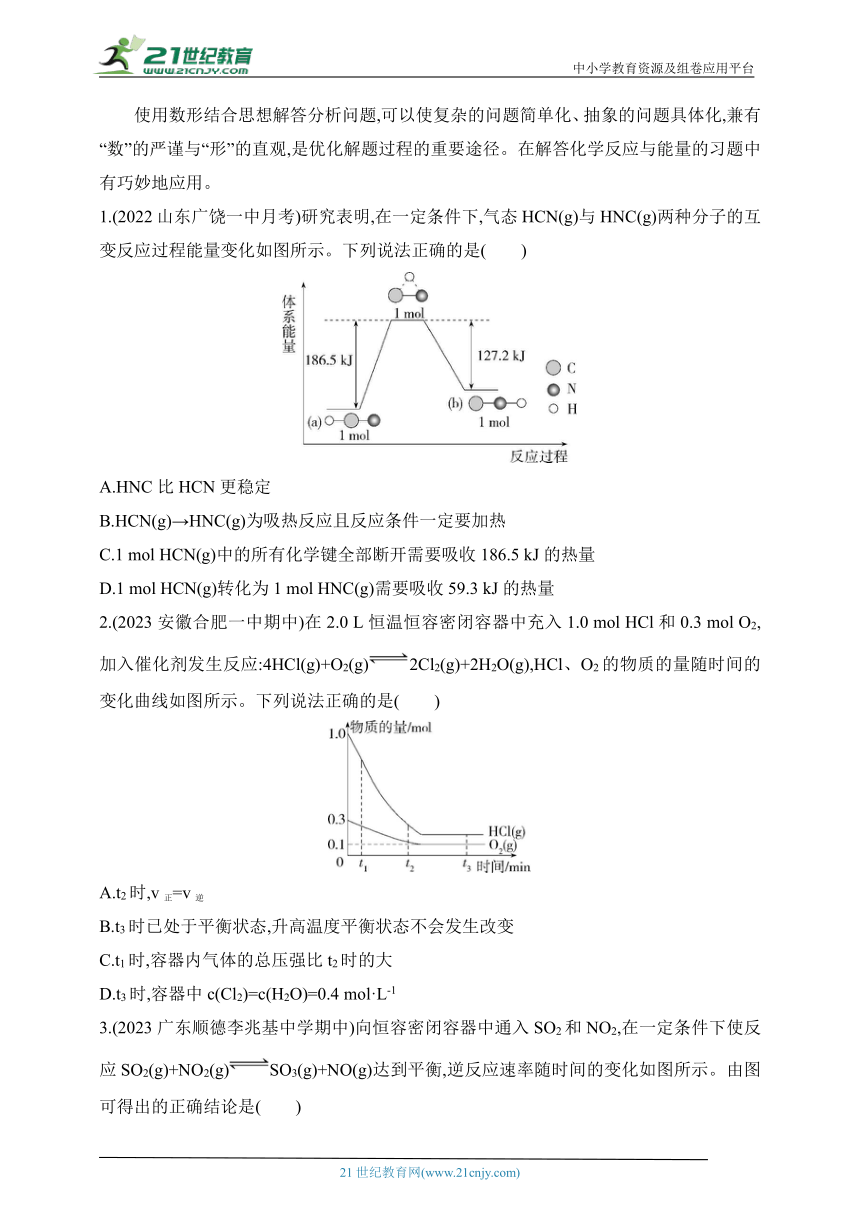
1.(2022山东广饶一中月考)研究表明,在一定条件下,气态HCN(g)与HNC(g)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
A.HNC比HCN更稳定
B.HCN(g)→HNC(g)为吸热反应且反应条件一定要加热
C.1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量
D.1 mol HCN(g)转化为1 mol HNC(g)需要吸收59.3 kJ的热量
2.(2023安徽合肥一中期中)在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )
A.t2时,v正=v逆
B.t3时已处于平衡状态,升高温度平衡状态不会发生改变
C.t1时,容器内气体的总压强比t2时的大
D.t3时,容器中c(Cl2)=c(H2O)=0.4 mol·L-1
3.(2023广东顺德李兆基中学期中)向恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,逆反应速率随时间的变化如图所示。由图可得出的正确结论是( )
A.从图像可知该反应一定为放热反应
B.从a点到c点过程中反应物的浓度逐渐增大
C.c点时,反应达到最大限度
D.Δt1=Δt2时,SO2的浓度变化a~b段小于b~c段
4.(2023湖北期中联考)在一个容积不变的2 L密闭容器中加入2 mol SO2、1 mol O2和合适的催化剂,发生反应2SO2(g)+O2(g)2SO3(g),该反应为放热反应,同时研究温度对SO2的平衡转化率和催化剂的催化效率的影响,如下图所示:
已知:SO2的平衡转化率=×100%。下列说法正确的是( )
A.合成SO3的最佳条件是加催化剂,温度为250 ℃
B.450 ℃时,若5 min达到平衡,则v(O2)=0.09 mol·L-1·min-1
C.升高温度,正反应速率增大,逆反应速率减小
D.SO3的生成速率:v(N)一定大于v(M)
本章复习提升
易混易错练
1.C 2.C 3.D 4.D 5.D 6.A
1.C 需要加热的化学反应不一定是吸热反应,如木炭的燃烧需要加热,但该反应属于放热反应,A正确;酸与碱的中和反应都是放热反应,B正确;浓硫酸溶于水的过程为放热过程,不是放热反应,C错误;反应中旧键断裂吸收的能量大于新键形成放出的能量说明反应物的总能量小于生成物的总能量,该反应为吸热反应,D正确。
易错分析 吸热反应、放热反应均是化学变化过程。化学反应是放热反应还是吸热反应,与反应条件和反应类型无直接关系,是由反应物总能量和生成物总能量的相对大小所决定的。
2.C 图a中反应物总能量高于生成物总能量,属于放热反应,不能表示氯化铵固体与氢氧化钡晶体反应的能量变化,因为该反应是吸热反应,A错误;图b中反应物总能量低于生成物总能量,属于吸热反应,B错误;图b表示吸热反应,因此反应物的总键能大于生成物的总键能,C正确;图b表示吸热反应,镁和盐酸的反应是放热反应,图b不能表示Mg与盐酸反应的能量变化,D错误。
3.D 该装置为原电池装置,主要是将化学能转化为电能,A正确;Pb电极为原电池的负极,失电子发生氧化反应,B正确;电池工作时,Pb电极作负极,电极反应式为Pb-2e-+2Cl- PbCl2,则Pb电极上有白色沉淀PbCl2生成,C正确;Pb电极作负极,Pt电极作正极,溶液中H+向正极移动,即向Pt电极区域移动,D错误。
易错分析 原电池中电子流向与电流方向、离子的迁移方向等易混淆。需明确电子流向:负极→导线→正极;电流方向:正极→导线→负极(与电子流向相反);离子的迁移方向:阳离子→正极,阴离子→负极。
4.D 根据a的金属活动性在氢之前,b为碳棒,可知该原电池中a为负极、b为正极。a极失去电子发生氧化反应,b极得到电子发生还原反应,A项错误;碳棒上H+得电子被还原生成H2,反应中消耗H+,溶液中c(H+)减小,B项错误;电池工作时,导线上电流从正极流向负极,即电流方向为b→a,C项错误;a极金属失去电子而溶解进入溶液中,即反应后a极质量减小,D项正确。
5.D 加入适当催化剂,能加快化学反应速率,A项正确;可逆反应存在一定的限度,反应物的转化率不可能达到100%,B项正确;有气体参加的反应,通过压缩体积增大压强,间接增大了气体反应物的浓度,化学反应速率增大,C项正确;化学反应达到最大限度时,即达到化学平衡状态,v正=v逆≠0,反应并没有停止,D项错误。
易错分析 ①所有的化学反应,升高温度均能加快化学反应速率,使用催化剂能同等程度的改变正、逆反应速率。
②不能正确理解“变量不变”时才能说明反应达到平衡状态而出错。需将各项表述转化为分析正、逆反应速率是否相等或混合物中各组分浓度是否保持不变,再进行判断。
6.A 随着反应的进行,平均反应速率不断减小,0~20 s,Z的平均生成速率为0.10 mol·L-1·s-1,则0~10 s,Z的平均生成速率大于0.10 mol·L-1·s-1,10 s时Z的浓度大于0.10 mol·L-1·s-1×10 s=1 mol·L-1,此时Y的浓度大于0.50 mol·L-1,A不正确;反应过程中,始终满足Y(g)、Z(g)物质的量之比为1∶2,所以第30秒时,Z的体积分数为×100%≈66.7%,B正确;将块状X改为粉末状,反应物的接触面积增大,所以化学反应速率加快,C正确;随着反应的进行,X不断分解,混合气体的物质的量不断增大,压强不断增大,当容器内压强不再变化时,达到化学反应的限度,D正确。
思想方法练
1.D 2.C 3.C 4.B
1.D 由题图可知,等物质的量的HCN比HNC含有的能量更低,则HCN比HNC更稳定,A项错误;HCN(g)→HNC(g)时会吸收能量,即反应为吸热反应,但反应不一定在加热条件下进行,B项错误;由题图可知1 mol HCN(g)转化为中间状态的物质需吸收186.5 kJ的热量,该中间物质中仍存在化学键,故1 mol HCN(g)中的所有化学键全部断开吸收的热量要大于186.5 kJ,C项错误;由题图可知1 mol HCN(g)转化为1 mol HNC(g)吸收的能量为186.5 kJ-127.2 kJ=59.3 kJ,D项正确。
方法点津 根据变化过程中的能量变化,可判断反应是吸热反应还是放热反应,若生成物总能量>反应物总能量则为吸热反应,反之为放热反应;结合物质所具有的能量,可判断物质的稳定性,一般来说,物质含有的能量越低,其越稳定。
2.C t2时反应还没有达到平衡,v正≠v逆,A项错误;t3时HCl和O2的物质的量不再发生变化,反应已经达到平衡,但升高温度改变了原有条件,旧平衡会被破坏,一段时间后达到新的平衡,故升温平衡状态会发生改变,B项错误;该反应反应物气体分子数大于生成物,t1时气体总分子数大于t2时气体总分子数,故在恒温恒容密闭容器内,t1时气体的总压强比t2时的大,C项正确;t3时,列三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
起始/mol 1 0.3 0 0
转化/mol 0.8 0.2 0.4 0.4
平衡/mol 0.2 0.1 0.4 0.4
容器中c(Cl2)=c(H2O)==0.2 mol·L-1,D项错误。
方法点津 解答速率、平衡图像题的思路分析
3.C 题图中不能体现温度对反应的影响,不能确定是吸热反应还是放热反应,A错误;从a点到c点过程中逆反应速率逐渐增大,则平衡正向进行,反应物浓度逐渐减小,B错误;c点后逆反应速率不再变,反应达到平衡状态,则反应达到最大限度,C正确;a~b段反应速率快,则Δt1=Δt2时,SO2的浓度变化a~b段大于b~c段,D错误。
4.B 加入催化剂可加快反应速率,缩短反应达到平衡的时间,合成SO3的最佳条件是加入催化剂,温度为450 ℃,A错误;450 ℃时,SO2的平衡转化率为90%,此时参加反应的SO2为2 mol×90%=1.8 mol,若5 min达到平衡,则v(SO2)==0.18 mol·L-1·min-1,由速率之比等于化学计量数之比可得v(O2)=v(SO2)=0.09 mol·L-1·min-1,B正确;升高温度,正、逆反应速率均增大,C错误;N点温度高于M点,但N点催化剂的催化效率低于M点,所以v(N)有可能小于v(M),D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版高中化学必修第二册同步
本章复习提升
易混易错练
易错点1 错误理解化学反应中的能量变化
1.(2023河南洛宁一中期中)对于化学反应中的能量变化,表述不正确的是( )
A.需要加热的化学反应不一定是吸热反应
B.中和反应都是放热反应
C.浓硫酸溶于水为放热反应
D.反应中旧键断裂吸收的能量大于新键形成放出的能量时,反应为吸热反应
2.(2023黑龙江牡丹江一中期中)如下图所示,有关化学反应和能量变化的说法正确的是( )
图a图b
A.图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
B.图a表示吸热反应,图b表示放热反应
C.图b中反应物的总键能大于生成物的总键能
D.图b可以表示Mg与盐酸反应的能量变化
易错点2 对原电池的工作原理认识不透彻
3.(2023河南焦作期中)PbCl2是一种难溶于冷水和稀盐酸的白色固体。某化学兴趣小组根据反应Pb+Cl2PbCl2设计的原电池的工作原理如图所示,下列说法错误的是( )
A.该装置主要是将化学能转化为电能
B.Pb电极为原电池的负极
C.电池工作时,Pb电极上有白色沉淀生成
D.电池工作时,溶液中H+向Pb电极区域移动
4.(2022广东十五校联盟月考)如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法中,正确的是( )
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向为a→b
D.反应后a极质量减小
易错点3 错误理解化学反应速率和反应限度的概念
5.(2022黑龙江黑河期中联考)下列有关化学反应速率及限度的描述错误的是( )
A.催化剂能改变化学反应的速率
B.一定条件下的可逆反应,反应物的转化率不可能达到100%
C.有气体参加的反应,通过压缩体积增大压强,可以使反应速率增大
D.当化学反应达到其最大限度时,反应就停止了
6.(2023浙江9+1高中联盟联考)某温度下,在1 L恒容真空密闭容器中充入5.0 mol块状X,发生反应:2X(s)Y(g)+2Z(g),测得如表数据,下列说法不正确的是( )
时间段/s 产物Z的平均生成速率/mol·L-1·s-1
0~20 0.10
0~40 0.075
0~60 0.05
A.第10秒时,Y的浓度小于0.50 mol·L-1
B.第30秒时,Z的体积分数约为66.7%
C.将块状X改为粉末状,化学反应速率加快
D.容器内压强不再变化时,达到化学反应的限度
思想方法练
运用“数形结合”思想解答能量图像题及速率平衡图像题
方法概述
使用数形结合思想解答分析问题,可以使复杂的问题简单化、抽象的问题具体化,兼有“数”的严谨与“形”的直观,是优化解题过程的重要途径。在解答化学反应与能量的习题中有巧妙地应用。
1.(2022山东广饶一中月考)研究表明,在一定条件下,气态HCN(g)与HNC(g)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
A.HNC比HCN更稳定
B.HCN(g)→HNC(g)为吸热反应且反应条件一定要加热
C.1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量
D.1 mol HCN(g)转化为1 mol HNC(g)需要吸收59.3 kJ的热量
2.(2023安徽合肥一中期中)在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )
A.t2时,v正=v逆
B.t3时已处于平衡状态,升高温度平衡状态不会发生改变
C.t1时,容器内气体的总压强比t2时的大
D.t3时,容器中c(Cl2)=c(H2O)=0.4 mol·L-1
3.(2023广东顺德李兆基中学期中)向恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,逆反应速率随时间的变化如图所示。由图可得出的正确结论是( )
A.从图像可知该反应一定为放热反应
B.从a点到c点过程中反应物的浓度逐渐增大
C.c点时,反应达到最大限度
D.Δt1=Δt2时,SO2的浓度变化a~b段小于b~c段
4.(2023湖北期中联考)在一个容积不变的2 L密闭容器中加入2 mol SO2、1 mol O2和合适的催化剂,发生反应2SO2(g)+O2(g)2SO3(g),该反应为放热反应,同时研究温度对SO2的平衡转化率和催化剂的催化效率的影响,如下图所示:
已知:SO2的平衡转化率=×100%。下列说法正确的是( )
A.合成SO3的最佳条件是加催化剂,温度为250 ℃
B.450 ℃时,若5 min达到平衡,则v(O2)=0.09 mol·L-1·min-1
C.升高温度,正反应速率增大,逆反应速率减小
D.SO3的生成速率:v(N)一定大于v(M)
本章复习提升
易混易错练
1.C 2.C 3.D 4.D 5.D 6.A
1.C 需要加热的化学反应不一定是吸热反应,如木炭的燃烧需要加热,但该反应属于放热反应,A正确;酸与碱的中和反应都是放热反应,B正确;浓硫酸溶于水的过程为放热过程,不是放热反应,C错误;反应中旧键断裂吸收的能量大于新键形成放出的能量说明反应物的总能量小于生成物的总能量,该反应为吸热反应,D正确。
易错分析 吸热反应、放热反应均是化学变化过程。化学反应是放热反应还是吸热反应,与反应条件和反应类型无直接关系,是由反应物总能量和生成物总能量的相对大小所决定的。
2.C 图a中反应物总能量高于生成物总能量,属于放热反应,不能表示氯化铵固体与氢氧化钡晶体反应的能量变化,因为该反应是吸热反应,A错误;图b中反应物总能量低于生成物总能量,属于吸热反应,B错误;图b表示吸热反应,因此反应物的总键能大于生成物的总键能,C正确;图b表示吸热反应,镁和盐酸的反应是放热反应,图b不能表示Mg与盐酸反应的能量变化,D错误。
3.D 该装置为原电池装置,主要是将化学能转化为电能,A正确;Pb电极为原电池的负极,失电子发生氧化反应,B正确;电池工作时,Pb电极作负极,电极反应式为Pb-2e-+2Cl- PbCl2,则Pb电极上有白色沉淀PbCl2生成,C正确;Pb电极作负极,Pt电极作正极,溶液中H+向正极移动,即向Pt电极区域移动,D错误。
易错分析 原电池中电子流向与电流方向、离子的迁移方向等易混淆。需明确电子流向:负极→导线→正极;电流方向:正极→导线→负极(与电子流向相反);离子的迁移方向:阳离子→正极,阴离子→负极。
4.D 根据a的金属活动性在氢之前,b为碳棒,可知该原电池中a为负极、b为正极。a极失去电子发生氧化反应,b极得到电子发生还原反应,A项错误;碳棒上H+得电子被还原生成H2,反应中消耗H+,溶液中c(H+)减小,B项错误;电池工作时,导线上电流从正极流向负极,即电流方向为b→a,C项错误;a极金属失去电子而溶解进入溶液中,即反应后a极质量减小,D项正确。
5.D 加入适当催化剂,能加快化学反应速率,A项正确;可逆反应存在一定的限度,反应物的转化率不可能达到100%,B项正确;有气体参加的反应,通过压缩体积增大压强,间接增大了气体反应物的浓度,化学反应速率增大,C项正确;化学反应达到最大限度时,即达到化学平衡状态,v正=v逆≠0,反应并没有停止,D项错误。
易错分析 ①所有的化学反应,升高温度均能加快化学反应速率,使用催化剂能同等程度的改变正、逆反应速率。
②不能正确理解“变量不变”时才能说明反应达到平衡状态而出错。需将各项表述转化为分析正、逆反应速率是否相等或混合物中各组分浓度是否保持不变,再进行判断。
6.A 随着反应的进行,平均反应速率不断减小,0~20 s,Z的平均生成速率为0.10 mol·L-1·s-1,则0~10 s,Z的平均生成速率大于0.10 mol·L-1·s-1,10 s时Z的浓度大于0.10 mol·L-1·s-1×10 s=1 mol·L-1,此时Y的浓度大于0.50 mol·L-1,A不正确;反应过程中,始终满足Y(g)、Z(g)物质的量之比为1∶2,所以第30秒时,Z的体积分数为×100%≈66.7%,B正确;将块状X改为粉末状,反应物的接触面积增大,所以化学反应速率加快,C正确;随着反应的进行,X不断分解,混合气体的物质的量不断增大,压强不断增大,当容器内压强不再变化时,达到化学反应的限度,D正确。
思想方法练
1.D 2.C 3.C 4.B
1.D 由题图可知,等物质的量的HCN比HNC含有的能量更低,则HCN比HNC更稳定,A项错误;HCN(g)→HNC(g)时会吸收能量,即反应为吸热反应,但反应不一定在加热条件下进行,B项错误;由题图可知1 mol HCN(g)转化为中间状态的物质需吸收186.5 kJ的热量,该中间物质中仍存在化学键,故1 mol HCN(g)中的所有化学键全部断开吸收的热量要大于186.5 kJ,C项错误;由题图可知1 mol HCN(g)转化为1 mol HNC(g)吸收的能量为186.5 kJ-127.2 kJ=59.3 kJ,D项正确。
方法点津 根据变化过程中的能量变化,可判断反应是吸热反应还是放热反应,若生成物总能量>反应物总能量则为吸热反应,反之为放热反应;结合物质所具有的能量,可判断物质的稳定性,一般来说,物质含有的能量越低,其越稳定。
2.C t2时反应还没有达到平衡,v正≠v逆,A项错误;t3时HCl和O2的物质的量不再发生变化,反应已经达到平衡,但升高温度改变了原有条件,旧平衡会被破坏,一段时间后达到新的平衡,故升温平衡状态会发生改变,B项错误;该反应反应物气体分子数大于生成物,t1时气体总分子数大于t2时气体总分子数,故在恒温恒容密闭容器内,t1时气体的总压强比t2时的大,C项正确;t3时,列三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
起始/mol 1 0.3 0 0
转化/mol 0.8 0.2 0.4 0.4
平衡/mol 0.2 0.1 0.4 0.4
容器中c(Cl2)=c(H2O)==0.2 mol·L-1,D项错误。
方法点津 解答速率、平衡图像题的思路分析
3.C 题图中不能体现温度对反应的影响,不能确定是吸热反应还是放热反应,A错误;从a点到c点过程中逆反应速率逐渐增大,则平衡正向进行,反应物浓度逐渐减小,B错误;c点后逆反应速率不再变,反应达到平衡状态,则反应达到最大限度,C正确;a~b段反应速率快,则Δt1=Δt2时,SO2的浓度变化a~b段大于b~c段,D错误。
4.B 加入催化剂可加快反应速率,缩短反应达到平衡的时间,合成SO3的最佳条件是加入催化剂,温度为450 ℃,A错误;450 ℃时,SO2的平衡转化率为90%,此时参加反应的SO2为2 mol×90%=1.8 mol,若5 min达到平衡,则v(SO2)==0.18 mol·L-1·min-1,由速率之比等于化学计量数之比可得v(O2)=v(SO2)=0.09 mol·L-1·min-1,B正确;升高温度,正、逆反应速率均增大,C错误;N点温度高于M点,但N点催化剂的催化效率低于M点,所以v(N)有可能小于v(M),D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
