3.2.1 水的电离和溶液的pH 课件(共20张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.1 水的电离和溶液的pH 课件(共20张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 29.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 19:52:52 | ||
图片预览






文档简介
(共20张PPT)
第2节 水的电离和溶液的pH
第1课时:水的电离和溶液的 酸碱性与pH
第三章
水的导电性实验
纯水能发生微弱的电离
水的电导率测定
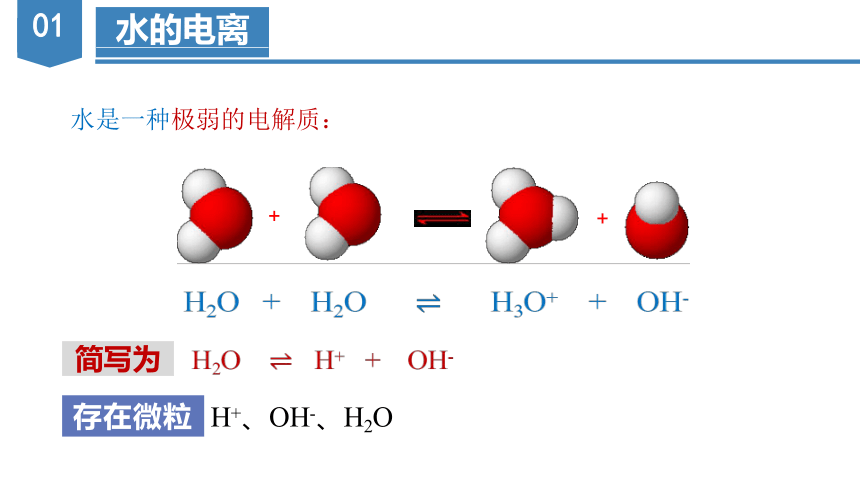
水的电离
水是一种极弱的电解质:
+
+
H2O + H2O H3O+ + OH-
简写为
H2O H+ + OH-
存在微粒
H+、OH-、H2O
水的电离
Kw=c(H+)·c(OH-)
1. Kw 的表达式:
特别提示:
常温时,Kw=c(H+)·c(OH-)=1×10-14
① Kw 为常数,无单位
② Kw 不仅适用于纯水,也适用于稀的电解质水溶液
③ c(H+)表示溶液中总的H+浓度,
c(OH-)表示溶液中总的OH-浓度。
当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作Kw,Kw 叫做水的离子积常数,简称水的离子积。
水的电离
影响水电离平衡的因素
T/℃ 0 10 20 25 40 50 100
Kw/10-14 0.114 0.292 0.681 1.00 2.92 5.47 55.0
KW 只受温度影响。
温度升高,水的离子积增大。
100℃下: Kw = 55×10-14 ≈ 1.0×10-12
水的电离
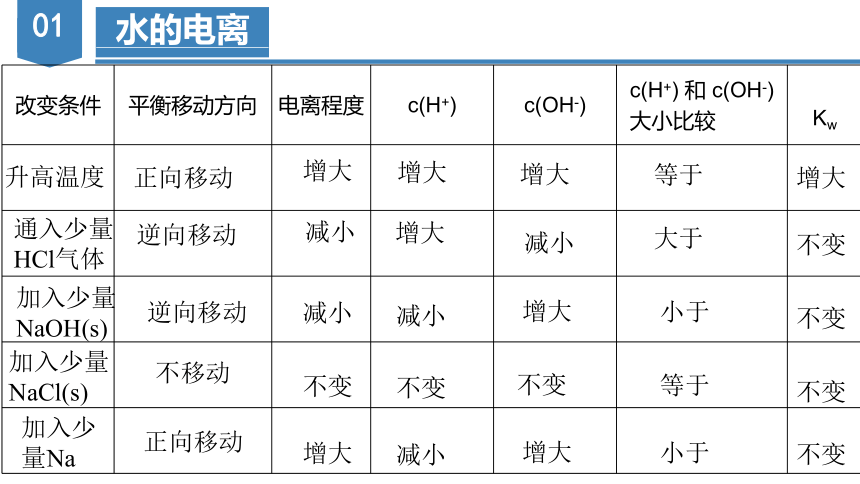
改变条件 平衡移动方向 电离程度 c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较
Kw
升高温度
通入少量HCl气体
加入少量NaOH(s)
加入少量
NaCl(s)
加入少量Na
增大
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
正向移动
正向移动
逆向移动
逆向移动
不移动
不变
不变
不变
不变
不变
不变
不变
大于
小于
等于
小于
等于
减小
水的电离
(1)温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
(下一节再讲)
(2)酸
(3)碱
(4)发生化学反应
促进水的电离,Kw不变
(5)能水解的盐促进水的电离
水的离子平衡的影响因素
溶液的酸碱性与pH
水的离子积 Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
1) 酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
【思考与讨论】
H2O H+ + OH-
存在
溶液的酸碱性与pH
【思考与讨论】
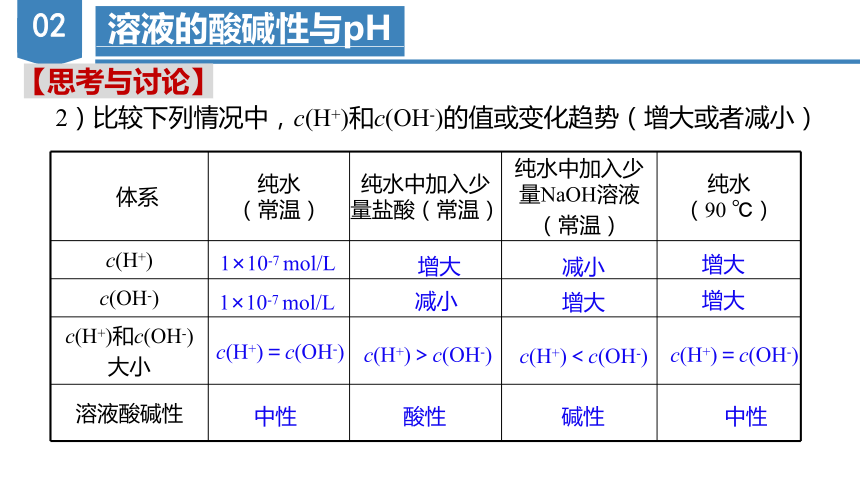
2)比较下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或者减小)
体系 纯水 (常温) 纯水中加入少量盐酸(常温) 纯水中加入少量NaOH溶液 (常温) 纯水
(90 ℃)
c(H+)
c(OH-)
c(H+)和c(OH-) 大小
溶液酸碱性
c(H+)>c(OH-)
1×10-7 mol/L
1×10-7 mol/L
减小
增大
c(H+)=c(OH-)
c(H+)<c(OH-)
增大
减小
c(H+)=c(OH-)
增大
增大
中性
酸性
碱性
中性
溶液的酸碱性与pH
溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性由c(H+)和c(OH-)相对大小决定
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性
酸性
碱性
常温时:KW= c(H+) · c(OH-) = 1×10-14
c(H+) =1×10-7
c(H+) >1×10-7
c(H+) <1×10-7
溶液的酸碱性与pH
pH大小与溶液的酸碱性关系 (25℃)
pH 溶液的酸碱性
pH<7 溶液呈酸性,pH越小,酸性越强
pH=7 溶液呈中性
pH>7 溶液呈碱性,pH越大,碱性越强
10-5
10-4
10-3
10-2
10-1
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
10-6
5
4
3
2
1
7
8
9
10
11
12
13
14
6
c(H+)
pH
c(H+)增大,pH减小
酸性增强
c(H+)减小,pH增大
碱性增强
溶液的酸碱性与pH
pH是c(H+)的负对数,即:pH=-lgc(H+)
■ pH的适用范围:
c(H+)和c(OH-)都较小的稀溶液(小于1 mol/L)
c(H+)=1×10-3 mol/L, pH= -lg10-3 =3
例1:1×10-3 mol/L盐酸,求溶液的pH。
pH=-lg10-10=10
c(OH-)=1×10-4 mol/L
例2: 常温下,1×10-4 mol/L NaOH溶液,求溶液的pH。
c(H+)== 1×10-10 mol/L
溶液的酸碱性与pH
pH=7的溶液一定是中性溶液吗?(以100℃ 为例)
答:不一定,只有在常温下才显中性。 100℃时显碱性
溶液的酸碱性 c(H+)和c(OH-)的关系 常温下:c(H+)= 常温下:pH
中性溶液 1×10-7mol/L
c(H+)>c(OH-)
>7
酸性溶液
碱性溶液
c(H+)=c(OH-)
>1×10-7mol/L
<7
=7
c(H+)<c(OH-)
<1×10-7mol/L
二、溶液的酸碱性与pH值
pH的测定方法
pH试纸法
(1)广泛pH试纸:测量出溶液的整数pH
使用方法:用镊子撕取一小片pH试纸放于洁净干燥的表面皿(或玻璃片)上,用洁净干燥的玻璃棒蘸取待测液点在试纸中部,待试纸显色稳定后与标准比色卡对比,读出pH。
注意:①试纸测pH值时不能用水润湿
②不能将试纸伸到溶液中
③广泛pH试纸只能读出整数
溶液的酸碱性与pH
pH的测定
广泛pH试纸
精密pH试纸
pH 计(酸度计)
提出问题
pH=5
pH=8
常温下,为什么盐酸加水稀释,pH恒小于7?
pH是c(H+)的负对数,即:pH=-lgc(H+)
实验测得:pH<7
c(H+)>1×10-7 mol/L
将1 mL 1×10-5 mol/L的盐酸,
稀释至1000 mL,
c(H+)=1×10-8 mol/L,
c(H+)=1×10-5 mol/L,
溶液稀释图像分析
无限稀释
pH趋向于7
随堂练习
1.纯水中存在电离平衡:H2O H++OH﹣。下列措施能促进水的电离的是(忽略体积变化)( )
A.加入几滴浓硫酸 B.适当加热
C.加入少量KOH固体 D.加入少量Na2SO4
解析:A. H2SO4==2H++,加入几滴浓硫酸c(H+)增大,抑制水的电离,A错误;
B.水的电离过程为吸热过程,适当加热可促进水的电离,B正确;
C.KOH==K+ +OH﹣,加入少量KOH固体c(OH﹣)增大,抑制水的电离,C错误;
D.加入少量Na2SO4是强酸强碱盐,对水的电离无影响,D错误。
B
随堂练习
1.用pH试纸测定某无色溶液的pH,正确的是( )
A.用广泛pH试纸测得该溶液的pH为3.2
B.用pH试纸蘸取溶液,观察其颜色变化并与标准比色卡对照
C.用干燥、洁净的玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照
D.用干燥、洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,所测得的pH一定偏小
用干燥、洁净玻璃棒蘸取溶液,滴在湿润的pH试纸上,测量的pH结果不一定偏低,如中性溶液氯化钠溶液的 pH不变。
广泛pH试纸的读数不会出现小数,只能读到整数
污染溶液
测得溶液 pH,操作正确。
pH试纸不能湿润,防止形成实验误差,
×
×
√
×
C
随堂练习
2.下列说法正确的是( )
A.c(H+)<c(OH﹣)的溶液一定显碱性
B.pH=6的溶液一定显酸性
C.pH=7的溶液一定显中性
D.c(OH﹣)=1×10﹣6mol/L的溶液一定显酸性
√
可能为中性,如 100℃时氯化钠溶液
×
温度未知,不能直接由 pH判断酸碱性
×
c(H+)未知,不能确定与c(H+)的关系,不能判断酸碱性。
A
×
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH(25℃)
酸性 c(H+) > c(OH-) <7
中性 c(H+) = c(OH-) =7
碱性 c(H+) < c(OH-) >7
水的电离、
溶液的酸碱性与pH
水的电离
溶液的酸碱性与pH
溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性与pH的关系
溶液稀释图像分析
水的离子积
影响水电离平衡的因素
第2节 水的电离和溶液的pH
第1课时:水的电离和溶液的 酸碱性与pH
第三章
水的导电性实验
纯水能发生微弱的电离
水的电导率测定
水的电离
水是一种极弱的电解质:
+
+
H2O + H2O H3O+ + OH-
简写为
H2O H+ + OH-
存在微粒
H+、OH-、H2O
水的电离
Kw=c(H+)·c(OH-)
1. Kw 的表达式:
特别提示:
常温时,Kw=c(H+)·c(OH-)=1×10-14
① Kw 为常数,无单位
② Kw 不仅适用于纯水,也适用于稀的电解质水溶液
③ c(H+)表示溶液中总的H+浓度,
c(OH-)表示溶液中总的OH-浓度。
当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作Kw,Kw 叫做水的离子积常数,简称水的离子积。
水的电离
影响水电离平衡的因素
T/℃ 0 10 20 25 40 50 100
Kw/10-14 0.114 0.292 0.681 1.00 2.92 5.47 55.0
KW 只受温度影响。
温度升高,水的离子积增大。
100℃下: Kw = 55×10-14 ≈ 1.0×10-12
水的电离
改变条件 平衡移动方向 电离程度 c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较
Kw
升高温度
通入少量HCl气体
加入少量NaOH(s)
加入少量
NaCl(s)
加入少量Na
增大
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
正向移动
正向移动
逆向移动
逆向移动
不移动
不变
不变
不变
不变
不变
不变
不变
大于
小于
等于
小于
等于
减小
水的电离
(1)温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
(下一节再讲)
(2)酸
(3)碱
(4)发生化学反应
促进水的电离,Kw不变
(5)能水解的盐促进水的电离
水的离子平衡的影响因素
溶液的酸碱性与pH
水的离子积 Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
1) 酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
【思考与讨论】
H2O H+ + OH-
存在
溶液的酸碱性与pH
【思考与讨论】
2)比较下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或者减小)
体系 纯水 (常温) 纯水中加入少量盐酸(常温) 纯水中加入少量NaOH溶液 (常温) 纯水
(90 ℃)
c(H+)
c(OH-)
c(H+)和c(OH-) 大小
溶液酸碱性
c(H+)>c(OH-)
1×10-7 mol/L
1×10-7 mol/L
减小
增大
c(H+)=c(OH-)
c(H+)<c(OH-)
增大
减小
c(H+)=c(OH-)
增大
增大
中性
酸性
碱性
中性
溶液的酸碱性与pH
溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性由c(H+)和c(OH-)相对大小决定
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性
酸性
碱性
常温时:KW= c(H+) · c(OH-) = 1×10-14
c(H+) =1×10-7
c(H+) >1×10-7
c(H+) <1×10-7
溶液的酸碱性与pH
pH大小与溶液的酸碱性关系 (25℃)
pH 溶液的酸碱性
pH<7 溶液呈酸性,pH越小,酸性越强
pH=7 溶液呈中性
pH>7 溶液呈碱性,pH越大,碱性越强
10-5
10-4
10-3
10-2
10-1
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
10-6
5
4
3
2
1
7
8
9
10
11
12
13
14
6
c(H+)
pH
c(H+)增大,pH减小
酸性增强
c(H+)减小,pH增大
碱性增强
溶液的酸碱性与pH
pH是c(H+)的负对数,即:pH=-lgc(H+)
■ pH的适用范围:
c(H+)和c(OH-)都较小的稀溶液(小于1 mol/L)
c(H+)=1×10-3 mol/L, pH= -lg10-3 =3
例1:1×10-3 mol/L盐酸,求溶液的pH。
pH=-lg10-10=10
c(OH-)=1×10-4 mol/L
例2: 常温下,1×10-4 mol/L NaOH溶液,求溶液的pH。
c(H+)== 1×10-10 mol/L
溶液的酸碱性与pH
pH=7的溶液一定是中性溶液吗?(以100℃ 为例)
答:不一定,只有在常温下才显中性。 100℃时显碱性
溶液的酸碱性 c(H+)和c(OH-)的关系 常温下:c(H+)= 常温下:pH
中性溶液 1×10-7mol/L
c(H+)>c(OH-)
>7
酸性溶液
碱性溶液
c(H+)=c(OH-)
>1×10-7mol/L
<7
=7
c(H+)<c(OH-)
<1×10-7mol/L
二、溶液的酸碱性与pH值
pH的测定方法
pH试纸法
(1)广泛pH试纸:测量出溶液的整数pH
使用方法:用镊子撕取一小片pH试纸放于洁净干燥的表面皿(或玻璃片)上,用洁净干燥的玻璃棒蘸取待测液点在试纸中部,待试纸显色稳定后与标准比色卡对比,读出pH。
注意:①试纸测pH值时不能用水润湿
②不能将试纸伸到溶液中
③广泛pH试纸只能读出整数
溶液的酸碱性与pH
pH的测定
广泛pH试纸
精密pH试纸
pH 计(酸度计)
提出问题
pH=5
pH=8
常温下,为什么盐酸加水稀释,pH恒小于7?
pH是c(H+)的负对数,即:pH=-lgc(H+)
实验测得:pH<7
c(H+)>1×10-7 mol/L
将1 mL 1×10-5 mol/L的盐酸,
稀释至1000 mL,
c(H+)=1×10-8 mol/L,
c(H+)=1×10-5 mol/L,
溶液稀释图像分析
无限稀释
pH趋向于7
随堂练习
1.纯水中存在电离平衡:H2O H++OH﹣。下列措施能促进水的电离的是(忽略体积变化)( )
A.加入几滴浓硫酸 B.适当加热
C.加入少量KOH固体 D.加入少量Na2SO4
解析:A. H2SO4==2H++,加入几滴浓硫酸c(H+)增大,抑制水的电离,A错误;
B.水的电离过程为吸热过程,适当加热可促进水的电离,B正确;
C.KOH==K+ +OH﹣,加入少量KOH固体c(OH﹣)增大,抑制水的电离,C错误;
D.加入少量Na2SO4是强酸强碱盐,对水的电离无影响,D错误。
B
随堂练习
1.用pH试纸测定某无色溶液的pH,正确的是( )
A.用广泛pH试纸测得该溶液的pH为3.2
B.用pH试纸蘸取溶液,观察其颜色变化并与标准比色卡对照
C.用干燥、洁净的玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照
D.用干燥、洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,所测得的pH一定偏小
用干燥、洁净玻璃棒蘸取溶液,滴在湿润的pH试纸上,测量的pH结果不一定偏低,如中性溶液氯化钠溶液的 pH不变。
广泛pH试纸的读数不会出现小数,只能读到整数
污染溶液
测得溶液 pH,操作正确。
pH试纸不能湿润,防止形成实验误差,
×
×
√
×
C
随堂练习
2.下列说法正确的是( )
A.c(H+)<c(OH﹣)的溶液一定显碱性
B.pH=6的溶液一定显酸性
C.pH=7的溶液一定显中性
D.c(OH﹣)=1×10﹣6mol/L的溶液一定显酸性
√
可能为中性,如 100℃时氯化钠溶液
×
温度未知,不能直接由 pH判断酸碱性
×
c(H+)未知,不能确定与c(H+)的关系,不能判断酸碱性。
A
×
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH(25℃)
酸性 c(H+) > c(OH-) <7
中性 c(H+) = c(OH-) =7
碱性 c(H+) < c(OH-) >7
水的电离、
溶液的酸碱性与pH
水的电离
溶液的酸碱性与pH
溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性与pH的关系
溶液稀释图像分析
水的离子积
影响水电离平衡的因素
