2.1.4 纯碱的生产历史 课件 (36张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.4 纯碱的生产历史 课件 (36张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览






文档简介
(共36张PPT)
纯碱的生产历史
碳酸钠与碳酸氢钠计算
第4课时
第一节 钠及其化合物
【研究目的】
纯碱是一种重要的化工原料,具有广泛的用途。通过查阅资料,了解纯碱的生产历史,感受化学工业发展过程中技术进步的重要性,以及建设生态文明的意义。
【材料阅读】
1.路布兰制碱法
1791年法国医生路布兰首先取得专利,以食盐为原料,制得了纯碱,称为路布兰制碱法。
(1)制取原理与步骤
①首先使氯化钠与硫酸反应,生成硫酸钠:
②然后用焦炭还原硫酸钠得硫化钠:
③最后利用硫化钠与石灰石的反应生产碳酸钠:
Na2S+CaCO3===Na2CO3+CaS。
(2)制取方法评价
路布兰制取纯碱,主要生产过程在固相中进行,难以连续生产,又需硫酸做原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵,所以在20世纪20年代被淘汰。
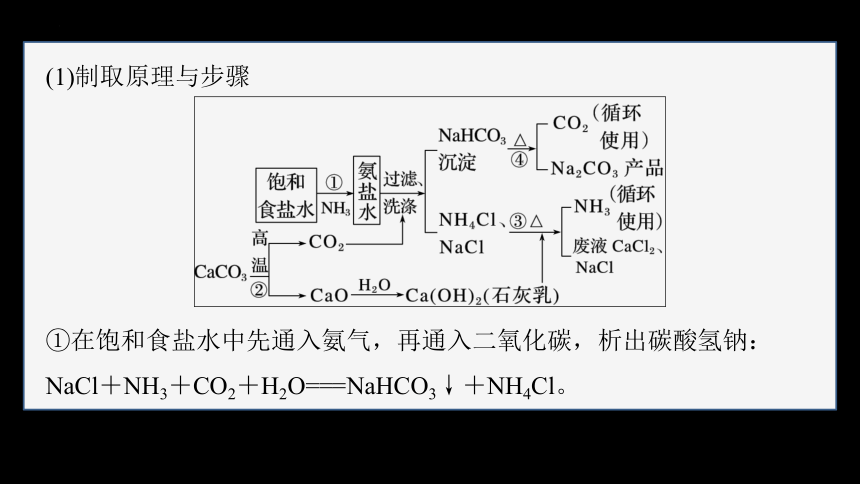
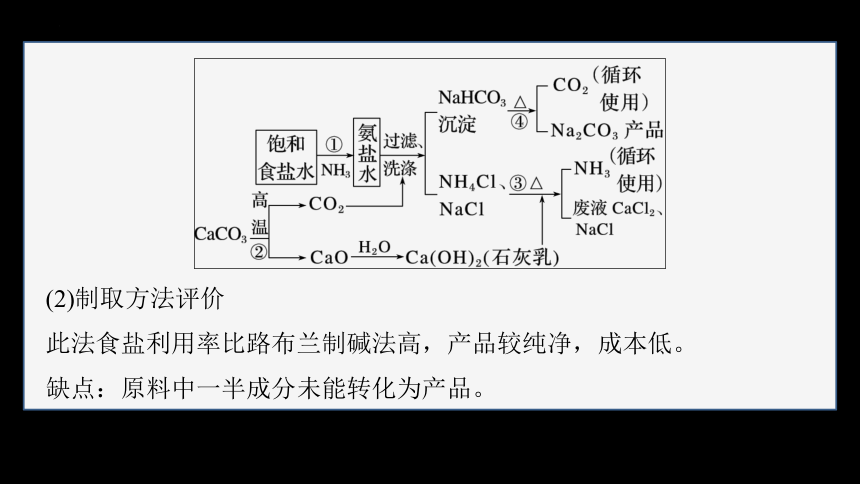
(1)制取原理与步骤
①在饱和食盐水中先通入氨气,再通入二氧化碳,析出碳酸氢钠:
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。
(2)制取方法评价
此法食盐利用率比路布兰制碱法高,产品较纯净,成本低。
缺点:原料中一半成分未能转化为产品。
3.侯氏制碱法
1943年我国化学工业科学家侯德榜发明创建了联合制碱法,即将氨碱法(又称索尔维制碱法)和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。原料是食盐、氨和二氧化碳,二氧化碳为合成氨厂用水煤气制取氢气时的废气。
(1)制取原理与步骤
①低温下先向饱和食盐水中通入氨气,然后通入二氧化碳可析出碳酸氢钠,再加入食盐细粉,因氯离子存在及低温条件使氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果相继析出NaHCO3和NH4Cl,NH3+H2O+CO2===NH4HCO3;NH4HCO3+NaCl===NH4Cl+NaHCO3↓。
(2)制取方法评价
①符合现在提倡的“绿色化学的要求”,提高了原料(NaCl)的利用率,不产生无用的CaCl2。
②利用了大规模联合生产的优越性,利用一个厂的废料,作为另一个厂的主要原料。如合成氨厂的废料CO2可以作为碱厂的主要原料;碱厂无用的Cl-可以代替价格比较昂贵的硫酸用来固定氨,制成氮肥,降低了成本,提高了综合经济效益。
【分析讨论】
1.根据所阅读资料,分析后一种制碱法与前一种制碱法相比所具有的优势是什么?
提示 氨碱法(索尔维制碱法)相比于路布兰制碱法的优点是原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
侯氏制碱法与氨碱法相比较,其优点是食盐的利用率大大提高,用等量的食盐可生产更多的纯碱,同时得到氮肥氯化铵,不再产生废渣氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
2.从生态文明建设的角度,思考侯氏制碱法的意义。
提示 减少了对环境的污染,有助于环境保护和生态文明建设,原料利用率高,产率高,降低了成本,减少了资源的浪费和能源的消耗。
【结果与讨论】
1.侯氏制碱法的反应原理能发生的原因是什么?
提示 碳酸氢钠的溶解度小,在此条件下可以生成沉淀,从而使反应发生。
2.从原材料的角度综合考虑,你认为制碱工厂可以与哪些工厂就近建设?
提示 合成氨、石灰、水泥厂等。
3.侯氏制碱法中先通入氨气至饱和再通入二氧化碳的优点是什么?
提示 氨气易溶于水,且溶于水后显碱性,有助于吸收二氧化碳,从而析出更多的碳酸氢钠。
2.索尔维制碱法
1861年比利时工程师索尔维发明的纯碱制法,是以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
碳酸钠与碳酸氢钠的相关计算
1.Na2CO3、NaHCO3与足量盐酸反应的定量关系
①生成CO2的速率 NaHCO3快
②耗酸量 等质量 Na2CO3耗酸多
相同数目 Na2CO3耗酸多
③生成CO2的体积 等质量 NaHCO3产生的多
相同数目 相等
2.质量差量法
在反应前后,物质的质量差和参加该反应的反应物或生成物的质量成正比关系。
2NaHCO3 Na2CO3+CO2↑+H2O Δm
168 g 106 g 62 g
NaHCO3受热分解时,当168 g NaHCO3反应后,固体质量减少62 g,实际参与反应的各物质的质量对应成比例。
提示 2NaHCO3 Na2CO3+CO2↑+H2O
84 g 53 g 22 g 9 g
2CO2+2Na2O2===2Na2CO3+O2
22 g 39 g 53 g
2H2O+2Na2O2===4NaOH+O2↑
9 g 39 g 40 g
综上所述,加热一段时间后,容器中的固体及质量分别是碳酸钠106 g、氢氧化钠40 g。
若将84 g碳酸氢钠和78 g过氧化钠置于密闭容器中,加热一段时间后,容器中的固体是什么?固体的质量是多少?
思考1
3.图像分析法
(1)向Na2CO3溶液中逐滴滴入盐酸
①Na2CO3+HCl===NaCl+NaHCO3,
②NaHCO3+HCl===NaCl+H2O+CO2↑。
(2)向NaHCO3溶液中逐滴滴入盐酸
NaHCO3+HCl===NaCl+H2O+CO2↑。
若向NaOH、Na2CO3混合液中滴加盐酸,依据反应的先后顺序写出相应的化学方程式,并画出CO2的体积随加入盐酸的体积变化的草图。
思考2
提示
①NaOH+HCl===NaCl+H2O,
②Na2CO3+HCl===NaCl+NaHCO3,
③NaHCO3+HCl===NaCl+H2O+CO2↑。
已知:①纯净的碳酸钠a g;②碳酸钠与碳酸氢钠的混合物a g。关于两者的比较,下列描述正确的是
A.分别和盐酸完全反应时,混合物的耗酸量大
B.分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多
C.分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大
D.分别配成溶液,混合物溶液中的Na+个数多
练习1
√
相同质量的Na2CO3比NaHCO3耗酸量要多,但是产生的CO2要少,A、B项错误;
相同质量的两组物质,混合物含的碳元素较多,故最终转化成CaCO3沉淀的质量就大,C项正确;
Na2CO3中钠元素的质量分数高于NaHCO3,故相同质量的Na2CO3比NaHCO3所含Na+的数目多,D项错误。
把Na2CO3和NaHCO3的混合物27.4 g加热到质量不再变化时,得残留固体21.2 g。求原混合物中NaHCO3和Na2CO3的质量之比为
A.53∶84 B.84∶53
C.1∶1 D.42∶53
练习2
√
设NaHCO3的质量为x g,则根据化学方程式可知:
2NaHCO3 Na2CO3+CO2↑+H2O Δm
168 62
x g (27.4-21.2) g=6.2 g
x=168× =16.8,
混合物中碳酸钠的质量是27.4 g-16.8 g=10.6 g,所以原混合物中NaHCO3与Na2CO3的质量之比为16.8∶10.6=84∶53。
1.要除去碳酸氢钠溶液中混有的少量碳酸钠,最好采用
A.加入过量的澄清石灰水
B.通入足量的CO2气体
C.将溶液加热蒸干并灼烧
D.加入适量的氢氧化钠溶液
√
1
2
3
自我测试
4
澄清石灰水和碳酸钠、碳酸氢钠均发生反应,生成碳酸钙沉淀,故A错误;
可以通入足量二氧化碳使碳酸钠转化为碳酸氢钠而除去,反应的化学方程式为Na2CO3+CO2+H2O===2NaHCO3,并且二氧化碳和碳酸氢钠之间不会发生反应,故B正确;
将溶液加热蒸干并灼烧,可使碳酸氢钠分解生成碳酸钠,故C错误;
氢氧化钠和碳酸氢钠反应生成碳酸钠和水,故D错误。
1
2
3
自我测试
4
2.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为
A.2∶1 B.1∶1
C.1∶2 D.4∶1
√
自我测试
1
2
3
本题可从钠元素守恒的角度考虑。无论NaHCO3是直接与盐酸反应,还是先加热分解再与盐酸反应,Na的量不变,生成NaCl的量相等,则消耗盐酸的量相等。
4
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3溶液
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3溶液
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3溶液
D 逐滴加入等浓度的NaOH溶液 无明显现象的是Na2CO3溶液
3.(2022·上海市宜川中学高一期末)有分别装有Na2CO3溶液和NaHCO3溶液的两试管,下列操作或判断正确的是
自我测试
1
2
3
√
4
自我测试
1
2
3
碳酸钠和碳酸氢钠均与Ca(OH)2反应产生沉淀,故不能鉴别二者,故A错误;
向Na2CO3中逐滴加入盐酸时,先无气体产生,当盐酸加入较多时,可产生气体,而向NaHCO3中加入同浓度盐酸,则迅速产生气体,产生气体较为剧烈的为碳酸氢钠,故B错误;
碳酸钠与氯化钙反应产生碳酸钙沉淀,碳酸氢钠与氯化钙不反应,故氯化钙溶液可以区分二者,故C正确;
NaHCO3与NaOH溶液反应生成碳酸钠和水也无现象,故D错误。
4
(1)溶液中所含溶质为________________。
(2)OA段发生反应的离子方程式:____________________________________。
AB段发生反应的离子方程式:__________________________。
4.将一定体积的CO2通入一定浓度的NaOH溶液中,为了测定所得溶液的成分,向该溶液中逐滴加入盐酸,所加盐酸的体积与产生CO2的体积的关系如图所示:
NaOH、Na2CO3
自我测试
1
2
3
4
H++OH-===H2O、
OA段碳酸钠消耗20 mL盐酸,所以,前5 mL应该是盐酸与氢氧化钠发生中和反应;OA段H+先与OH-反应生成H2O,待OH-消耗完,H+再与
反应生成
由图中消耗盐酸的体积与产生CO2的体积可知,该溶液的溶质是NaOH和Na2CO3,碳酸根离子转化为碳酸氢根离子和碳酸氢根离子转化为二氧化碳消耗的盐酸是等量的,
自我测试
1
2
3
4
纯碱的生产历史
碳酸钠与碳酸氢钠计算
第4课时
第一节 钠及其化合物
【研究目的】
纯碱是一种重要的化工原料,具有广泛的用途。通过查阅资料,了解纯碱的生产历史,感受化学工业发展过程中技术进步的重要性,以及建设生态文明的意义。
【材料阅读】
1.路布兰制碱法
1791年法国医生路布兰首先取得专利,以食盐为原料,制得了纯碱,称为路布兰制碱法。
(1)制取原理与步骤
①首先使氯化钠与硫酸反应,生成硫酸钠:
②然后用焦炭还原硫酸钠得硫化钠:
③最后利用硫化钠与石灰石的反应生产碳酸钠:
Na2S+CaCO3===Na2CO3+CaS。
(2)制取方法评价
路布兰制取纯碱,主要生产过程在固相中进行,难以连续生产,又需硫酸做原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵,所以在20世纪20年代被淘汰。
(1)制取原理与步骤
①在饱和食盐水中先通入氨气,再通入二氧化碳,析出碳酸氢钠:
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。
(2)制取方法评价
此法食盐利用率比路布兰制碱法高,产品较纯净,成本低。
缺点:原料中一半成分未能转化为产品。
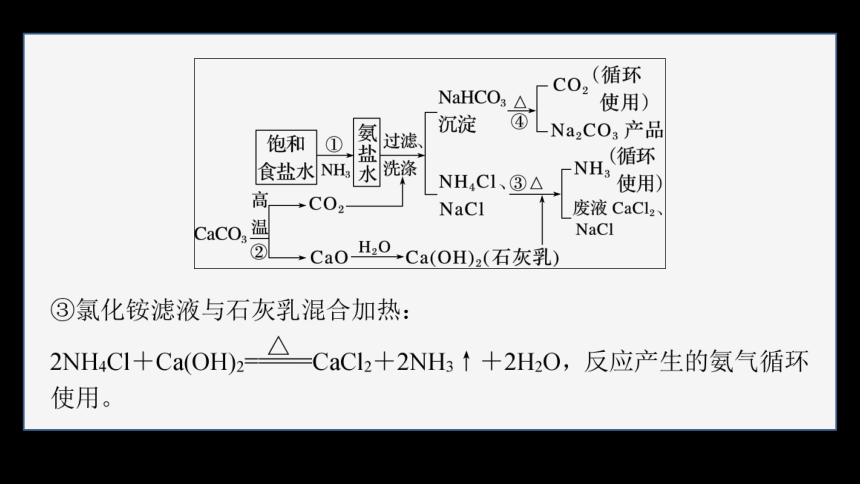
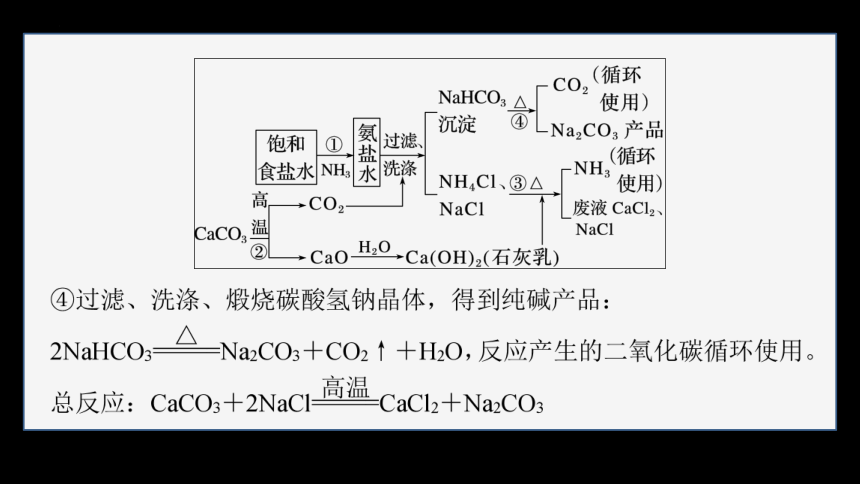
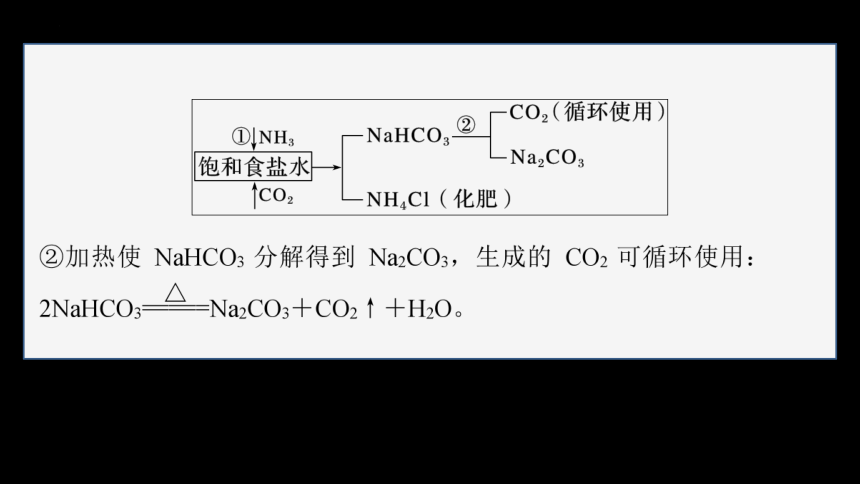
3.侯氏制碱法
1943年我国化学工业科学家侯德榜发明创建了联合制碱法,即将氨碱法(又称索尔维制碱法)和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。原料是食盐、氨和二氧化碳,二氧化碳为合成氨厂用水煤气制取氢气时的废气。
(1)制取原理与步骤
①低温下先向饱和食盐水中通入氨气,然后通入二氧化碳可析出碳酸氢钠,再加入食盐细粉,因氯离子存在及低温条件使氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果相继析出NaHCO3和NH4Cl,NH3+H2O+CO2===NH4HCO3;NH4HCO3+NaCl===NH4Cl+NaHCO3↓。
(2)制取方法评价
①符合现在提倡的“绿色化学的要求”,提高了原料(NaCl)的利用率,不产生无用的CaCl2。
②利用了大规模联合生产的优越性,利用一个厂的废料,作为另一个厂的主要原料。如合成氨厂的废料CO2可以作为碱厂的主要原料;碱厂无用的Cl-可以代替价格比较昂贵的硫酸用来固定氨,制成氮肥,降低了成本,提高了综合经济效益。
【分析讨论】
1.根据所阅读资料,分析后一种制碱法与前一种制碱法相比所具有的优势是什么?
提示 氨碱法(索尔维制碱法)相比于路布兰制碱法的优点是原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
侯氏制碱法与氨碱法相比较,其优点是食盐的利用率大大提高,用等量的食盐可生产更多的纯碱,同时得到氮肥氯化铵,不再产生废渣氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
2.从生态文明建设的角度,思考侯氏制碱法的意义。
提示 减少了对环境的污染,有助于环境保护和生态文明建设,原料利用率高,产率高,降低了成本,减少了资源的浪费和能源的消耗。
【结果与讨论】
1.侯氏制碱法的反应原理能发生的原因是什么?
提示 碳酸氢钠的溶解度小,在此条件下可以生成沉淀,从而使反应发生。
2.从原材料的角度综合考虑,你认为制碱工厂可以与哪些工厂就近建设?
提示 合成氨、石灰、水泥厂等。
3.侯氏制碱法中先通入氨气至饱和再通入二氧化碳的优点是什么?
提示 氨气易溶于水,且溶于水后显碱性,有助于吸收二氧化碳,从而析出更多的碳酸氢钠。
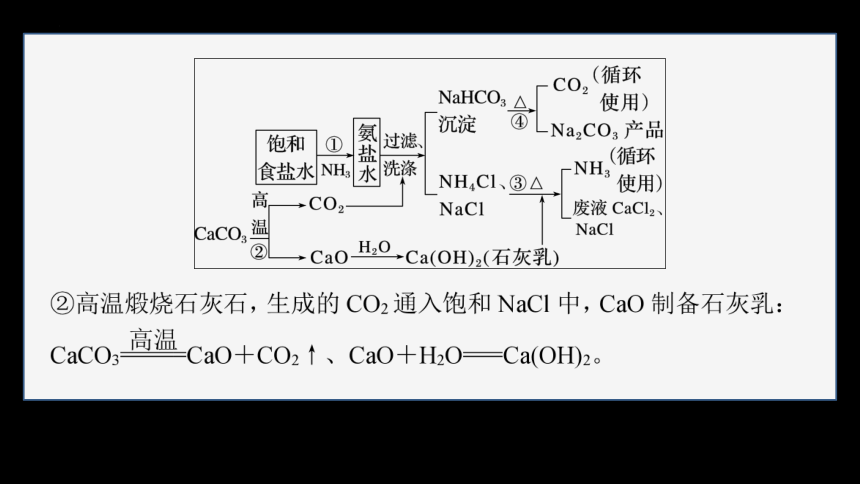
2.索尔维制碱法
1861年比利时工程师索尔维发明的纯碱制法,是以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
碳酸钠与碳酸氢钠的相关计算
1.Na2CO3、NaHCO3与足量盐酸反应的定量关系
①生成CO2的速率 NaHCO3快
②耗酸量 等质量 Na2CO3耗酸多
相同数目 Na2CO3耗酸多
③生成CO2的体积 等质量 NaHCO3产生的多
相同数目 相等
2.质量差量法
在反应前后,物质的质量差和参加该反应的反应物或生成物的质量成正比关系。
2NaHCO3 Na2CO3+CO2↑+H2O Δm
168 g 106 g 62 g
NaHCO3受热分解时,当168 g NaHCO3反应后,固体质量减少62 g,实际参与反应的各物质的质量对应成比例。
提示 2NaHCO3 Na2CO3+CO2↑+H2O
84 g 53 g 22 g 9 g
2CO2+2Na2O2===2Na2CO3+O2
22 g 39 g 53 g
2H2O+2Na2O2===4NaOH+O2↑
9 g 39 g 40 g
综上所述,加热一段时间后,容器中的固体及质量分别是碳酸钠106 g、氢氧化钠40 g。
若将84 g碳酸氢钠和78 g过氧化钠置于密闭容器中,加热一段时间后,容器中的固体是什么?固体的质量是多少?
思考1
3.图像分析法
(1)向Na2CO3溶液中逐滴滴入盐酸
①Na2CO3+HCl===NaCl+NaHCO3,
②NaHCO3+HCl===NaCl+H2O+CO2↑。
(2)向NaHCO3溶液中逐滴滴入盐酸
NaHCO3+HCl===NaCl+H2O+CO2↑。
若向NaOH、Na2CO3混合液中滴加盐酸,依据反应的先后顺序写出相应的化学方程式,并画出CO2的体积随加入盐酸的体积变化的草图。
思考2
提示
①NaOH+HCl===NaCl+H2O,
②Na2CO3+HCl===NaCl+NaHCO3,
③NaHCO3+HCl===NaCl+H2O+CO2↑。
已知:①纯净的碳酸钠a g;②碳酸钠与碳酸氢钠的混合物a g。关于两者的比较,下列描述正确的是
A.分别和盐酸完全反应时,混合物的耗酸量大
B.分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多
C.分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大
D.分别配成溶液,混合物溶液中的Na+个数多
练习1
√
相同质量的Na2CO3比NaHCO3耗酸量要多,但是产生的CO2要少,A、B项错误;
相同质量的两组物质,混合物含的碳元素较多,故最终转化成CaCO3沉淀的质量就大,C项正确;
Na2CO3中钠元素的质量分数高于NaHCO3,故相同质量的Na2CO3比NaHCO3所含Na+的数目多,D项错误。
把Na2CO3和NaHCO3的混合物27.4 g加热到质量不再变化时,得残留固体21.2 g。求原混合物中NaHCO3和Na2CO3的质量之比为
A.53∶84 B.84∶53
C.1∶1 D.42∶53
练习2
√
设NaHCO3的质量为x g,则根据化学方程式可知:
2NaHCO3 Na2CO3+CO2↑+H2O Δm
168 62
x g (27.4-21.2) g=6.2 g
x=168× =16.8,
混合物中碳酸钠的质量是27.4 g-16.8 g=10.6 g,所以原混合物中NaHCO3与Na2CO3的质量之比为16.8∶10.6=84∶53。
1.要除去碳酸氢钠溶液中混有的少量碳酸钠,最好采用
A.加入过量的澄清石灰水
B.通入足量的CO2气体
C.将溶液加热蒸干并灼烧
D.加入适量的氢氧化钠溶液
√
1
2
3
自我测试
4
澄清石灰水和碳酸钠、碳酸氢钠均发生反应,生成碳酸钙沉淀,故A错误;
可以通入足量二氧化碳使碳酸钠转化为碳酸氢钠而除去,反应的化学方程式为Na2CO3+CO2+H2O===2NaHCO3,并且二氧化碳和碳酸氢钠之间不会发生反应,故B正确;
将溶液加热蒸干并灼烧,可使碳酸氢钠分解生成碳酸钠,故C错误;
氢氧化钠和碳酸氢钠反应生成碳酸钠和水,故D错误。
1
2
3
自我测试
4
2.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为
A.2∶1 B.1∶1
C.1∶2 D.4∶1
√
自我测试
1
2
3
本题可从钠元素守恒的角度考虑。无论NaHCO3是直接与盐酸反应,还是先加热分解再与盐酸反应,Na的量不变,生成NaCl的量相等,则消耗盐酸的量相等。
4
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3溶液
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3溶液
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3溶液
D 逐滴加入等浓度的NaOH溶液 无明显现象的是Na2CO3溶液
3.(2022·上海市宜川中学高一期末)有分别装有Na2CO3溶液和NaHCO3溶液的两试管,下列操作或判断正确的是
自我测试
1
2
3
√
4
自我测试
1
2
3
碳酸钠和碳酸氢钠均与Ca(OH)2反应产生沉淀,故不能鉴别二者,故A错误;
向Na2CO3中逐滴加入盐酸时,先无气体产生,当盐酸加入较多时,可产生气体,而向NaHCO3中加入同浓度盐酸,则迅速产生气体,产生气体较为剧烈的为碳酸氢钠,故B错误;
碳酸钠与氯化钙反应产生碳酸钙沉淀,碳酸氢钠与氯化钙不反应,故氯化钙溶液可以区分二者,故C正确;
NaHCO3与NaOH溶液反应生成碳酸钠和水也无现象,故D错误。
4
(1)溶液中所含溶质为________________。
(2)OA段发生反应的离子方程式:____________________________________。
AB段发生反应的离子方程式:__________________________。
4.将一定体积的CO2通入一定浓度的NaOH溶液中,为了测定所得溶液的成分,向该溶液中逐滴加入盐酸,所加盐酸的体积与产生CO2的体积的关系如图所示:
NaOH、Na2CO3
自我测试
1
2
3
4
H++OH-===H2O、
OA段碳酸钠消耗20 mL盐酸,所以,前5 mL应该是盐酸与氢氧化钠发生中和反应;OA段H+先与OH-反应生成H2O,待OH-消耗完,H+再与
反应生成
由图中消耗盐酸的体积与产生CO2的体积可知,该溶液的溶质是NaOH和Na2CO3,碳酸根离子转化为碳酸氢根离子和碳酸氢根离子转化为二氧化碳消耗的盐酸是等量的,
自我测试
1
2
3
4
