1.2.2 核外电子排布与元素周期表(共21张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 1.2.2 核外电子排布与元素周期表(共21张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 808.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 21:02:42 | ||
图片预览







文档简介
(共21张PPT)
第一章原子结构与元素性质
第2节原子结构与元素周期表
第2课时 核外电子排布与元素周期表
写出下列元素的基态原子的核外电子排布式。
①钪Sc ②钛Ti ③钒V ④铬 Cr ⑤锰Mn ⑥铁 Fe ⑦钴 Co ⑧镍Ni ⑨ 铜 Cu ⑩锌 Zn
①Sc 1s22s22p63s23p63d14s2; ②Ti 1s22s22p63s23p63d24s2;
③V 1s22s22p63s23p63d34s2; ④Cr 1s22s22p63s23p63d54s1;
⑤Mn 1s22s22p63s23p63d54s2 ;⑥Fe 1s22s22p63s23p63d64s2;
⑦Co 1s22s22p63s23p63d74s2 ;⑧Ni 1s22s22p63s23p63d84s2;
⑨Cu 1s22s22p63s23p63d104s1 ;⑩Zn 1s22s22p63s23p63d104s2。
课前练习
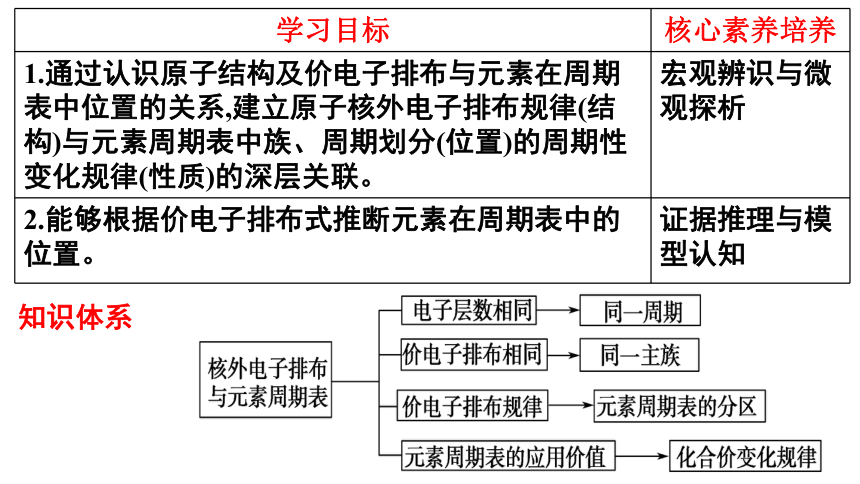
学习目标 核心素养培养
1.通过认识原子结构及价电子排布与元素在周期表中位置的关系,建立原子核外电子排布规律(结构)与元素周期表中族、周期划分(位置)的周期性变化规律(性质)的深层关联。 宏观辨识与微观探析
2.能够根据价电子排布式推断元素在周期表中的位置。 证据推理与模型认知
知识体系
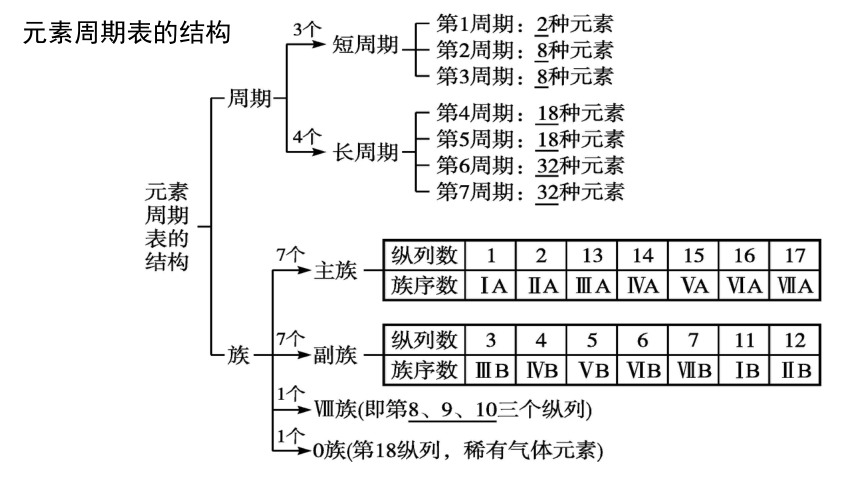
元素周期表的结构
原子核外的电子排布、原子轨道的能级与周期表之间有什么样的关系?
活动探究
阅读课本第15-16页,了解鲍林近似能级图,能级组与元素周期表的周期之间的对应关系,同一能级组和不同能级组间的能量关系。
价电子的概念,主族元素和过渡元素的原子的价电子的组成,价电子的表示方法。
原子核外的电子排布与周期表的周期划分的本质联系,周期与量子数n的关系。
1、核外电子排布与周期的划分
⑴鲍林近似能级图与周期
二、核外电子排布与元素周期表
⑶周期数与电子层数的关系
⑵原子核外电子排布与元素周期表中周期划分的本质联系
元素种数
周期数=最外层电子所在轨道所处的 。
电子层数
阅读课本第16页,了解核外电子排布与周期表中族的内在联系;每个族中价电子排布的特点,元素周期表的分组。
⑵特点
一般来说,同族元素原子的价电子数目相同。
2、核外电子排布与族的划分
⑴划分依据:
族的划分与原子的价电子数目和价电子排布密切相关。
(3)稀有气体→最外层电子排布:ns2np6(He除外)。
⑶规律
①主族元素:
主族元素族序数=价电子数,价电子电子排布:ns1~2或ns2np1~5。
②过渡元素:
ⅠB~ⅡB族序数=ns电子数,ⅢB~ⅦB族序数=价电子数;
价电子排布:(n-1)d1~10ns1~2。
⑷核外电子排布与元素周期表的分区
按核外电子排布式中最后填入电子的能级符号可将元素周期表(ⅠB族、ⅡB族除外)分为s、p、d、f 4个区,而ⅠB族、ⅡB族这2个纵列的元素原子的核外电子因先填充满(n-1)d能级而后再填充ns能级而得名ds区。5个区的位置关系如图所示。
阅读课本第17~18页,了解元素化合价与原子核外电子排布尤其是价电子排布的密切关系;主族元素的最高化合价与价电子排布的关系;稀有气体元素的化合价和电子层结构的关系。
阅读《拓展视野》核外电子排布与元素周期表的分区,
②非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8。
⑸元素化合价与价电子排布的关系
①除Ⅷ族、ⅠB族的某些元素和0族元素外,(主族)元素的最高化合价等于所在的族序数。
③稀有气体元素原子的电子层结构是稳定结构,因此稀有气体元素的化合价在通常情况下为0。
1.指出下列元素在周期表中的位置:
(1)基态原子的电子排布式为1s22s22p63s23p64s1的元素:
第___周期、____族。
(2)基态原子的电子排布式为1s22s22p63s23p63d34s2的元素:
第____周期、____族。
(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素:
第_____周期、_____族。
(4)基态原子的电子排布式为1s22s22p63s23p5的元素:
第_____周期、_____族。
4
ⅠA
4
ⅤB
4
ⅠB
3
ⅦA
2.下列说法不正确的是( )
A.某基态原子外围电子排布式为4f75d16s2,该元素位于周期表中第6周期ⅢB族
B.在元素周期表中,s区、d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布由 转变为
时,释放能量,由激发态转化成基态。
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
B
3.已知某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,则该元素在元素周期表中的位置是( )
A.第3周期Ⅷ族,p区
B.第3周期ⅤB族,ds区
C.第4周期Ⅷ族,d区
D.第4周期ⅤB族,f区
C
4.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素一定是ⅠA族元素
B.基态原子的价电子排布式为(n-1)d10ns2的元素一定是副族元素
C.基态原子的p能级半充满的元素一定位于p区
D.基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
BC
5.(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第________周期________族;最高价氧化物的化学式为__________,砷酸钠的化学式是________。
(2)已知下列元素在周期表中的位置,写出它们价电子排布式和元素符号:
①第4周期ⅣB族____________、___________;
②第5周期ⅦA族____________、___________。
4
ⅤA
As2O5
Na3AsO4
3d24s2
Ti
5s25p5
I
6.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区
C.f区、p区、ds区 D.s区、f区、ds区
A
7.具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )
A.两种元素原子的电子层上全部都是s电子
B.3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子
C.最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子
D.原子核外的M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子
B
8.甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:
(1)甲的元素符号是________;其轨道表示式为________________。
(2)乙元素原子的最外层电子排布式为________,其在元素周期表中的位置是______________。
(3)甲属于________区元素,乙属于______区元素。
C
4s24p3
第4周期ⅤA族
p
p
课下学习:
①阅读课本,掌握本节课的知识内容,预习原子轨道的图形描述;
②课本练习第18~19页1~8题;
第一章原子结构与元素性质
第2节原子结构与元素周期表
第2课时 核外电子排布与元素周期表
写出下列元素的基态原子的核外电子排布式。
①钪Sc ②钛Ti ③钒V ④铬 Cr ⑤锰Mn ⑥铁 Fe ⑦钴 Co ⑧镍Ni ⑨ 铜 Cu ⑩锌 Zn
①Sc 1s22s22p63s23p63d14s2; ②Ti 1s22s22p63s23p63d24s2;
③V 1s22s22p63s23p63d34s2; ④Cr 1s22s22p63s23p63d54s1;
⑤Mn 1s22s22p63s23p63d54s2 ;⑥Fe 1s22s22p63s23p63d64s2;
⑦Co 1s22s22p63s23p63d74s2 ;⑧Ni 1s22s22p63s23p63d84s2;
⑨Cu 1s22s22p63s23p63d104s1 ;⑩Zn 1s22s22p63s23p63d104s2。
课前练习
学习目标 核心素养培养
1.通过认识原子结构及价电子排布与元素在周期表中位置的关系,建立原子核外电子排布规律(结构)与元素周期表中族、周期划分(位置)的周期性变化规律(性质)的深层关联。 宏观辨识与微观探析
2.能够根据价电子排布式推断元素在周期表中的位置。 证据推理与模型认知
知识体系
元素周期表的结构
原子核外的电子排布、原子轨道的能级与周期表之间有什么样的关系?
活动探究
阅读课本第15-16页,了解鲍林近似能级图,能级组与元素周期表的周期之间的对应关系,同一能级组和不同能级组间的能量关系。
价电子的概念,主族元素和过渡元素的原子的价电子的组成,价电子的表示方法。
原子核外的电子排布与周期表的周期划分的本质联系,周期与量子数n的关系。
1、核外电子排布与周期的划分
⑴鲍林近似能级图与周期
二、核外电子排布与元素周期表
⑶周期数与电子层数的关系
⑵原子核外电子排布与元素周期表中周期划分的本质联系
元素种数
周期数=最外层电子所在轨道所处的 。
电子层数
阅读课本第16页,了解核外电子排布与周期表中族的内在联系;每个族中价电子排布的特点,元素周期表的分组。
⑵特点
一般来说,同族元素原子的价电子数目相同。
2、核外电子排布与族的划分
⑴划分依据:
族的划分与原子的价电子数目和价电子排布密切相关。
(3)稀有气体→最外层电子排布:ns2np6(He除外)。
⑶规律
①主族元素:
主族元素族序数=价电子数,价电子电子排布:ns1~2或ns2np1~5。
②过渡元素:
ⅠB~ⅡB族序数=ns电子数,ⅢB~ⅦB族序数=价电子数;
价电子排布:(n-1)d1~10ns1~2。
⑷核外电子排布与元素周期表的分区
按核外电子排布式中最后填入电子的能级符号可将元素周期表(ⅠB族、ⅡB族除外)分为s、p、d、f 4个区,而ⅠB族、ⅡB族这2个纵列的元素原子的核外电子因先填充满(n-1)d能级而后再填充ns能级而得名ds区。5个区的位置关系如图所示。
阅读课本第17~18页,了解元素化合价与原子核外电子排布尤其是价电子排布的密切关系;主族元素的最高化合价与价电子排布的关系;稀有气体元素的化合价和电子层结构的关系。
阅读《拓展视野》核外电子排布与元素周期表的分区,
②非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8。
⑸元素化合价与价电子排布的关系
①除Ⅷ族、ⅠB族的某些元素和0族元素外,(主族)元素的最高化合价等于所在的族序数。
③稀有气体元素原子的电子层结构是稳定结构,因此稀有气体元素的化合价在通常情况下为0。
1.指出下列元素在周期表中的位置:
(1)基态原子的电子排布式为1s22s22p63s23p64s1的元素:
第___周期、____族。
(2)基态原子的电子排布式为1s22s22p63s23p63d34s2的元素:
第____周期、____族。
(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素:
第_____周期、_____族。
(4)基态原子的电子排布式为1s22s22p63s23p5的元素:
第_____周期、_____族。
4
ⅠA
4
ⅤB
4
ⅠB
3
ⅦA
2.下列说法不正确的是( )
A.某基态原子外围电子排布式为4f75d16s2,该元素位于周期表中第6周期ⅢB族
B.在元素周期表中,s区、d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布由 转变为
时,释放能量,由激发态转化成基态。
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
B
3.已知某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,则该元素在元素周期表中的位置是( )
A.第3周期Ⅷ族,p区
B.第3周期ⅤB族,ds区
C.第4周期Ⅷ族,d区
D.第4周期ⅤB族,f区
C
4.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素一定是ⅠA族元素
B.基态原子的价电子排布式为(n-1)d10ns2的元素一定是副族元素
C.基态原子的p能级半充满的元素一定位于p区
D.基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
BC
5.(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第________周期________族;最高价氧化物的化学式为__________,砷酸钠的化学式是________。
(2)已知下列元素在周期表中的位置,写出它们价电子排布式和元素符号:
①第4周期ⅣB族____________、___________;
②第5周期ⅦA族____________、___________。
4
ⅤA
As2O5
Na3AsO4
3d24s2
Ti
5s25p5
I
6.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区
C.f区、p区、ds区 D.s区、f区、ds区
A
7.具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )
A.两种元素原子的电子层上全部都是s电子
B.3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子
C.最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子
D.原子核外的M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子
B
8.甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:
(1)甲的元素符号是________;其轨道表示式为________________。
(2)乙元素原子的最外层电子排布式为________,其在元素周期表中的位置是______________。
(3)甲属于________区元素,乙属于______区元素。
C
4s24p3
第4周期ⅤA族
p
p
课下学习:
①阅读课本,掌握本节课的知识内容,预习原子轨道的图形描述;
②课本练习第18~19页1~8题;
