1.3.1 原子半径、电离能及其变化规律(共22张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 1.3.1 原子半径、电离能及其变化规律(共22张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 21:03:57 | ||
图片预览






文档简介
(共22张PPT)
第一章 原子结构与元素性质
第3节 元素的性质及其变化规律
第1课时 原子半径、电离能及其变化规律
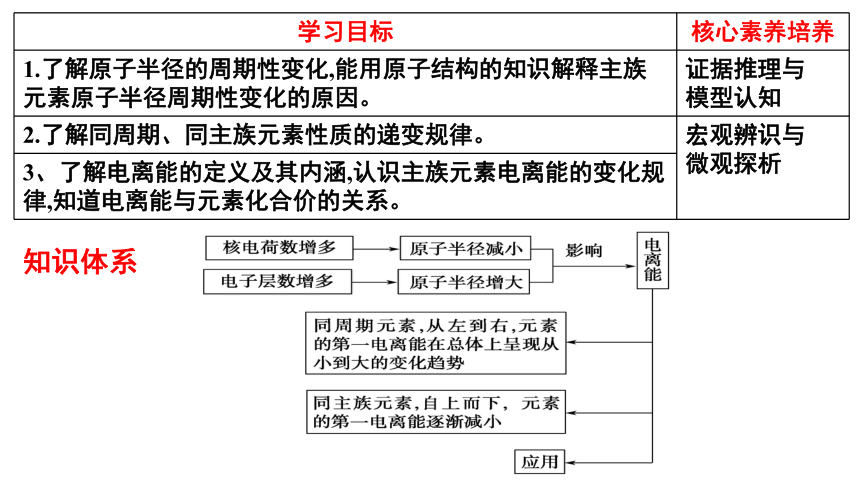
学习目标 核心素养培养
1.了解原子半径的周期性变化,能用原子结构的知识解释主族元素原子半径周期性变化的原因。 证据推理与
模型认知
2.了解同周期、同主族元素性质的递变规律。 宏观辨识与
微观探析
3、了解电离能的定义及其内涵,认识主族元素电离能的变化规律,知道电离能与元素化合价的关系。 知识体系
阅读课本第20页《追根寻源》,了解原子半径的定义和测定方法。
阅读学习
阅读课本第21页,原子半径的变化规律及变化原因。
假定原子是一个实心球体,用统计方法测定的半径。
利用核间距法测得几种形式的原子半径:①共价半径①金属半径③范得华半径
一般有下列关系:
范得华半径>金属半径>共价半径
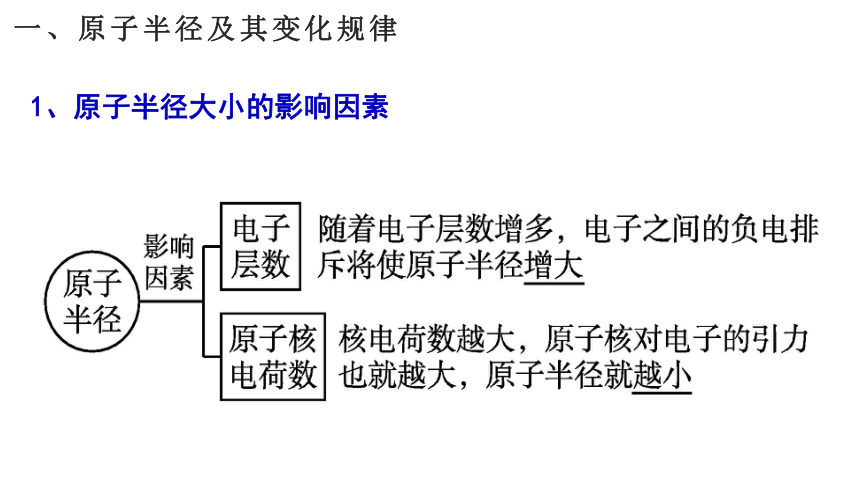
一、原子半径及其变化规律
1、原子半径大小的影响因素
(1)主族元素
2.原子半径的周期性变化规律:
同一周期从左到右,增加电子产生的电子间的排斥作用小于核电荷数增大导致原子核对外层电子的吸引作用,使原子半径逐渐减小。
同一主族从上到下,核电荷数增大对外层电子的吸引作用小于增加电子间的排斥作用,使原子半径逐渐增大。
同一周期过渡元素自左至右原子半径逐渐减小,但变化幅度不大。原因是同一周期过渡元素增加的电子一般分布在内层d轨道或f轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
(2)过渡元素
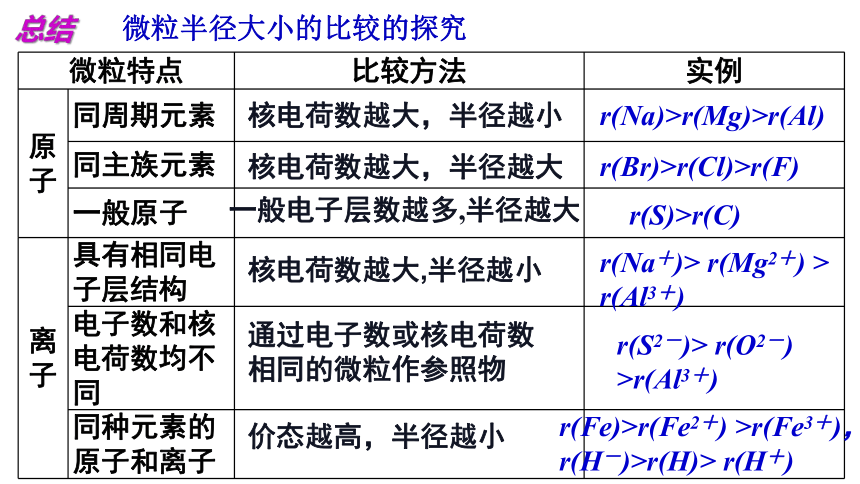
总结
微粒半径大小的比较的探究
微粒特点 比较方法 实例
原子 同周期元素
同主族元素
一般原子
离 子 具有相同电子层结构
电子数和核电荷数均不同
同种元素的原子和离子
核电荷数越大,半径越小
核电荷数越大,半径越大
一般电子层数越多,半径越大
r(Na)>r(Mg)>r(Al)
r(Br)>r(Cl)>r(F)
r(S)>r(C)
核电荷数越大,半径越小
通过电子数或核电荷数相同的微粒作参照物
价态越高,半径越小
r(Na+)> r(Mg2+) > r(Al3+)
r(S2-)> r(O2-) >r(Al3+)
r(Fe)>r(Fe2+) >r(Fe3+),
r(H-)>r(H)> r(H+)
1、下列微粒半径大小比较正确的是( )
A.Na+Cl->Na+>Al3+
C.NaB
2、已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>d B.离子的还原性Y2-C.氢化物的稳定性H2Y>HZ D.原子半径X>W
D
(1)同周期主族元素原子的电子层数相同,从左到右原子半径逐渐减小,原子核对外层电子的吸引作用逐渐增强。因此,同一周期主族元素从左到右,元素原子失去电子的能力越来越弱,获得电子的能力越来越强。
(2)同主族元素原子的价电子数相同,但自上而下原子半径逐渐增大,原子核对外层电子的吸引作用逐渐减弱。因此,自上而下,金属元素原子失去电子的能力越来越强,非金属元素原子获得电子的能力越来越弱。
3.元素原子得失电子的能力
同周期元素和同主族元素原子结构递变的综合结果是:位于元素周期表中金属元素与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
在科学研究和生产实践中,仅有定性的分析往往是不够的,为此人们用电离能、电负性来定量的衡量或比较原子得失电子能力的强弱。
阅读课本第22页内容,了解电离能的概念和含义,分析电离能描述的是元素的哪种性质?并分析第一电离能的数值和性质的关系?
阅读学习
二、元素的电离能及其变化规律
M(g)= M+ (g) + e- I1(第一电离能)
M+(g)= M2+ (g) + e- I2(第二电离能)
M2+(g)= M3+ (g) + e- I3(第三电离能)
1.定义:
气态基态原子或气态基态离子失去一个电子所需要的最小能量叫做电离能。
2.符号:I 单位:kJ/mol
3、表示式:
4、电离能的意义:
表示气态原子失去电子难易程度的物理量。
第一电离能:处于基态的气态原子失去一个电子转化为正一价气态离子所需要的能量叫做第一电离能。元素第一电离能符号:I1。
第二电离能:气态正一价离子再失去一个电子成为气态正二价离子所需的能量叫做第二电离能;第三电离能和第四、第五电离能依此类推。
通常情况下,第一电离能 第二电离能 第三电离能……
小于
小于
I2
I1
I3
Be的电离能
5、逐级电离能:
6、影响电离能大小因素
⑴核电荷数
电子层数相同,核电荷数越多、半径越小、核对外层电子引力越大、越不易失去电子,电离能越大。
⑵原子半径
同族原子半径越大、原子核对外层电子的引力越小,越易失电子,电离能越小。
⑶电子层结构
稳定的8电子结构(同周期末层)电离能最大。
阅读课本第23-24页内容,分析总结元素原子的第一电离能随元素原子序数的递增而变化的规律,并从原子结构的角度解释。
7、元素第一电离能变化规律
⑴金属元素的第一电离能都较小,非金属元素和稀有气体元素的第一电离能都较大。
⑵同一周期元素的第一电离能,从左到右总体上是呈增大趋势。同一主族元素的第一电离能 从上到下逐渐减小。
⑶过渡元素第一电离能变化不太大。
1.金属元素的第一电离能都较小,非金属元素和稀有气体元素的第一电离能都较大。为什么?
交流研讨:
如何从从原子结构的角度解释电离能的变化规律?
2.同一周期元素的第一电离能从左到右呈增大趋势。为什么?
3.同一主族元素的第一电离能从上到下逐渐减小。为什么?
He
Ne
Ar
H
Li
Na
Be
B
C
N
O
F
Mg
Al
Si
P
S
Cl
短周期元素的第一电离能
4.在第二周期中Be和N元素及第三周期中Mg和P的第一电离能大于相邻的元素的第一电离能。为什么?
阅读课本第23~24页《追根寻源》和《拓展视野》栏目,了解金属活动性顺序和电离能为什么不一致?什么是电子亲和能?含义是什么?受哪些因素影响?
都表示原子失去电子的能力,但是具体条件不同。
电子亲和能的大小反映了气态原子获得电子成为气态阴离子的难易程度。取决于原子核对外层电子的吸引力以及电子之间的排斥两个因素。
结论:
第一电离能的周期性变化规律与原子半径和核外电子排布的周期性变化密切相关。
8、电离能的应用:
⑶利用逐级电离能判断化合价,判断原子失去电子的数目或形成的阳离子的电荷。
如K: I1 I2<I3 ,表明K原子容易失去一个电子形成+1价阳离子。
⑴确定核外电子排布。
如Li:I1 I2<I3,表明Li核外3个电子排布K、L层,最外层只1个电子。
⑵判断元素性质强弱或判断金属原子在气态时失电子的难易程度。I1 越大,元素非金属性越强;I1 越小,元素金属性越强。
示例1:观察分析下表电离能数据回答:
元素 I1 kJ/mol I2 kJ/mol I3 kJ/mol
Li 520 7295 11815
Mg 738 1451 7733
试解释为什么锂元素易形成Li+,而不易形成Li2+;镁元素易形成Mg2+,而不易形成Mg3+?
从表中数据可知:Li元素的I2远大于I1,因此Li容易失去第一个电子,而不易失去第二个电子;即Li易形成Li+,而不易形成Li2+ 。镁元素的I1、I2相差不大,I3远大于它们,说明镁容易失去两个电子,而不易失去第三个电子,因此镁易形成Mg2+,而不易形成Mg3+。
示例2、在反应 O2+PtF6= O2PtF6 中,
O2(g) = O2+(g) +e- I1 =1171.5kJ·mol-1。
而 Xe(g) = Xe+(g) +e- I1 =1175.7 kJ·mol-1。Xe和PtF6能否发生反应?写出反应方程式,并分析各元素价态。
O2+PtF6= O2PtF6 Xe+PtF6= XePtF6
O2PtF6和 XePtF6是离子化合物,
O2+:+1价 F:-1价 Pt:+5价 Xe:+1价。
I1 I2 I3 I4
X 500 1 020 6 900 9 500
Y 580 1 800 2 700 11 600
Z 420 3 100 4 400 5 900
1、判断X、Y、Z化合价?
练习
2、下列原子的外围电子排布中,对应的第一电离能最大的是( )
A.3s23p1 B.3s23p2 C.3s23p3 D.3s23p4
C
+2
+3
+1
》4~5倍
3、有一种元素的逐级电离能数据如下:
电离能 I1 I2 I3 I4 ……
kJ·mol-1 578 1817 2745 11578 ……
当它与氯气反应时最可能生成的阳离子是( )
A.X+ B.X2+ C.X3+ D.X4+
C
4、将下列元素按第一电离能由大到小的顺序排列:
①K Na Li ②B C Be N
③He Ne Ar ④ Na Al S P
Li >Na> K
N> C >Be> B
He >Ne > Ar
P >S >Al> Na
课下学习:
①阅读课本,掌握本节课的知识内容;
第一章 原子结构与元素性质
第3节 元素的性质及其变化规律
第1课时 原子半径、电离能及其变化规律
学习目标 核心素养培养
1.了解原子半径的周期性变化,能用原子结构的知识解释主族元素原子半径周期性变化的原因。 证据推理与
模型认知
2.了解同周期、同主族元素性质的递变规律。 宏观辨识与
微观探析
3、了解电离能的定义及其内涵,认识主族元素电离能的变化规律,知道电离能与元素化合价的关系。 知识体系
阅读课本第20页《追根寻源》,了解原子半径的定义和测定方法。
阅读学习
阅读课本第21页,原子半径的变化规律及变化原因。
假定原子是一个实心球体,用统计方法测定的半径。
利用核间距法测得几种形式的原子半径:①共价半径①金属半径③范得华半径
一般有下列关系:
范得华半径>金属半径>共价半径
一、原子半径及其变化规律
1、原子半径大小的影响因素
(1)主族元素
2.原子半径的周期性变化规律:
同一周期从左到右,增加电子产生的电子间的排斥作用小于核电荷数增大导致原子核对外层电子的吸引作用,使原子半径逐渐减小。
同一主族从上到下,核电荷数增大对外层电子的吸引作用小于增加电子间的排斥作用,使原子半径逐渐增大。
同一周期过渡元素自左至右原子半径逐渐减小,但变化幅度不大。原因是同一周期过渡元素增加的电子一般分布在内层d轨道或f轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
(2)过渡元素
总结
微粒半径大小的比较的探究
微粒特点 比较方法 实例
原子 同周期元素
同主族元素
一般原子
离 子 具有相同电子层结构
电子数和核电荷数均不同
同种元素的原子和离子
核电荷数越大,半径越小
核电荷数越大,半径越大
一般电子层数越多,半径越大
r(Na)>r(Mg)>r(Al)
r(Br)>r(Cl)>r(F)
r(S)>r(C)
核电荷数越大,半径越小
通过电子数或核电荷数相同的微粒作参照物
价态越高,半径越小
r(Na+)> r(Mg2+) > r(Al3+)
r(S2-)> r(O2-) >r(Al3+)
r(Fe)>r(Fe2+) >r(Fe3+),
r(H-)>r(H)> r(H+)
1、下列微粒半径大小比较正确的是( )
A.Na+
C.Na
2、已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>d B.离子的还原性Y2-
D
(1)同周期主族元素原子的电子层数相同,从左到右原子半径逐渐减小,原子核对外层电子的吸引作用逐渐增强。因此,同一周期主族元素从左到右,元素原子失去电子的能力越来越弱,获得电子的能力越来越强。
(2)同主族元素原子的价电子数相同,但自上而下原子半径逐渐增大,原子核对外层电子的吸引作用逐渐减弱。因此,自上而下,金属元素原子失去电子的能力越来越强,非金属元素原子获得电子的能力越来越弱。
3.元素原子得失电子的能力
同周期元素和同主族元素原子结构递变的综合结果是:位于元素周期表中金属元素与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
在科学研究和生产实践中,仅有定性的分析往往是不够的,为此人们用电离能、电负性来定量的衡量或比较原子得失电子能力的强弱。
阅读课本第22页内容,了解电离能的概念和含义,分析电离能描述的是元素的哪种性质?并分析第一电离能的数值和性质的关系?
阅读学习
二、元素的电离能及其变化规律
M(g)= M+ (g) + e- I1(第一电离能)
M+(g)= M2+ (g) + e- I2(第二电离能)
M2+(g)= M3+ (g) + e- I3(第三电离能)
1.定义:
气态基态原子或气态基态离子失去一个电子所需要的最小能量叫做电离能。
2.符号:I 单位:kJ/mol
3、表示式:
4、电离能的意义:
表示气态原子失去电子难易程度的物理量。
第一电离能:处于基态的气态原子失去一个电子转化为正一价气态离子所需要的能量叫做第一电离能。元素第一电离能符号:I1。
第二电离能:气态正一价离子再失去一个电子成为气态正二价离子所需的能量叫做第二电离能;第三电离能和第四、第五电离能依此类推。
通常情况下,第一电离能 第二电离能 第三电离能……
小于
小于
I2
I1
I3
Be的电离能
5、逐级电离能:
6、影响电离能大小因素
⑴核电荷数
电子层数相同,核电荷数越多、半径越小、核对外层电子引力越大、越不易失去电子,电离能越大。
⑵原子半径
同族原子半径越大、原子核对外层电子的引力越小,越易失电子,电离能越小。
⑶电子层结构
稳定的8电子结构(同周期末层)电离能最大。
阅读课本第23-24页内容,分析总结元素原子的第一电离能随元素原子序数的递增而变化的规律,并从原子结构的角度解释。
7、元素第一电离能变化规律
⑴金属元素的第一电离能都较小,非金属元素和稀有气体元素的第一电离能都较大。
⑵同一周期元素的第一电离能,从左到右总体上是呈增大趋势。同一主族元素的第一电离能 从上到下逐渐减小。
⑶过渡元素第一电离能变化不太大。
1.金属元素的第一电离能都较小,非金属元素和稀有气体元素的第一电离能都较大。为什么?
交流研讨:
如何从从原子结构的角度解释电离能的变化规律?
2.同一周期元素的第一电离能从左到右呈增大趋势。为什么?
3.同一主族元素的第一电离能从上到下逐渐减小。为什么?
He
Ne
Ar
H
Li
Na
Be
B
C
N
O
F
Mg
Al
Si
P
S
Cl
短周期元素的第一电离能
4.在第二周期中Be和N元素及第三周期中Mg和P的第一电离能大于相邻的元素的第一电离能。为什么?
阅读课本第23~24页《追根寻源》和《拓展视野》栏目,了解金属活动性顺序和电离能为什么不一致?什么是电子亲和能?含义是什么?受哪些因素影响?
都表示原子失去电子的能力,但是具体条件不同。
电子亲和能的大小反映了气态原子获得电子成为气态阴离子的难易程度。取决于原子核对外层电子的吸引力以及电子之间的排斥两个因素。
结论:
第一电离能的周期性变化规律与原子半径和核外电子排布的周期性变化密切相关。
8、电离能的应用:
⑶利用逐级电离能判断化合价,判断原子失去电子的数目或形成的阳离子的电荷。
如K: I1 I2<I3 ,表明K原子容易失去一个电子形成+1价阳离子。
⑴确定核外电子排布。
如Li:I1 I2<I3,表明Li核外3个电子排布K、L层,最外层只1个电子。
⑵判断元素性质强弱或判断金属原子在气态时失电子的难易程度。I1 越大,元素非金属性越强;I1 越小,元素金属性越强。
示例1:观察分析下表电离能数据回答:
元素 I1 kJ/mol I2 kJ/mol I3 kJ/mol
Li 520 7295 11815
Mg 738 1451 7733
试解释为什么锂元素易形成Li+,而不易形成Li2+;镁元素易形成Mg2+,而不易形成Mg3+?
从表中数据可知:Li元素的I2远大于I1,因此Li容易失去第一个电子,而不易失去第二个电子;即Li易形成Li+,而不易形成Li2+ 。镁元素的I1、I2相差不大,I3远大于它们,说明镁容易失去两个电子,而不易失去第三个电子,因此镁易形成Mg2+,而不易形成Mg3+。
示例2、在反应 O2+PtF6= O2PtF6 中,
O2(g) = O2+(g) +e- I1 =1171.5kJ·mol-1。
而 Xe(g) = Xe+(g) +e- I1 =1175.7 kJ·mol-1。Xe和PtF6能否发生反应?写出反应方程式,并分析各元素价态。
O2+PtF6= O2PtF6 Xe+PtF6= XePtF6
O2PtF6和 XePtF6是离子化合物,
O2+:+1价 F:-1价 Pt:+5价 Xe:+1价。
I1 I2 I3 I4
X 500 1 020 6 900 9 500
Y 580 1 800 2 700 11 600
Z 420 3 100 4 400 5 900
1、判断X、Y、Z化合价?
练习
2、下列原子的外围电子排布中,对应的第一电离能最大的是( )
A.3s23p1 B.3s23p2 C.3s23p3 D.3s23p4
C
+2
+3
+1
》4~5倍
3、有一种元素的逐级电离能数据如下:
电离能 I1 I2 I3 I4 ……
kJ·mol-1 578 1817 2745 11578 ……
当它与氯气反应时最可能生成的阳离子是( )
A.X+ B.X2+ C.X3+ D.X4+
C
4、将下列元素按第一电离能由大到小的顺序排列:
①K Na Li ②B C Be N
③He Ne Ar ④ Na Al S P
Li >Na> K
N> C >Be> B
He >Ne > Ar
P >S >Al> Na
课下学习:
①阅读课本,掌握本节课的知识内容;
