2.2.3 分子的空间结构与分子性质(共23张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 2.2.3 分子的空间结构与分子性质(共23张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 665.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览




文档简介
(共23张PPT)
第2章 微粒间的相互作用于物质性质
第2节 共价键与分子的空间结构
第3课时 分子的空间结构与分子性质
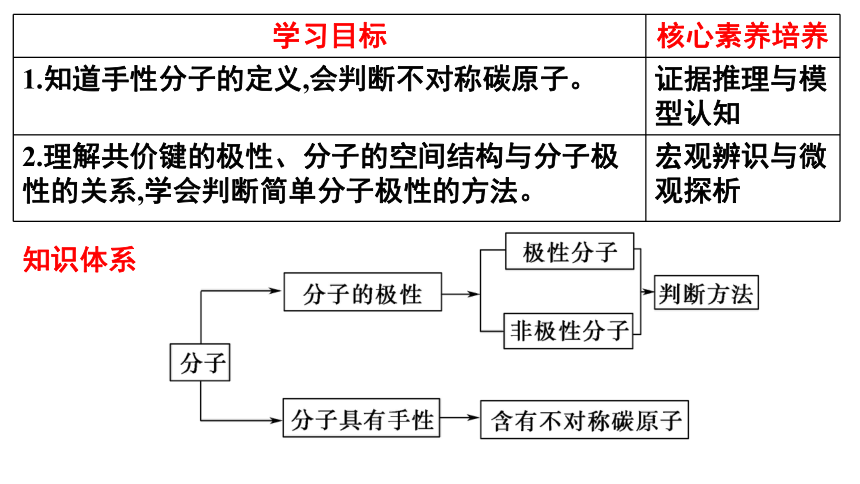
学习目标 核心素养培养
1.知道手性分子的定义,会判断不对称碳原子。 证据推理与模型认知
2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法。 宏观辨识与微观探析
知识体系
交流研讨
对称性普遍存在于自然界。例如五瓣对称的梅花、桃花,六瓣对称的水仙花、雪花(轴对称或中心对称);建筑物和动物的镜面对称;美术与文学中也存在很多对称的概念。
对称的雪花
自然界中的
对称性
建筑艺术中的对称性
阅读课本第51页了解 分子中的原子排布与对称性。
二、分子的空间结构与分子性质
1.分子中的原子排布与对称性
①依据对称轴的旋转或借助对称面的反映能够复原的分子。
②分子所具有的这种性质称为对称性。
③分子的许多性质如极性、旋光性等都与分子的对称性有关。
⑴对称分子
左手和右手不能重叠,左右手互为镜像
你的左手和右手能否完全重叠?
交流研讨
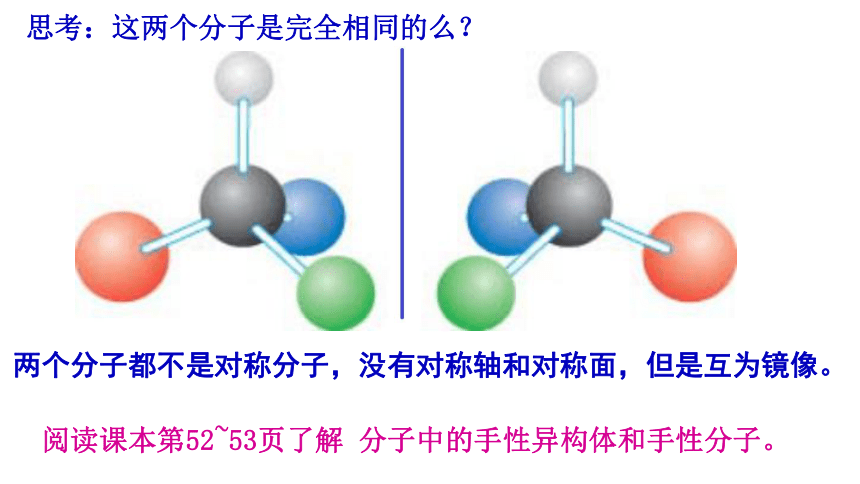
思考:这两个分子是完全相同的么?
两个分子都不是对称分子,没有对称轴和对称面,但是互为镜像。
阅读课本第52~53页了解 分子中的手性异构体和手性分子。
⑵手性异构体和手性分子
①概念:如果一对分子,它们的组成和原子的排列方式完全相同,但互为镜像,在三维空间里不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。
②条件:当四个不同的原子或基团连接在碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。
③判断手性碳原子的方法是一个碳原子上连有四个不同的原子或基团。
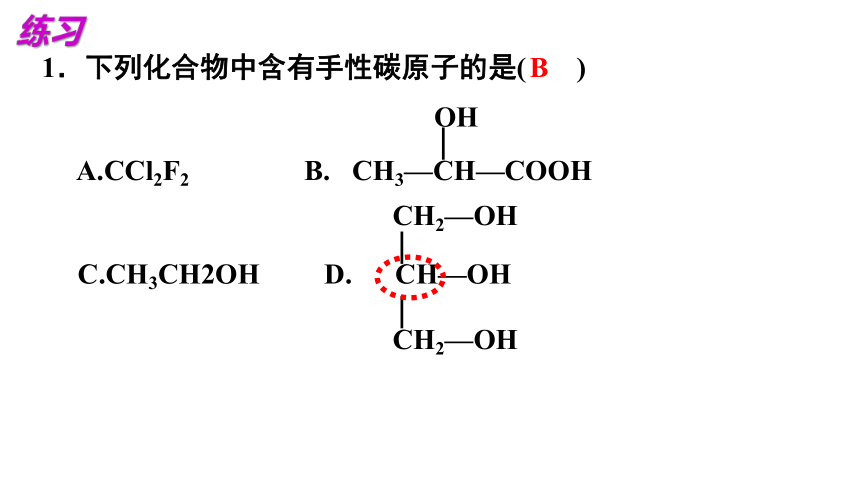
1.下列化合物中含有手性碳原子的是( )
A.CCl2F2 B. CH3—CH—COOH
C.CH3CH2OH D. CH—OH
CH2—OH
CH2—OH
OH
B
练习
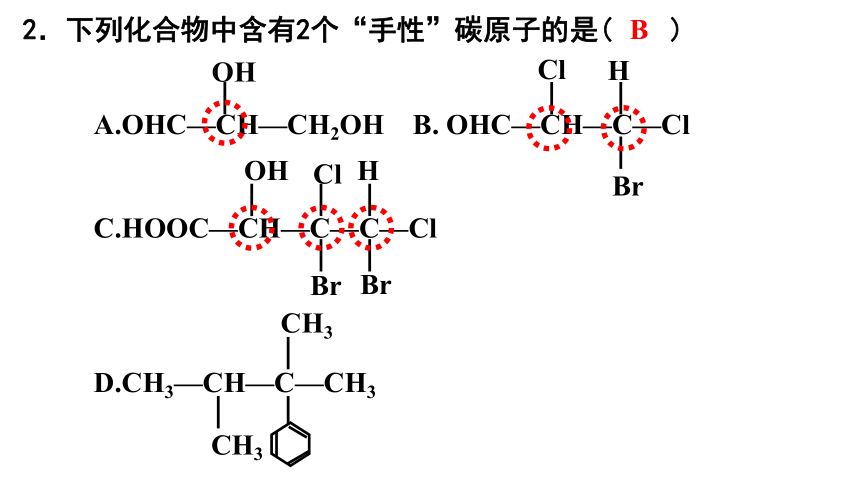
A.OHC—CH—CH2OH B. OHC—CH—C—Cl
C.HOOC—CH—C—C—Cl
D.CH3—CH—C—CH3
H
Cl
OH
Br
OH
Cl
H
Br
Br
CH3
CH3
2.下列化合物中含有2个“手性”碳原子的是( )
B
观察与思考
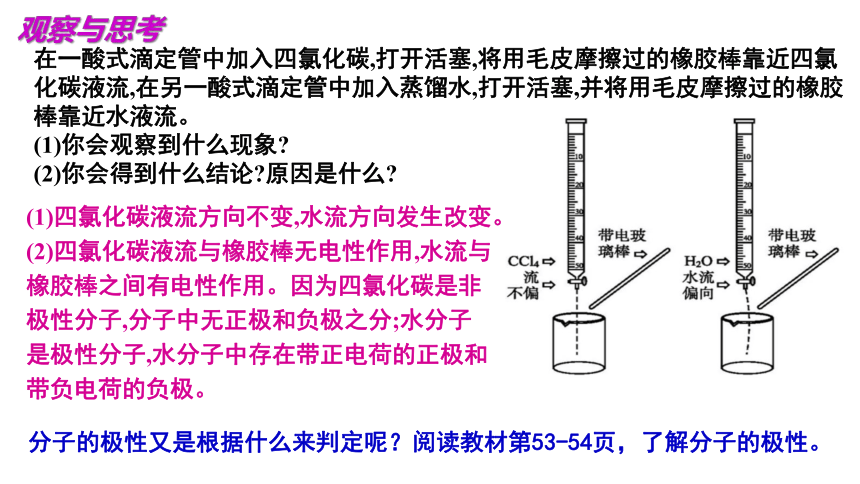
分子的极性又是根据什么来判定呢?阅读教材第53-54页,了解分子的极性。
在一酸式滴定管中加入四氯化碳,打开活塞,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,在另一酸式滴定管中加入蒸馏水,打开活塞,并将用毛皮摩擦过的橡胶棒靠近水液流。
(1)你会观察到什么现象
(2)你会得到什么结论 原因是什么
(1)四氯化碳液流方向不变,水流方向发生改变。
(2)四氯化碳液流与橡胶棒无电性作用,水流与橡胶棒之间有电性作用。因为四氯化碳是非极性分子,分子中无正极和负极之分;水分子是极性分子,水分子中存在带正电荷的正极和带负电荷的负极。
Cl
Cl
共用电子对
Cl
Cl
2个Cl原子吸引电子的能力相同,共用电子对不偏向任何一个原子,整个分子的电荷分布均匀,所以为非极性分子
Cl2分子是只含有非极性键的分子因为共用电子对无偏向,分子是非极性分子。
氯气分子是非极性分子
H
Cl
共用电子对
H
Cl
HCl分子中,共用电子对偏向Cl原子,Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,所以为极性分子
δ+
δ-
以极性键结合的双原子分子为极性分子
氯化氢分子是极性分子
⑴非极性分子:电荷分布均匀对称的分子
2、分子中的电荷分布与极性
正电荷重心和负电荷重心相重合的分子
⑵极性分子:电荷分布不均匀不对称的分子
正电荷重心和负电荷重心不相重合的分子
如:H2、O2、N2、CO2、CH4、CCl4等。
如:HCl、H2O、NH3、H2O2、CH3Cl等。
⑶分子极性的产生原因:
分子的极性是由分子中所含共价键的极性与分子的空间构型两方面共同决定的。
H
O
H
104.5
O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消(正负电荷重心不重合),整个分子电荷分布不均匀,是极性分子。
H2O分子
δ+
δ-
δ-
δ+
δ+
δ+
交流研讨
H2O、NH3等分子的极性分析
H
H
H
N
BF3:
120
107.3
三角锥型,不对称,键的极性不能抵消,是极性分子。
平面三角形,对称,键的极性互相抵消,是非极性分子。
NH3:
δ-
δ+
δ+
δ+
δ+
δ+
δ+
δ-
δ+
δ-
δ-
δ-
C
H
H
H
H
109.5
正四面体型 ,对称结构,C-H键的极性互相抵消,是非极性分子。
CH4分子的极性分析
δ+
δ-
δ+
δ+
δ+
δ+
δ+
δ+
δ+
δ-
⑷分子极性的判断方法
分子的极性是由分子中所含共价键的极性与分子的空间构型两方面共同决定的。判断分子极性时,可根据以下原则进行:
①只含有非极性键的双原子分子都是极性分子,如O2、H2。
③含有极性键的双原子分子都是极性分子,如HCl、HF、HBr等。
④含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。
②只含有非极性键的多原子分子是非极性分子,如P4、C60等。
⑷分子极性对性质的影响
分子的极性会影响分子的性质。
①在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。
②极性分子易溶于极性溶剂,如氨、乙醇等极性分子易溶于水;非极性分子易溶于非极性溶剂,这就是我们常说的“相似相溶”原理中的一种类型。如油脂、石油的成分难溶于水,而溶于非极性或极性较小的溶剂。
3、下列分子中,属于非极性分子的是( )
A.SO2 B.NH3 C.BBr3 D.COCl2
C
4、下列分子是极性分子的是 ( )
A.PCl3 B.SO3 C.BF3 D.CS2
A
5、下列各组物质中,都是由极性键构成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
B
6.NF3分子中的中心原子采取sp3杂化,下列有关叙述正确的是( )
A.NF3分子的空间构型为三角锥形
B.NF3分子的空间构型为平面三角形
C.NF3分子的N—F键夹角与CH4分子中的C—H键的夹角相等
D.NF3分子是非极性分子
A
7.下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
C
8.回答下列问题:
(1)根据“相似相溶”规律,极性溶质能溶于极性溶剂,非极性溶质一般能溶于非极性溶剂。
①在a.苯 b.CH3OH c.HCHO d.CS2 e.CCl4五种溶剂中,碳原子采取sp2杂化的分子有____ (填字母)。CS2分子的空间构型是________,是________(填“极性”或“非极性”)分子。
非极性
ac
直线形
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
非极性
③金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于下列_____(填字母)。
a.水 b.CCl4 c.C6H6(苯) d.NiSO4溶液
bc
(2)双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如右图所示:H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答:
①下列关于H2O2的说法中正确的是_____(填字母)。
a.分子中有极性键
b.分子中有非极性键
c.氧原子的轨道发生sp2杂化
d.分子是非极性分子
ab
②H2O2难溶于CS2,主要原因是_____________________________
_____________________________________________ _。
因为H2O2为极性分子,CS2为非极性分子,根据“相似相溶”规律可知H2O2难溶于CS2
③H2O2分子中氧元素的化合价为 ,原因是_______________________________________________________
________ _______
-1
因为O—O键为非极性键O—H键为极性键,共用电子对偏向于氧,故氧元素显-1价。
(3)1,2 -二氯乙烯存在两种同分异构体:
、
,属于极性分子的是________(填“A”、“B”)。
B
第2章 微粒间的相互作用于物质性质
第2节 共价键与分子的空间结构
第3课时 分子的空间结构与分子性质
学习目标 核心素养培养
1.知道手性分子的定义,会判断不对称碳原子。 证据推理与模型认知
2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法。 宏观辨识与微观探析
知识体系
交流研讨
对称性普遍存在于自然界。例如五瓣对称的梅花、桃花,六瓣对称的水仙花、雪花(轴对称或中心对称);建筑物和动物的镜面对称;美术与文学中也存在很多对称的概念。
对称的雪花
自然界中的
对称性
建筑艺术中的对称性
阅读课本第51页了解 分子中的原子排布与对称性。
二、分子的空间结构与分子性质
1.分子中的原子排布与对称性
①依据对称轴的旋转或借助对称面的反映能够复原的分子。
②分子所具有的这种性质称为对称性。
③分子的许多性质如极性、旋光性等都与分子的对称性有关。
⑴对称分子
左手和右手不能重叠,左右手互为镜像
你的左手和右手能否完全重叠?
交流研讨
思考:这两个分子是完全相同的么?
两个分子都不是对称分子,没有对称轴和对称面,但是互为镜像。
阅读课本第52~53页了解 分子中的手性异构体和手性分子。
⑵手性异构体和手性分子
①概念:如果一对分子,它们的组成和原子的排列方式完全相同,但互为镜像,在三维空间里不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。
②条件:当四个不同的原子或基团连接在碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。
③判断手性碳原子的方法是一个碳原子上连有四个不同的原子或基团。
1.下列化合物中含有手性碳原子的是( )
A.CCl2F2 B. CH3—CH—COOH
C.CH3CH2OH D. CH—OH
CH2—OH
CH2—OH
OH
B
练习
A.OHC—CH—CH2OH B. OHC—CH—C—Cl
C.HOOC—CH—C—C—Cl
D.CH3—CH—C—CH3
H
Cl
OH
Br
OH
Cl
H
Br
Br
CH3
CH3
2.下列化合物中含有2个“手性”碳原子的是( )
B
观察与思考
分子的极性又是根据什么来判定呢?阅读教材第53-54页,了解分子的极性。
在一酸式滴定管中加入四氯化碳,打开活塞,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,在另一酸式滴定管中加入蒸馏水,打开活塞,并将用毛皮摩擦过的橡胶棒靠近水液流。
(1)你会观察到什么现象
(2)你会得到什么结论 原因是什么
(1)四氯化碳液流方向不变,水流方向发生改变。
(2)四氯化碳液流与橡胶棒无电性作用,水流与橡胶棒之间有电性作用。因为四氯化碳是非极性分子,分子中无正极和负极之分;水分子是极性分子,水分子中存在带正电荷的正极和带负电荷的负极。
Cl
Cl
共用电子对
Cl
Cl
2个Cl原子吸引电子的能力相同,共用电子对不偏向任何一个原子,整个分子的电荷分布均匀,所以为非极性分子
Cl2分子是只含有非极性键的分子因为共用电子对无偏向,分子是非极性分子。
氯气分子是非极性分子
H
Cl
共用电子对
H
Cl
HCl分子中,共用电子对偏向Cl原子,Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,所以为极性分子
δ+
δ-
以极性键结合的双原子分子为极性分子
氯化氢分子是极性分子
⑴非极性分子:电荷分布均匀对称的分子
2、分子中的电荷分布与极性
正电荷重心和负电荷重心相重合的分子
⑵极性分子:电荷分布不均匀不对称的分子
正电荷重心和负电荷重心不相重合的分子
如:H2、O2、N2、CO2、CH4、CCl4等。
如:HCl、H2O、NH3、H2O2、CH3Cl等。
⑶分子极性的产生原因:
分子的极性是由分子中所含共价键的极性与分子的空间构型两方面共同决定的。
H
O
H
104.5
O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消(正负电荷重心不重合),整个分子电荷分布不均匀,是极性分子。
H2O分子
δ+
δ-
δ-
δ+
δ+
δ+
交流研讨
H2O、NH3等分子的极性分析
H
H
H
N
BF3:
120
107.3
三角锥型,不对称,键的极性不能抵消,是极性分子。
平面三角形,对称,键的极性互相抵消,是非极性分子。
NH3:
δ-
δ+
δ+
δ+
δ+
δ+
δ+
δ-
δ+
δ-
δ-
δ-
C
H
H
H
H
109.5
正四面体型 ,对称结构,C-H键的极性互相抵消,是非极性分子。
CH4分子的极性分析
δ+
δ-
δ+
δ+
δ+
δ+
δ+
δ+
δ+
δ-
⑷分子极性的判断方法
分子的极性是由分子中所含共价键的极性与分子的空间构型两方面共同决定的。判断分子极性时,可根据以下原则进行:
①只含有非极性键的双原子分子都是极性分子,如O2、H2。
③含有极性键的双原子分子都是极性分子,如HCl、HF、HBr等。
④含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。
②只含有非极性键的多原子分子是非极性分子,如P4、C60等。
⑷分子极性对性质的影响
分子的极性会影响分子的性质。
①在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。
②极性分子易溶于极性溶剂,如氨、乙醇等极性分子易溶于水;非极性分子易溶于非极性溶剂,这就是我们常说的“相似相溶”原理中的一种类型。如油脂、石油的成分难溶于水,而溶于非极性或极性较小的溶剂。
3、下列分子中,属于非极性分子的是( )
A.SO2 B.NH3 C.BBr3 D.COCl2
C
4、下列分子是极性分子的是 ( )
A.PCl3 B.SO3 C.BF3 D.CS2
A
5、下列各组物质中,都是由极性键构成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
B
6.NF3分子中的中心原子采取sp3杂化,下列有关叙述正确的是( )
A.NF3分子的空间构型为三角锥形
B.NF3分子的空间构型为平面三角形
C.NF3分子的N—F键夹角与CH4分子中的C—H键的夹角相等
D.NF3分子是非极性分子
A
7.下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
C
8.回答下列问题:
(1)根据“相似相溶”规律,极性溶质能溶于极性溶剂,非极性溶质一般能溶于非极性溶剂。
①在a.苯 b.CH3OH c.HCHO d.CS2 e.CCl4五种溶剂中,碳原子采取sp2杂化的分子有____ (填字母)。CS2分子的空间构型是________,是________(填“极性”或“非极性”)分子。
非极性
ac
直线形
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
非极性
③金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于下列_____(填字母)。
a.水 b.CCl4 c.C6H6(苯) d.NiSO4溶液
bc
(2)双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如右图所示:H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答:
①下列关于H2O2的说法中正确的是_____(填字母)。
a.分子中有极性键
b.分子中有非极性键
c.氧原子的轨道发生sp2杂化
d.分子是非极性分子
ab
②H2O2难溶于CS2,主要原因是_____________________________
_____________________________________________ _。
因为H2O2为极性分子,CS2为非极性分子,根据“相似相溶”规律可知H2O2难溶于CS2
③H2O2分子中氧元素的化合价为 ,原因是_______________________________________________________
________ _______
-1
因为O—O键为非极性键O—H键为极性键,共用电子对偏向于氧,故氧元素显-1价。
(3)1,2 -二氯乙烯存在两种同分异构体:
、
,属于极性分子的是________(填“A”、“B”)。
B
