2.4.2 氢键(共20张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 2.4.2 氢键(共20张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 869.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 21:13:54 | ||
图片预览





文档简介
(共20张PPT)
第2章 微粒间的相互作用于物质性质
第4节 分子间作用力
第2课时 氢键
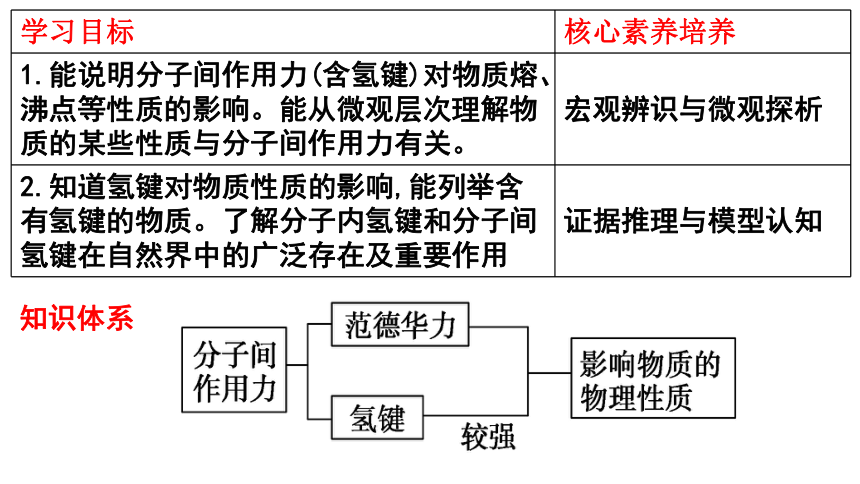
学习目标 核心素养培养
1.能说明分子间作用力(含氢键)对物质熔、沸点等性质的影响。能从微观层次理解物质的某些性质与分子间作用力有关。 宏观辨识与微观探析
2.知道氢键对物质性质的影响,能列举含有氢键的物质。了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用 证据推理与模型认知
知识体系
联想 质疑
阅读课本第71页,思考范德华力对物质的熔沸点的影响?根据规律,分析第ⅥA族的氢化物H2O、H2S、H2Se、H2Te
的沸点呈怎样的变化规律呢?观察课本图示,是否和你的分析结论一致?
阅读课本第71~72页,了解什么是氢键,氢键的形成条件。
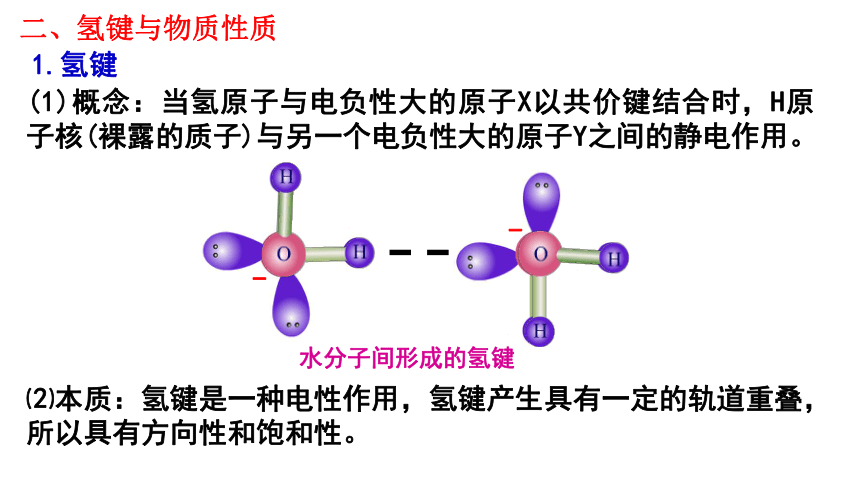
水分子间形成的氢键
+
+
+
+
-
-
二、氢键与物质性质
1.氢键
(1)概念:当氢原子与电负性大的原子X以共价键结合时,H原子核(裸露的质子)与另一个电负性大的原子Y之间的静电作用。
⑵本质:氢键是一种电性作用,氢键产生具有一定的轨道重叠,所以具有方向性和饱和性。
⑶表示形式
通常用 X—H…Y—表示氢键,其中X—H表示H原子和X原子以共价键相结合,与Y原子形成氢键。
2、氢键的形成条件
⑴氢键的形成条件:在X—H…Y— 中,X原子和Y原子所属的元素通常有较大的电负性和较小的原子半径,氢键才能形成。
X原子和Y原子是位于元素周期表的右上角的元素的原子时更容易形成氢键,如N、O、F等。
氢键一般存在于含N—H、H—O、H—F键的物质中,或有机化合物中醇类(羟基)和羧酸类(羟基、羰基)、醛类(羰基)等物质中。
①分子间氢键。如水中氢键,O—H…O—;对羟基苯甲醛分子间氢键:
⑵氢键的类型:
②分子内氢键。如邻羟基苯甲醛分子内氢键。
X和Y的电负性越大,吸引电子能力越强,则氢键越强。
⑶氢键X—H …Y—的强弱
氢键强弱顺序:
F—H…F— > O—H…O—> O—H…N— > N—H…N—
阅读课本第73页,了解氢键对物质性质的影响。
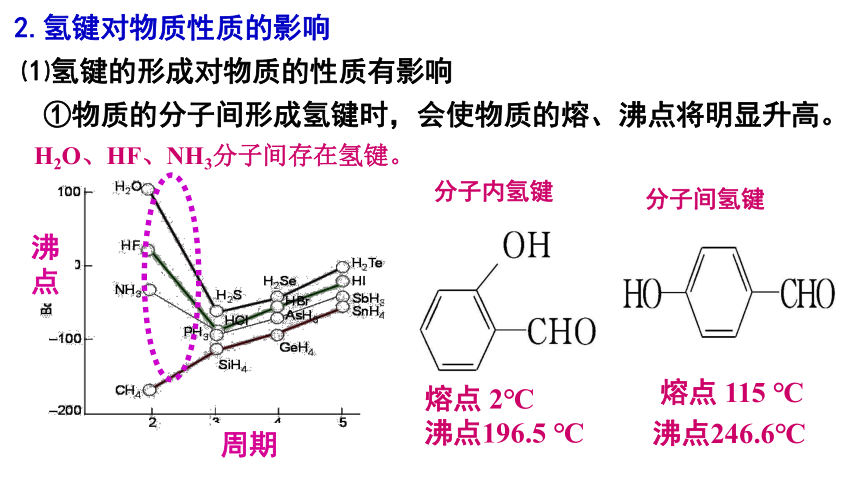
2.氢键对物质性质的影响
⑴氢键的形成对物质的性质有影响
①物质的分子间形成氢键时,会使物质的熔、沸点将明显升高。
H2O、HF、NH3分子间存在氢键。
周期
沸
点
熔点 2℃
沸点196.5 ℃
分子内氢键
熔点 115 ℃
沸点246.6℃
分子间氢键
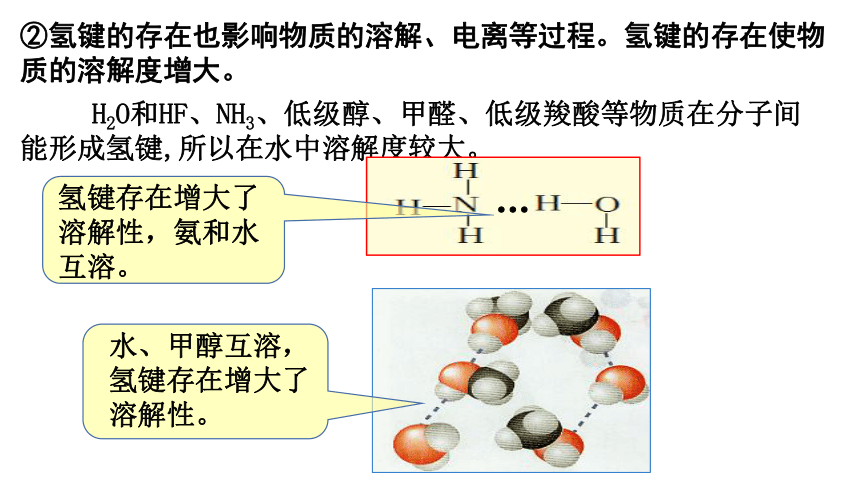
②氢键的存在也影响物质的溶解、电离等过程。氢键的存在使物质的溶解度增大。
H2O和HF、NH3、低级醇、甲醛、低级羧酸等物质在分子间能形成氢键,所以在水中溶解度较大。
…
氢键存在增大了溶解性,氨和水互溶。
水、甲醇互溶,氢键存在增大了溶解性。
①氢键是分子间作用力,不是化学键,其键能比共价键键能小得多。氢键的作用一般不超过 40 kJ mol-1
②氢键的键长是指X和Y的距离;
③氢键的键能是指X—H…Y 分解为X—H和Y所需要的能量。
④氢键具有方向性和饱和性。⑤只要具备形成条件,物质倾向于形成尽可能多的氢键,以最大限度降低体系的能量。
对于氢键X—H …Y—
阅读课本第73页追根寻源《为什么水呈现独特的物理性质》
水的独特的物理性质
水 4℃时的密度最大,水结成冰时,体积膨胀,密度减小,由于形成氢键有方向性、饱和性,水分子间形成的孔穴造成冰晶体的微观结构存在空隙。每摩尔冰平均有2NA个氢键,每个氢原子分享到1个氢键。
水蒸气中单个H2O分子存在;
液态水中,通过氢键形成(H2O)n;
冰中水分子大范围以氢键联结,形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
水的性质受氢键影响的解释:
冰在融化过程中,一是冰晶结构小集体受热不断崩溃,缔合分子减少,体积减小,密度增大;二是水分子间距因热运动不断增大,造成体积膨胀,密度减小。0~4℃间前者占优势, 4℃以上后者占优势, 4℃时两者互不相让。
由于形成氢键有方向性、饱和性,水分子间形成的孔穴造成冰晶体的微观结构存在空隙。在高压、低温的条件下,甲烷进入空隙形成可燃冰。
可燃冰的形成
练习
6.下列物质中不存在氢键的是( )
A、冰醋酸中醋酸分子之间
B、一水合氨分子中的氨分子与水分子之间
C、液态氟化氢中氟化氢分子之间
D、可燃冰(CH4·8H2O)中甲烷分子与水分子之间
D
7、关于氢键的下列说法中正确的是( )
A.每个水分子内含有两个氢键
B.冰、液态水、水蒸气中都存在氢键
C.1个水分子最多可形成4个氢键
D.HF的稳定性很强,是因为其分子间能形成氢键
C
8、下列事实与氢键无关的是( )
A.液态氟化氢中有三聚氟化氢(HF)3分子存在。
B.冰的密度比液态水的密度小。
C.乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水。
D.NH3比PH3稳定。
D
9、下列物质的性质可用范德华力的大小来解释的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.F2、Cl2、Br2、I2的熔、沸点依次升高
C. 、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱
D.CH3—O—CH3、C2H5OH的沸点依次升高
B
10.下列现象与氢键有关的是( )
①NH3的熔、沸点比ⅤA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.①②③④⑤ B.①②③⑤
C.①②③④ D.①②③
B
(1)NH3的沸点比PH3高的原因是_________________________
___________________________。
(2)CH4的分解温度比SiH4高的原因是_____________________
__________________________________。
(3)CH4的沸点比SiH4低的原因是_________________________
______________________________。
11.分析下表中四种物质的相关数据,并回答下列问题:
物质 CH4 SiH4 NH3 PH3
沸点(K) 101.7 161.2 239.7 185.4
分解温度(K) 873 773 1073 713.2
NH3分子间含有氢键,PH3分子间含有范德华力,氢键比范德华力强
C半径小于Si,键长C—H键小于Si—H键,键能C—H键大于Si—H键
CH4与SiH4结构和组成相似,相对分子质量:SiH4>CH4,范德华力:SiH4>CH4
12、回答下列问题:
(1)下列几种氢键由强到弱的顺序为______________。
a.O—H…O— b.N—H…N—
c.F—H…F— d.O—H…N—
c>a>d>b
(2)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如右图所示,呈现这种变化关系的原因是________________________
______________________________________________。
硅烷的结构和组成相似,相对分子质量越大,分子间作用力越大,沸点越高
(3)①H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为:______________________。
的沸点比 的沸点低,原因:
前者形成的是分子内的氢键,而后者可形成分子间的氢键,分子间氢键使分子间的作用力增大,沸点升高。
O—H键>氢键>范德华力
THANKS
第2章 微粒间的相互作用于物质性质
第4节 分子间作用力
第2课时 氢键
学习目标 核心素养培养
1.能说明分子间作用力(含氢键)对物质熔、沸点等性质的影响。能从微观层次理解物质的某些性质与分子间作用力有关。 宏观辨识与微观探析
2.知道氢键对物质性质的影响,能列举含有氢键的物质。了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用 证据推理与模型认知
知识体系
联想 质疑
阅读课本第71页,思考范德华力对物质的熔沸点的影响?根据规律,分析第ⅥA族的氢化物H2O、H2S、H2Se、H2Te
的沸点呈怎样的变化规律呢?观察课本图示,是否和你的分析结论一致?
阅读课本第71~72页,了解什么是氢键,氢键的形成条件。
水分子间形成的氢键
+
+
+
+
-
-
二、氢键与物质性质
1.氢键
(1)概念:当氢原子与电负性大的原子X以共价键结合时,H原子核(裸露的质子)与另一个电负性大的原子Y之间的静电作用。
⑵本质:氢键是一种电性作用,氢键产生具有一定的轨道重叠,所以具有方向性和饱和性。
⑶表示形式
通常用 X—H…Y—表示氢键,其中X—H表示H原子和X原子以共价键相结合,与Y原子形成氢键。
2、氢键的形成条件
⑴氢键的形成条件:在X—H…Y— 中,X原子和Y原子所属的元素通常有较大的电负性和较小的原子半径,氢键才能形成。
X原子和Y原子是位于元素周期表的右上角的元素的原子时更容易形成氢键,如N、O、F等。
氢键一般存在于含N—H、H—O、H—F键的物质中,或有机化合物中醇类(羟基)和羧酸类(羟基、羰基)、醛类(羰基)等物质中。
①分子间氢键。如水中氢键,O—H…O—;对羟基苯甲醛分子间氢键:
⑵氢键的类型:
②分子内氢键。如邻羟基苯甲醛分子内氢键。
X和Y的电负性越大,吸引电子能力越强,则氢键越强。
⑶氢键X—H …Y—的强弱
氢键强弱顺序:
F—H…F— > O—H…O—> O—H…N— > N—H…N—
阅读课本第73页,了解氢键对物质性质的影响。
2.氢键对物质性质的影响
⑴氢键的形成对物质的性质有影响
①物质的分子间形成氢键时,会使物质的熔、沸点将明显升高。
H2O、HF、NH3分子间存在氢键。
周期
沸
点
熔点 2℃
沸点196.5 ℃
分子内氢键
熔点 115 ℃
沸点246.6℃
分子间氢键
②氢键的存在也影响物质的溶解、电离等过程。氢键的存在使物质的溶解度增大。
H2O和HF、NH3、低级醇、甲醛、低级羧酸等物质在分子间能形成氢键,所以在水中溶解度较大。
…
氢键存在增大了溶解性,氨和水互溶。
水、甲醇互溶,氢键存在增大了溶解性。
①氢键是分子间作用力,不是化学键,其键能比共价键键能小得多。氢键的作用一般不超过 40 kJ mol-1
②氢键的键长是指X和Y的距离;
③氢键的键能是指X—H…Y 分解为X—H和Y所需要的能量。
④氢键具有方向性和饱和性。⑤只要具备形成条件,物质倾向于形成尽可能多的氢键,以最大限度降低体系的能量。
对于氢键X—H …Y—
阅读课本第73页追根寻源《为什么水呈现独特的物理性质》
水的独特的物理性质
水 4℃时的密度最大,水结成冰时,体积膨胀,密度减小,由于形成氢键有方向性、饱和性,水分子间形成的孔穴造成冰晶体的微观结构存在空隙。每摩尔冰平均有2NA个氢键,每个氢原子分享到1个氢键。
水蒸气中单个H2O分子存在;
液态水中,通过氢键形成(H2O)n;
冰中水分子大范围以氢键联结,形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
水的性质受氢键影响的解释:
冰在融化过程中,一是冰晶结构小集体受热不断崩溃,缔合分子减少,体积减小,密度增大;二是水分子间距因热运动不断增大,造成体积膨胀,密度减小。0~4℃间前者占优势, 4℃以上后者占优势, 4℃时两者互不相让。
由于形成氢键有方向性、饱和性,水分子间形成的孔穴造成冰晶体的微观结构存在空隙。在高压、低温的条件下,甲烷进入空隙形成可燃冰。
可燃冰的形成
练习
6.下列物质中不存在氢键的是( )
A、冰醋酸中醋酸分子之间
B、一水合氨分子中的氨分子与水分子之间
C、液态氟化氢中氟化氢分子之间
D、可燃冰(CH4·8H2O)中甲烷分子与水分子之间
D
7、关于氢键的下列说法中正确的是( )
A.每个水分子内含有两个氢键
B.冰、液态水、水蒸气中都存在氢键
C.1个水分子最多可形成4个氢键
D.HF的稳定性很强,是因为其分子间能形成氢键
C
8、下列事实与氢键无关的是( )
A.液态氟化氢中有三聚氟化氢(HF)3分子存在。
B.冰的密度比液态水的密度小。
C.乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水。
D.NH3比PH3稳定。
D
9、下列物质的性质可用范德华力的大小来解释的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.F2、Cl2、Br2、I2的熔、沸点依次升高
C. 、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱
D.CH3—O—CH3、C2H5OH的沸点依次升高
B
10.下列现象与氢键有关的是( )
①NH3的熔、沸点比ⅤA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.①②③④⑤ B.①②③⑤
C.①②③④ D.①②③
B
(1)NH3的沸点比PH3高的原因是_________________________
___________________________。
(2)CH4的分解温度比SiH4高的原因是_____________________
__________________________________。
(3)CH4的沸点比SiH4低的原因是_________________________
______________________________。
11.分析下表中四种物质的相关数据,并回答下列问题:
物质 CH4 SiH4 NH3 PH3
沸点(K) 101.7 161.2 239.7 185.4
分解温度(K) 873 773 1073 713.2
NH3分子间含有氢键,PH3分子间含有范德华力,氢键比范德华力强
C半径小于Si,键长C—H键小于Si—H键,键能C—H键大于Si—H键
CH4与SiH4结构和组成相似,相对分子质量:SiH4>CH4,范德华力:SiH4>CH4
12、回答下列问题:
(1)下列几种氢键由强到弱的顺序为______________。
a.O—H…O— b.N—H…N—
c.F—H…F— d.O—H…N—
c>a>d>b
(2)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如右图所示,呈现这种变化关系的原因是________________________
______________________________________________。
硅烷的结构和组成相似,相对分子质量越大,分子间作用力越大,沸点越高
(3)①H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为:______________________。
的沸点比 的沸点低,原因:
前者形成的是分子内的氢键,而后者可形成分子间的氢键,分子间氢键使分子间的作用力增大,沸点升高。
O—H键>氢键>范德华力
THANKS
