3.1.2 晶体结构的基本重复单元—晶胞(共22张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 3.1.2 晶体结构的基本重复单元—晶胞(共22张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 21:15:13 | ||
图片预览



文档简介
(共22张PPT)
第3章 不同聚集状态的物质与性质
第1节 认识晶体
第2课时 晶体结构的基本重复单元—晶胞
学习目标 核心素养培养
了解晶体中微粒的空间排布存在周期性,了解晶胞的概念,以及晶胞与晶体的关系。 宏观辨识与微观探析
认识简单的晶胞,会用切割法确定晶胞微粒数目(或微粒数目比)及晶体化学式。 证据推理与模型认知
知识体系
联想 质疑
通过X射线衍射等实验证明晶体是微粒按照一定规律可重复的周期型排列而无限堆积得到的。我们研究晶体的结构只需找出其中的基本的重复单元并加以分析,就可以了解整个晶体。晶体中这个基本的重复单元就是晶胞。
常见的晶体结构的最小重复单元晶胞的种类有哪些,晶胞中的微粒关系是怎样的?
二、晶体结构的基本单元——晶胞
1、晶胞是晶体结构中基本的重复单元。
常规的晶胞是从晶体结构中截取出来的大小、形状完全相同的平行六面体。
2、晶胞必须符合两个条件:
⑴代表晶体的化学组成; ⑵代表晶体的对称性。
3、从晶体中选取晶胞的方式:
首先尽可能反映晶体内结构的对称性;其次,晶胞尽量的简洁(所含原子尽可能的少),优选棱的夹角为直角。
知道了晶胞的大小和形状以及晶胞中所含微粒的种类、数目和空间位置,就可以了解整个晶体的结构。
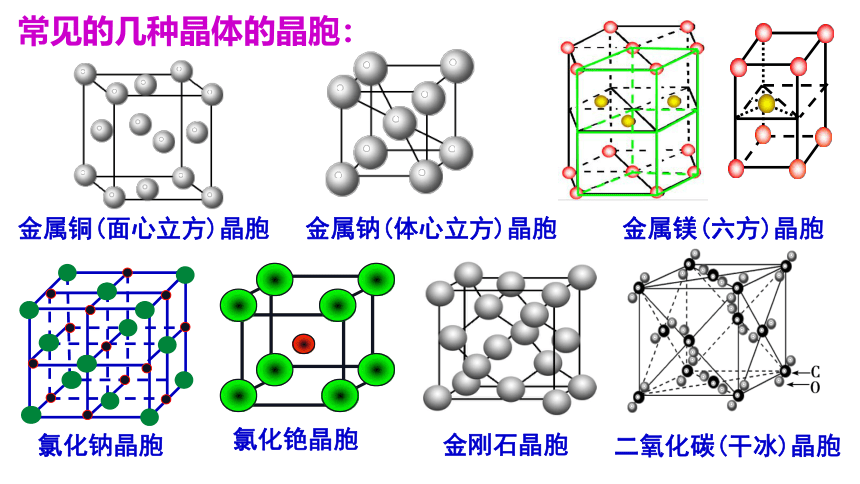
常见的几种晶体的晶胞:
金属铜(面心立方)晶胞
金属钠(体心立方)晶胞
金属镁(六方)晶胞
氯化铯晶胞
氯化钠晶胞
金刚石晶胞
二氧化碳(干冰)晶胞
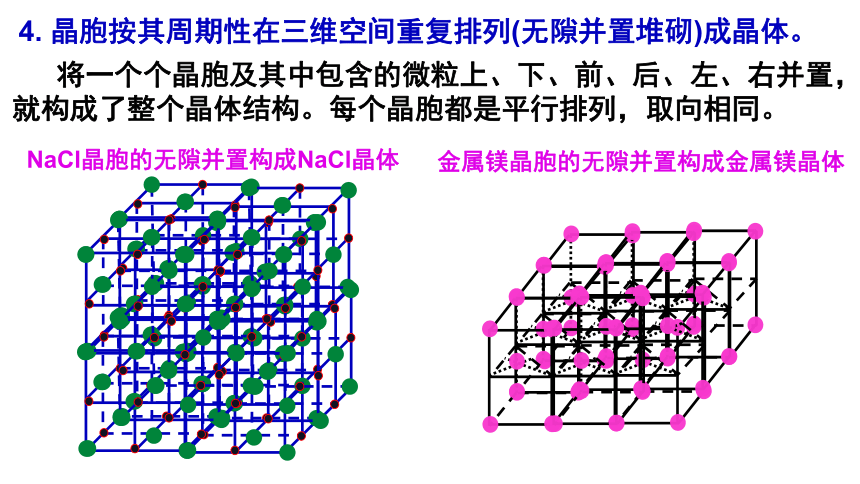
NaCl晶胞的无隙并置构成NaCl晶体
4. 晶胞按其周期性在三维空间重复排列(无隙并置堆砌)成晶体。
将一个个晶胞及其中包含的微粒上、下、前、后、左、右并置,就构成了整个晶体结构。每个晶胞都是平行排列,取向相同。
金属镁晶胞的无隙并置构成金属镁晶体
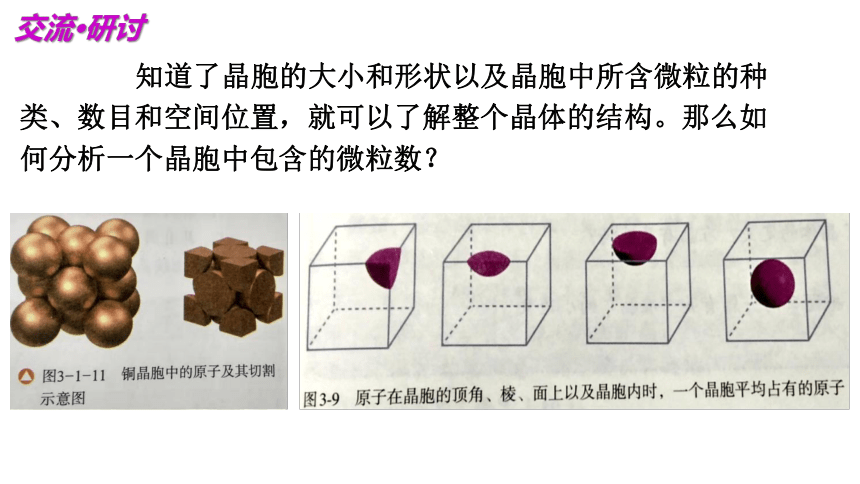
交流 研讨
知道了晶胞的大小和形状以及晶胞中所含微粒的种类、数目和空间位置,就可以了解整个晶体的结构。那么如何分析一个晶胞中包含的微粒数?
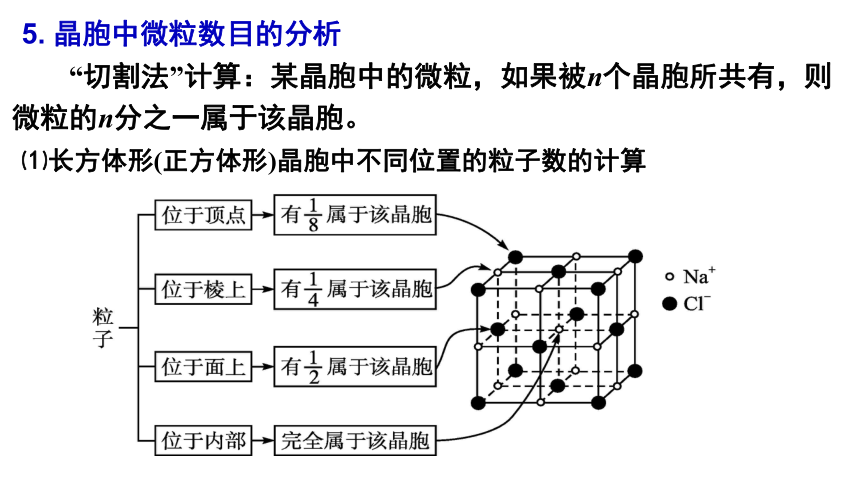
“切割法”计算:某晶胞中的微粒,如果被n个晶胞所共有,则微粒的n分之一属于该晶胞。
5. 晶胞中微粒数目的分析
⑴长方体形(正方体形)晶胞中不同位置的粒子数的计算
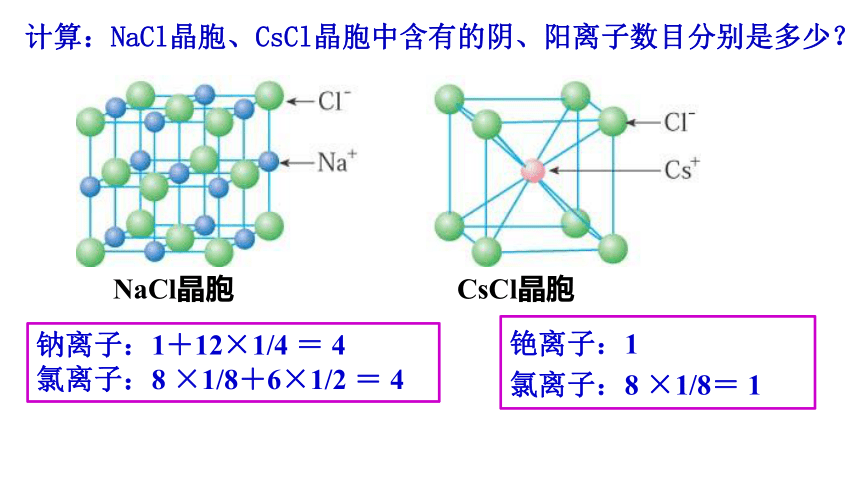
NaCl晶胞
CsCl晶胞
计算:NaCl晶胞、CsCl晶胞中含有的阴、阳离子数目分别是多少?
钠离子:1+12×1/4 = 4
氯离子:8 ×1/8+6×1/2 = 4
铯离子:1
氯离子:8 ×1/8= 1
⑵不规则晶胞中微粒数的计算
正六边形顶点 正六棱柱顶点 正六棱柱纵棱
石墨中的每个C被3个六边形共用,每个六边形2个C;
晶体中原子被6个六棱柱共用,各六棱柱分享1/6 个原子;
晶体中原子被3个六棱柱共用,各六棱柱分享1/3 个原子。
正三角形顶点:
正三角形纵棱:
A B C
思考:某晶体的一部分如右图,晶体中A、B、C三种粒子之比是 。
1:4:2
每个原子被12个三棱柱共用,各三棱柱分享1/12。
晶体中原子被6个三棱柱共用,各三棱柱分享1/6。
三棱柱晶胞中微粒数的计算
晶体中原子被4个三棱柱共用,各三棱柱分享1/4。
正三角形边上:
例1、某物质的晶体中含A、B、C三种元素,其晶胞中原子的排列方式如图所示,晶体中A、B、C的原子个数比为( )
典型例题
A.1∶3∶1 B.2∶3∶1
C.1∶2∶1 D.1∶3∶3
C
例2、硼和镁可形成超导化合物。如图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上、下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )
A.MgB B.Mg3B2
C.MgB2 D.Mg2B3
B
例3、(1)元素铜的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是 。
(2)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于6个面心和8个顶点,则该晶胞中有 个铜原子。
CuCl
16
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,左图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
(4)某晶体结构模型如右图所示。在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为 、 。
2
BN
6
12
1、现有甲、乙、丙(如下图)三种晶体的晶胞(甲中 x 处于晶胞的中心,乙中 a 处于晶胞的中心),可推知:
甲晶胞中 x 与 y 的个数比是 ,
乙晶胞中a与b的个数比是 ,
丙晶胞中有 个c离子,有 个d离子。
随堂练习
4∶3
1∶1
4
4
2、最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
A.Mg2CNi3 B.MgC2Ni C.MgCNi2 D.MgCNi3
D
3、已知某晶体晶胞如图所示,则该晶体的化学式为( )
A.XYZ B.X2Y4Z C.XY4Z D.X4Y2Z
C
4、如图所示,由金属原子M和非金属原子N构成的气态团簇分子,顶角和面上的原子是M原子,棱中心和体心的原子是N原子,则分子式可表示为 。
是气态团簇分子,不是晶胞,不能用切割法
M14N13或N13M14
5、如图所示的晶体结构是一种具有优良的压电、铁电、光电等功能的晶体材料的晶胞。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是 (各元素所带的电荷均已略去)
O原子
Ti原子
Ba原子
化学式为:BaTiO3
Ba:1×1
Ti:8× (1/8)
O:12× (1/4)
与每个“Ti”紧邻的氧原子数为6
BaTiO3
6
6、某离子晶体部分结构如图所示,X位于立方体的顶点,Y位于立方体的中心。试分析:
(1)在一个结构中有 个X, 个Y,所以该晶体的化学式为_____
(2)晶体中距离最近的2个X
与一个Y所形成的夹角
∠XYX角度为________(填角的度数)
1/2
1
XY2
109°28'
7、美国《科学》杂志评选2001年世界科技十大成就中,名列第五的日本青山学院大学教授秋光纯发现的金属间化合物硼化镁超导转变温度高达39K,该金属间化合物的晶体结构如下图。则它的化学式为( )
A.MgB B.Mg2B C.MgB2 D.Mg2B3
C
THANKS
第3章 不同聚集状态的物质与性质
第1节 认识晶体
第2课时 晶体结构的基本重复单元—晶胞
学习目标 核心素养培养
了解晶体中微粒的空间排布存在周期性,了解晶胞的概念,以及晶胞与晶体的关系。 宏观辨识与微观探析
认识简单的晶胞,会用切割法确定晶胞微粒数目(或微粒数目比)及晶体化学式。 证据推理与模型认知
知识体系
联想 质疑
通过X射线衍射等实验证明晶体是微粒按照一定规律可重复的周期型排列而无限堆积得到的。我们研究晶体的结构只需找出其中的基本的重复单元并加以分析,就可以了解整个晶体。晶体中这个基本的重复单元就是晶胞。
常见的晶体结构的最小重复单元晶胞的种类有哪些,晶胞中的微粒关系是怎样的?
二、晶体结构的基本单元——晶胞
1、晶胞是晶体结构中基本的重复单元。
常规的晶胞是从晶体结构中截取出来的大小、形状完全相同的平行六面体。
2、晶胞必须符合两个条件:
⑴代表晶体的化学组成; ⑵代表晶体的对称性。
3、从晶体中选取晶胞的方式:
首先尽可能反映晶体内结构的对称性;其次,晶胞尽量的简洁(所含原子尽可能的少),优选棱的夹角为直角。
知道了晶胞的大小和形状以及晶胞中所含微粒的种类、数目和空间位置,就可以了解整个晶体的结构。
常见的几种晶体的晶胞:
金属铜(面心立方)晶胞
金属钠(体心立方)晶胞
金属镁(六方)晶胞
氯化铯晶胞
氯化钠晶胞
金刚石晶胞
二氧化碳(干冰)晶胞
NaCl晶胞的无隙并置构成NaCl晶体
4. 晶胞按其周期性在三维空间重复排列(无隙并置堆砌)成晶体。
将一个个晶胞及其中包含的微粒上、下、前、后、左、右并置,就构成了整个晶体结构。每个晶胞都是平行排列,取向相同。
金属镁晶胞的无隙并置构成金属镁晶体
交流 研讨
知道了晶胞的大小和形状以及晶胞中所含微粒的种类、数目和空间位置,就可以了解整个晶体的结构。那么如何分析一个晶胞中包含的微粒数?
“切割法”计算:某晶胞中的微粒,如果被n个晶胞所共有,则微粒的n分之一属于该晶胞。
5. 晶胞中微粒数目的分析
⑴长方体形(正方体形)晶胞中不同位置的粒子数的计算
NaCl晶胞
CsCl晶胞
计算:NaCl晶胞、CsCl晶胞中含有的阴、阳离子数目分别是多少?
钠离子:1+12×1/4 = 4
氯离子:8 ×1/8+6×1/2 = 4
铯离子:1
氯离子:8 ×1/8= 1
⑵不规则晶胞中微粒数的计算
正六边形顶点 正六棱柱顶点 正六棱柱纵棱
石墨中的每个C被3个六边形共用,每个六边形2个C;
晶体中原子被6个六棱柱共用,各六棱柱分享1/6 个原子;
晶体中原子被3个六棱柱共用,各六棱柱分享1/3 个原子。
正三角形顶点:
正三角形纵棱:
A B C
思考:某晶体的一部分如右图,晶体中A、B、C三种粒子之比是 。
1:4:2
每个原子被12个三棱柱共用,各三棱柱分享1/12。
晶体中原子被6个三棱柱共用,各三棱柱分享1/6。
三棱柱晶胞中微粒数的计算
晶体中原子被4个三棱柱共用,各三棱柱分享1/4。
正三角形边上:
例1、某物质的晶体中含A、B、C三种元素,其晶胞中原子的排列方式如图所示,晶体中A、B、C的原子个数比为( )
典型例题
A.1∶3∶1 B.2∶3∶1
C.1∶2∶1 D.1∶3∶3
C
例2、硼和镁可形成超导化合物。如图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上、下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )
A.MgB B.Mg3B2
C.MgB2 D.Mg2B3
B
例3、(1)元素铜的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是 。
(2)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于6个面心和8个顶点,则该晶胞中有 个铜原子。
CuCl
16
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,左图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
(4)某晶体结构模型如右图所示。在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为 、 。
2
BN
6
12
1、现有甲、乙、丙(如下图)三种晶体的晶胞(甲中 x 处于晶胞的中心,乙中 a 处于晶胞的中心),可推知:
甲晶胞中 x 与 y 的个数比是 ,
乙晶胞中a与b的个数比是 ,
丙晶胞中有 个c离子,有 个d离子。
随堂练习
4∶3
1∶1
4
4
2、最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
A.Mg2CNi3 B.MgC2Ni C.MgCNi2 D.MgCNi3
D
3、已知某晶体晶胞如图所示,则该晶体的化学式为( )
A.XYZ B.X2Y4Z C.XY4Z D.X4Y2Z
C
4、如图所示,由金属原子M和非金属原子N构成的气态团簇分子,顶角和面上的原子是M原子,棱中心和体心的原子是N原子,则分子式可表示为 。
是气态团簇分子,不是晶胞,不能用切割法
M14N13或N13M14
5、如图所示的晶体结构是一种具有优良的压电、铁电、光电等功能的晶体材料的晶胞。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是 (各元素所带的电荷均已略去)
O原子
Ti原子
Ba原子
化学式为:BaTiO3
Ba:1×1
Ti:8× (1/8)
O:12× (1/4)
与每个“Ti”紧邻的氧原子数为6
BaTiO3
6
6、某离子晶体部分结构如图所示,X位于立方体的顶点,Y位于立方体的中心。试分析:
(1)在一个结构中有 个X, 个Y,所以该晶体的化学式为_____
(2)晶体中距离最近的2个X
与一个Y所形成的夹角
∠XYX角度为________(填角的度数)
1/2
1
XY2
109°28'
7、美国《科学》杂志评选2001年世界科技十大成就中,名列第五的日本青山学院大学教授秋光纯发现的金属间化合物硼化镁超导转变温度高达39K,该金属间化合物的晶体结构如下图。则它的化学式为( )
A.MgB B.Mg2B C.MgB2 D.Mg2B3
C
THANKS
