3.2.1 金属晶体-2023-2024学年高二化学鲁科版选择性必修第二册课件(共20张PPT)
文档属性
| 名称 | 3.2.1 金属晶体-2023-2024学年高二化学鲁科版选择性必修第二册课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 21:15:50 | ||
图片预览



文档简介
(共20张PPT)
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第1课时 金属晶体
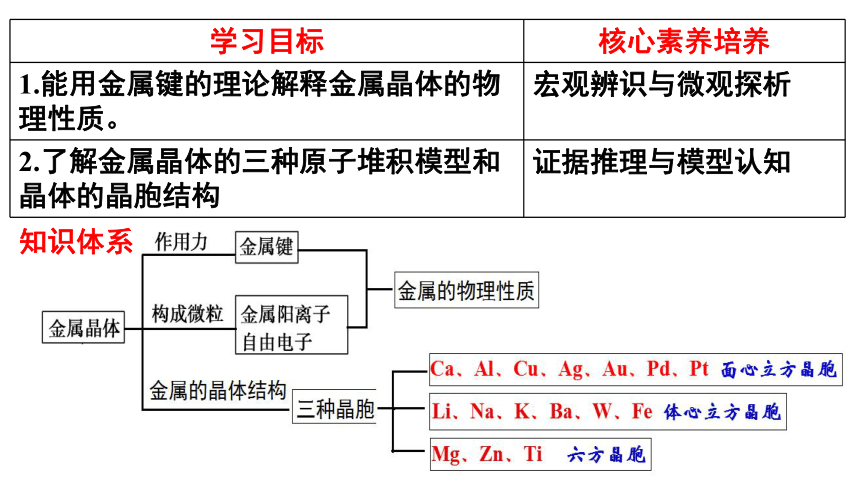
学习目标 核心素养培养
1.能用金属键的理论解释金属晶体的物理性质。 宏观辨识与微观探析
2.了解金属晶体的三种原子堆积模型和晶体的晶胞结构 证据推理与模型认知
知识体系
联想 质疑
晶体世界丰富多彩、复杂多样,我们今天就从简单的晶体:金属晶体、离子晶体、共价晶体和分子晶体入手来研究各种晶体的结构特点、性质和用途。
金属晶体、离子晶体、共价晶体和分子晶体的分类是根据构成晶体的微粒及微粒间的作用来分类的。我们首先从金属晶体开始分析晶体中微粒的空间排列、微粒的排列的影响因素和各类晶体的晶胞的特点。
一.金属晶体
⑴定义:金属原子通过金属键形成的晶体。
⑷金属键的特征:由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性。金属晶体可以看做等径圆球的堆积。
⑶成键微粒:金属阳离子和自由电子。
⑵金属键:金属阳离子和自由电子之间的较强的相互作用。
⑸金属键强弱判断:金属阳离子所带电荷越多、半径越小,金属键越强。金属键越强,金属晶体的熔点越高。
1.金属晶体的概念
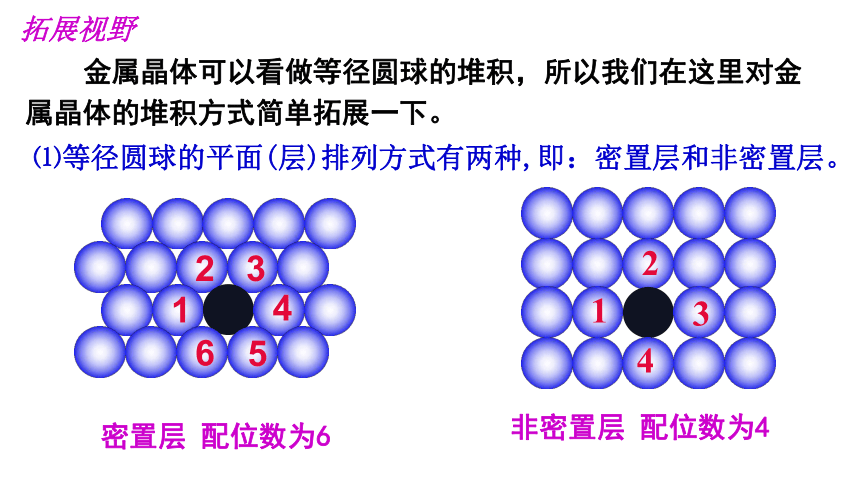
拓展视野
金属晶体可以看做等径圆球的堆积,所以我们在这里对金属晶体的堆积方式简单拓展一下。
1
4
3
2
非密置层 配位数为4
1
3
6
4
2
5
⑴等径圆球的平面(层)排列方式有两种,即:密置层和非密置层。
密置层 配位数为6
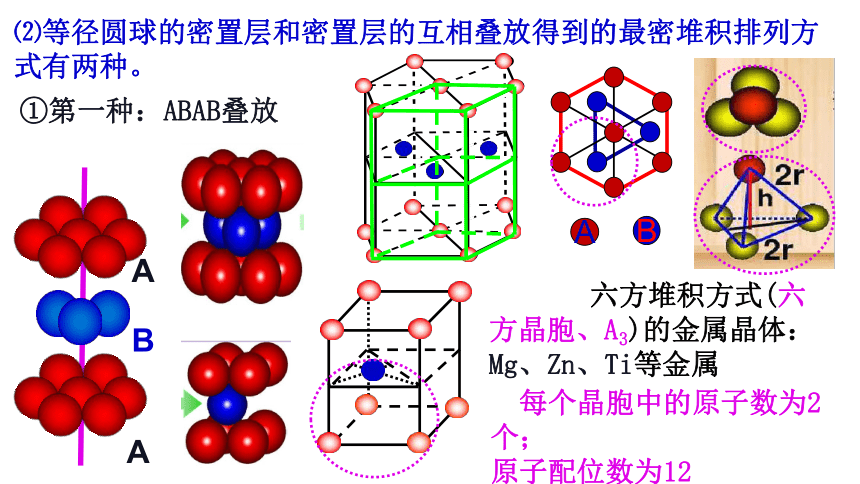
⑵等径圆球的密置层和密置层的互相叠放得到的最密堆积排列方式有两种。
A
B
A
A
B
六方堆积方式(六方晶胞、A3)的金属晶体: Mg、Zn、Ti等金属
每个晶胞中的原子数为2个;
原子配位数为12
①第一种:ABAB叠放
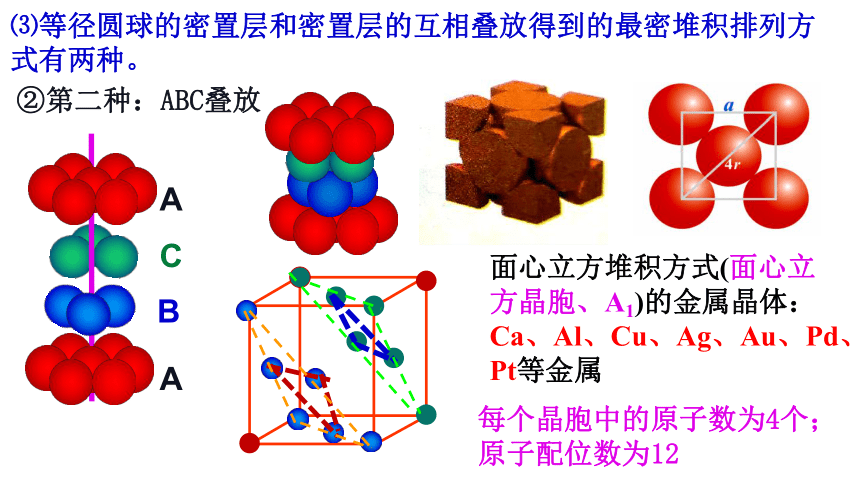
⑶等径圆球的密置层和密置层的互相叠放得到的最密堆积排列方式有两种。
②第二种:ABC叠放
A
B
C
A
面心立方堆积方式(面心立方晶胞、A1)的金属晶体:
Ca、Al、Cu、Ag、Au、Pd、Pt等金属
每个晶胞中的原子数为4个;原子配位数为12
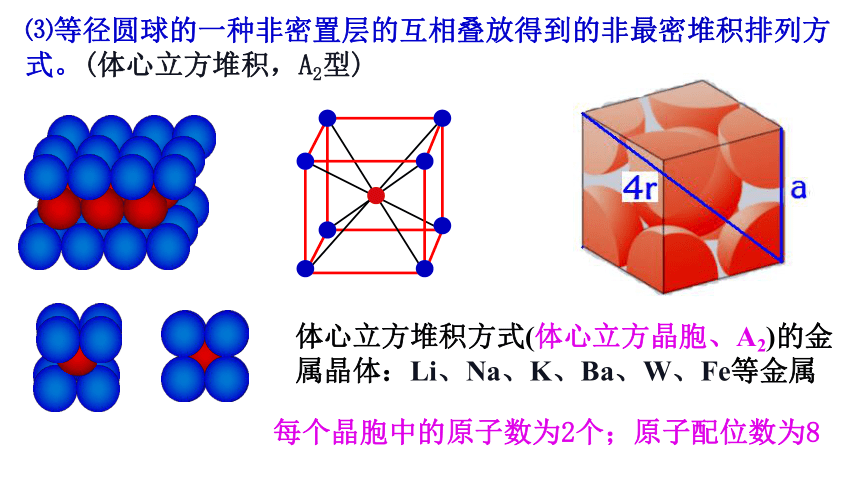
体心立方堆积方式(体心立方晶胞、A2)的金属晶体:Li、Na、K、Ba、W、Fe等金属
⑶等径圆球的一种非密置层的互相叠放得到的非最密堆积排列方式。(体心立方堆积,A2型)
每个晶胞中的原子数为2个;原子配位数为8
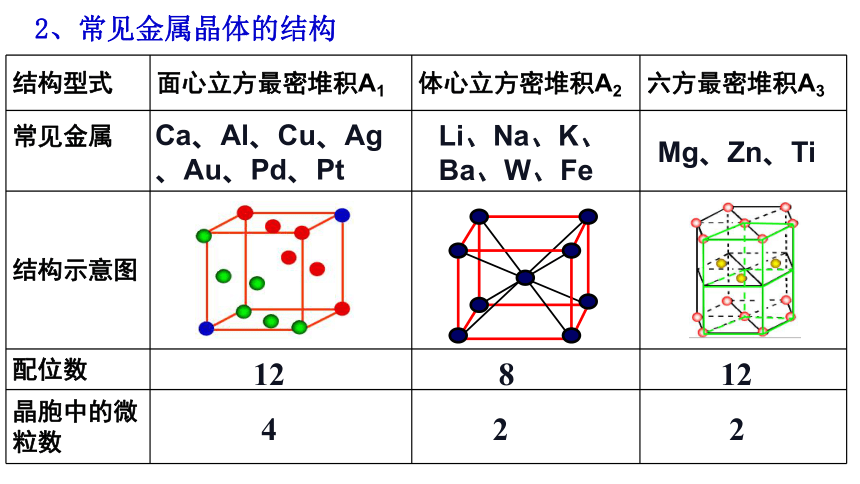
2、常见金属晶体的结构
结构型式 面心立方最密堆积A1 体心立方密堆积A2 六方最密堆积A3
常见金属
结构示意图
配位数
晶胞中的微粒数
12
8
12
2
4
Mg、Zn、Ti
Li、Na、K、Ba、W、Fe
Ca、Al、Cu、Ag、Au、Pd、Pt
2
⑴金属在通常状况下都是晶体吗
⑵为什么组成晶体的金属原子在没有其他因素影响时,在空间的排列大都服从紧密堆积原理
不都是晶体,如汞常温下是液态。
因为在金属晶体中,金属键没有方向性和饱和性,因此都趋向于使金属原子吸引更多的其他原子分布于周围,并以密堆积方式降低体系的能量,使晶体变得比较稳定。
交流 研讨
⑶合金为何比纯金属的性质优越?
合金内加入了其他元素或大或小的原子,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难。因此,在一般情况下,合金比纯金属硬度大。
⑷为什么金属具有较好的延性、展性和可塑性?
金属晶体中由于金属阳离子与自由电子间的相互作用没有方向性,各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变也不易断裂。金属晶体中原子的堆积方式也会影响金属的性质,具有最密堆积结构的金属延展性往往比其他结构的金属的延展性好。
3、金属晶体结构解释物理通性
(1)同类型的金属晶体的熔点由金属阳离子半径、离子所带的电荷数决定,阳离子半径越小,所带电荷越多,金属键就越强,晶体熔点就越高。例如熔点:Li>Na>K>Rb>Cs,Na4、金属晶体的熔点规律
(2)金属晶体的熔点差别较大,如Hg熔点很低,碱金属熔点较低,铁等金属熔点很高。这是由于金属晶体密堆积方式、金属阳离子和“自由电子”的作用力不同造成的。
(3)一般来说,同一周期主族金属单质的熔点由左到右逐渐升高,同一主族金属单质的熔点自上而下逐渐降低。
(4)合金的熔点一般低于其成分金属的熔点。
典型例题
例1、下列金属的晶体结构类型都属于面心立方最密堆积A1型的是( )
A. Li、Na、Mg、Ca B. Li、Na、K、Rb
C. Ca、Pt、Cu、Au D. Be、Mg、Ca、Zn
C
例2、已知某金属晶体的晶胞结构如图所示,则与该晶胞中任意一个顶点的原子距离相等且最近的原子数为( )
A. 6 B. 4 C. 8 D. 12
D
例3、
每个晶胞中包含铜原子数为4
(AC)=4r=
例4、要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
C
1、金属钠晶体为体心立方晶格(如下图),实验测得钠的密度为ρ (g·cm-3)。已知钠的相对原子质量为 a ,阿伏加德罗常数为NA (mol-1),假定钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为 .
练习
2、金属铜采取的是 A1 型密堆积,其晶胞边 长为 3.62×10-10 m,每1个 Cu 原子的质量为 1.05562×10-25 kg,计算铜的密度 ρ。
提示:金属铜采取 A1 型密堆积,其晶胞是 面心立方晶胞,每个晶胞中实际拥有的Cu 原子是 4 个,
3、铁有δ、γ、α三种晶体结构,如图是δ、γ、α三种晶体不同温度下转化的示意图,下列有关说法不正确的是( )
A.δ-Fe晶体中与每个铁原子距离相等且最近的铁原子有8个
B.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个
C.α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3∶4a3
D.将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D
THANKS
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第1课时 金属晶体
学习目标 核心素养培养
1.能用金属键的理论解释金属晶体的物理性质。 宏观辨识与微观探析
2.了解金属晶体的三种原子堆积模型和晶体的晶胞结构 证据推理与模型认知
知识体系
联想 质疑
晶体世界丰富多彩、复杂多样,我们今天就从简单的晶体:金属晶体、离子晶体、共价晶体和分子晶体入手来研究各种晶体的结构特点、性质和用途。
金属晶体、离子晶体、共价晶体和分子晶体的分类是根据构成晶体的微粒及微粒间的作用来分类的。我们首先从金属晶体开始分析晶体中微粒的空间排列、微粒的排列的影响因素和各类晶体的晶胞的特点。
一.金属晶体
⑴定义:金属原子通过金属键形成的晶体。
⑷金属键的特征:由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性。金属晶体可以看做等径圆球的堆积。
⑶成键微粒:金属阳离子和自由电子。
⑵金属键:金属阳离子和自由电子之间的较强的相互作用。
⑸金属键强弱判断:金属阳离子所带电荷越多、半径越小,金属键越强。金属键越强,金属晶体的熔点越高。
1.金属晶体的概念
拓展视野
金属晶体可以看做等径圆球的堆积,所以我们在这里对金属晶体的堆积方式简单拓展一下。
1
4
3
2
非密置层 配位数为4
1
3
6
4
2
5
⑴等径圆球的平面(层)排列方式有两种,即:密置层和非密置层。
密置层 配位数为6
⑵等径圆球的密置层和密置层的互相叠放得到的最密堆积排列方式有两种。
A
B
A
A
B
六方堆积方式(六方晶胞、A3)的金属晶体: Mg、Zn、Ti等金属
每个晶胞中的原子数为2个;
原子配位数为12
①第一种:ABAB叠放
⑶等径圆球的密置层和密置层的互相叠放得到的最密堆积排列方式有两种。
②第二种:ABC叠放
A
B
C
A
面心立方堆积方式(面心立方晶胞、A1)的金属晶体:
Ca、Al、Cu、Ag、Au、Pd、Pt等金属
每个晶胞中的原子数为4个;原子配位数为12
体心立方堆积方式(体心立方晶胞、A2)的金属晶体:Li、Na、K、Ba、W、Fe等金属
⑶等径圆球的一种非密置层的互相叠放得到的非最密堆积排列方式。(体心立方堆积,A2型)
每个晶胞中的原子数为2个;原子配位数为8
2、常见金属晶体的结构
结构型式 面心立方最密堆积A1 体心立方密堆积A2 六方最密堆积A3
常见金属
结构示意图
配位数
晶胞中的微粒数
12
8
12
2
4
Mg、Zn、Ti
Li、Na、K、Ba、W、Fe
Ca、Al、Cu、Ag、Au、Pd、Pt
2
⑴金属在通常状况下都是晶体吗
⑵为什么组成晶体的金属原子在没有其他因素影响时,在空间的排列大都服从紧密堆积原理
不都是晶体,如汞常温下是液态。
因为在金属晶体中,金属键没有方向性和饱和性,因此都趋向于使金属原子吸引更多的其他原子分布于周围,并以密堆积方式降低体系的能量,使晶体变得比较稳定。
交流 研讨
⑶合金为何比纯金属的性质优越?
合金内加入了其他元素或大或小的原子,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难。因此,在一般情况下,合金比纯金属硬度大。
⑷为什么金属具有较好的延性、展性和可塑性?
金属晶体中由于金属阳离子与自由电子间的相互作用没有方向性,各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变也不易断裂。金属晶体中原子的堆积方式也会影响金属的性质,具有最密堆积结构的金属延展性往往比其他结构的金属的延展性好。
3、金属晶体结构解释物理通性
(1)同类型的金属晶体的熔点由金属阳离子半径、离子所带的电荷数决定,阳离子半径越小,所带电荷越多,金属键就越强,晶体熔点就越高。例如熔点:Li>Na>K>Rb>Cs,Na
(2)金属晶体的熔点差别较大,如Hg熔点很低,碱金属熔点较低,铁等金属熔点很高。这是由于金属晶体密堆积方式、金属阳离子和“自由电子”的作用力不同造成的。
(3)一般来说,同一周期主族金属单质的熔点由左到右逐渐升高,同一主族金属单质的熔点自上而下逐渐降低。
(4)合金的熔点一般低于其成分金属的熔点。
典型例题
例1、下列金属的晶体结构类型都属于面心立方最密堆积A1型的是( )
A. Li、Na、Mg、Ca B. Li、Na、K、Rb
C. Ca、Pt、Cu、Au D. Be、Mg、Ca、Zn
C
例2、已知某金属晶体的晶胞结构如图所示,则与该晶胞中任意一个顶点的原子距离相等且最近的原子数为( )
A. 6 B. 4 C. 8 D. 12
D
例3、
每个晶胞中包含铜原子数为4
(AC)=4r=
例4、要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
C
1、金属钠晶体为体心立方晶格(如下图),实验测得钠的密度为ρ (g·cm-3)。已知钠的相对原子质量为 a ,阿伏加德罗常数为NA (mol-1),假定钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为 .
练习
2、金属铜采取的是 A1 型密堆积,其晶胞边 长为 3.62×10-10 m,每1个 Cu 原子的质量为 1.05562×10-25 kg,计算铜的密度 ρ。
提示:金属铜采取 A1 型密堆积,其晶胞是 面心立方晶胞,每个晶胞中实际拥有的Cu 原子是 4 个,
3、铁有δ、γ、α三种晶体结构,如图是δ、γ、α三种晶体不同温度下转化的示意图,下列有关说法不正确的是( )
A.δ-Fe晶体中与每个铁原子距离相等且最近的铁原子有8个
B.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个
C.α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3∶4a3
D.将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D
THANKS
