3.2.4 分子晶体(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 3.2.4 分子晶体(共25张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 00:00:00 | ||
图片预览






文档简介
(共25张PPT)
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第4课时 分子晶体
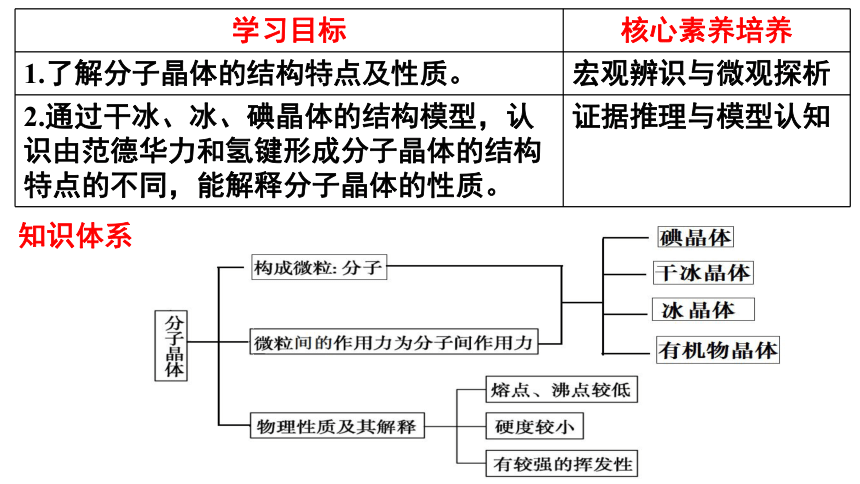
学习目标 核心素养培养
1.了解分子晶体的结构特点及性质。 宏观辨识与微观探析
2.通过干冰、冰、碘晶体的结构模型,认识由范德华力和氢键形成分子晶体的结构特点的不同,能解释分子晶体的性质。 证据推理与模型认知
知识体系
铜、钠、镁等金属的晶体是由金属阳离子和自由电子之间通过金属键的作用形成的,由于金属键没有方向性和饱和性,因此金属晶体可以看成等径圆球的密堆积。
复习 回顾
离子晶体是由阴、阳离子通过离子键的作用形成的晶体。由于阴、阳离子的半径大小不同,离子晶体属于不等径圆球的堆积,其中较大的离子按照等径圆球的方式进行密堆积,较小的离子有序地填充在半径大的离子所形成的空隙中。
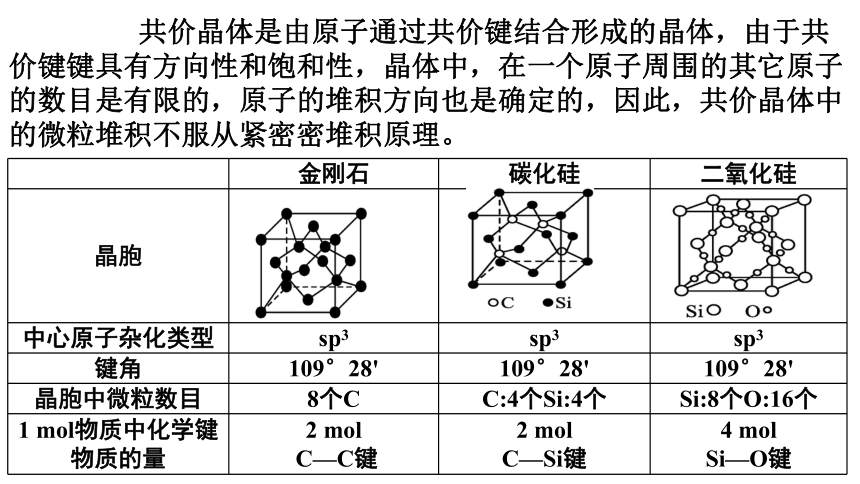
金刚石 碳化硅 二氧化硅
晶胞
中心原子杂化类型 sp3 sp3 sp3
键角 109°28' 109°28' 109°28'
晶胞中微粒数目 8个C C:4个Si:4个 Si:8个O:16个
1 mol物质中化学键物质的量 2 mol C—C键 2 mol C—Si键 4 mol
Si—O键
共价晶体是由原子通过共价键结合形成的晶体,由于共价键键具有方向性和饱和性,晶体中,在一个原子周围的其它原子的数目是有限的,原子的堆积方向也是确定的,因此,共价晶体中的微粒堆积不服从紧密密堆积原理。
联想 质疑
相邻原子间通过共价键形成分子,分子间通过分子间作用力(范德华力和氢键)结合形成分子晶体。
碘晶体、干冰晶体、冰等都是分子晶体,在这些在分子晶体的结构中,分子的排列又有怎样的规律和特点呢?从结构上分析为什么冰易融化,干冰易气化,碘晶体易升华?常见的分子晶体有哪些物质?以干冰晶体和碘晶体为例了解分子晶体中微粒间的数目、晶体的空间构型、晶体中微粒间的位置关系。
四、分子晶体
⑴定义:分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。
⑵构成晶体的微粒:分子(相邻原子间以共价键结合构成分子)。
⑶晶体微粒间的作用力:分子间作用力(包含范德华力和氢键)。
1、分子晶体的概念:
分子晶体气化或熔化时破坏的作用力:分子间作用力。
2.典型的分子晶体
(1)部分非金属单质: X2,O2,H2, S8,P4, C60 等
(2)非金属氢化物:H2O,NH3,CH4,HX 某些非金属氧化物:CO2, SO2, NO2,常见的的酸:H2SO4,HNO3,H3PO4等
(3)绝大多数有机物:乙醇,冰醋酸,蔗糖等
3、几种典型的分子晶体的结构
分子间以范德华力相结合的分子晶体,由于分子间作用力没有方向性和饱和性,分子构成晶体时尽可能地采取紧密堆积的方式形成晶体。如碘晶体、干冰晶体等。
⑴碘晶体
①碘晶体的晶胞:
晶胞为长方体(是一种变形的面心立方),8个顶点和6个面心各有一个碘分子,分子的方向有两种取向。氯单质、溴单质的晶体结构和碘非常类似,只是大小不同。
②晶胞的微粒数:
I2 8×1/8 + 6×1/2 =4
碘分子间以范德华力相结合,晶体熔化时只破坏范德华力,不影响分子内的化学键。
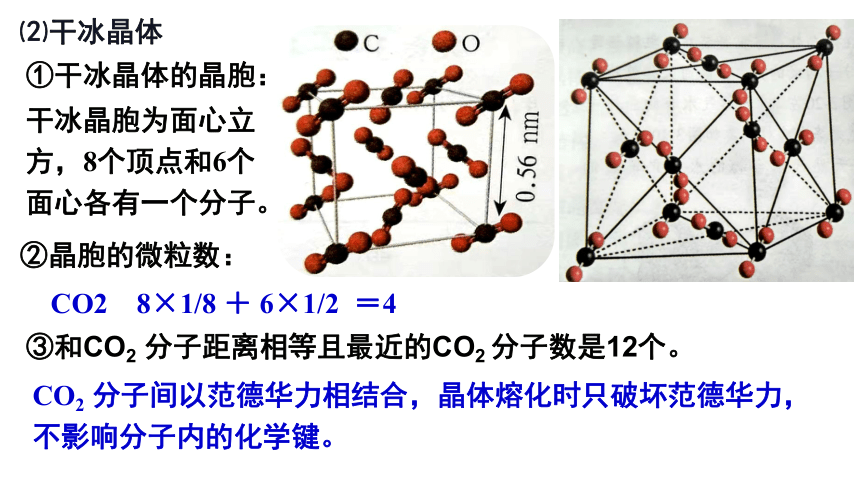
⑵干冰晶体
①干冰晶体的晶胞:
干冰晶胞为面心立方,8个顶点和6个面心各有一个分子。
②晶胞的微粒数:
CO2 8×1/8 + 6×1/2 =4
③和CO2 分子距离相等且最近的CO2 分子数是12个。
CO2 分子间以范德华力相结合,晶体熔化时只破坏范德华力,不影响分子内的化学键。
和碘晶体、干冰晶体一样,甲烷、碳-60的晶体,分子间以范德华力相结合的分子晶体,分子构成晶体时尽可能地采取紧密堆积的方式形成晶体。
冰晶体中水分子间存在哪几种相互作用?对冰晶体的结构与性质产生怎样的影响?
观察 思考
⑶冰的晶体结构
冰晶体是分子间以氢键相结合的分子晶体,由于氢键有方向性和饱和性,分子构成晶体时不采取紧密堆积的方式形成晶体。
冰晶体主要是水分子依靠氢键形成的(亦有范德华力),氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子互相吸引。由于氢键的方向性和饱和性,分子间距比较大,有很多空隙,结构比较松散,不符合紧密堆积。每个水分子周周有4个水分子,故配位数为4。
典型的分子晶体是指有限数目的原子以共价键结合为分子后,这些分子再通过分子间作用力结合形成晶体。一般来说,分子在无方向性的分子间作用力的作用下堆积时,尽可能利用空间紧密地堆积在一起,这一点与金属晶体相似。但是,分子的形状、分子的极性以及分子之间是否存在氢键等都会影响分子的堆积方式。
归纳 总结
如苯甲酸晶体中,苯甲酸分子排列形成层状结构,同一平面内分子之间通过氢键相互作用连接,平面之间的分子依靠范德华力维系。
⑴对于组成和结构相似、晶体中又不含氢键的分子晶体,相对分子质量越大,分子间作用力越 强,熔沸点越高;
如:烃的同分异构体中,支链越多,沸点越低。
4、分子晶体的物理性质
⑵由于分子间作用力很弱,所以分子晶体一般具有:
① 较低的熔点、沸点 ② 较小的硬度
③ 一般都是绝缘体,熔融状态不导电。
⑶对于能够形成分子间氢键的分子晶体,熔沸点显著升高。
例1、分子晶体具有的本质特征是( )
A.组成晶体的基本构成微粒是分子
B.熔融时不导电
C.晶体内微粒间以分子间作用力相结合,这种作用很弱
D.熔点一般比原子晶体低
C
典型例题
例2、下列分子晶体,关于熔点、沸点高低的叙述中,正确的是( )
A.Cl2>I2 B.SiCl4>CCl4
C.NH3<PH3 D.C(CH3)4>CH3CH2CH2CH2CH3
B
例3、SiCl4的分子结构与CCl4的相似,下列对SiCl4的推测不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子是由极性键形成的非极性分子
D.SiCl4为正四面体结构
例4、当SO3晶体熔化时,下述各项发生变化的是( )
A.化学键 B.硫与氧的原子个数之比
C.分子构型 D.分子间作用力
B
D
例5、某化学兴趣小组在学习分子晶体后,查阅了几种氯化物的熔点,记录如下:
NaCl MgCl2 AlCl3 SiCl4 CaCl2
熔点/℃ 801 712 190 -68 782
根据这些数据分析,他们认为属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2 B.AlCl3、SiCl4
C.NaCl、CaCl2 D.全部
B
例6、冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
在金刚石中每个碳原子以sp3杂化轨道与周围4个碳原子以共价键相结合形成正四面体结构,C—C键间的夹角为109°28'。冰晶体主要是水分子依靠氢键结合,氢键有方向性和饱和性,每个水分子与四面体顶点方向的4个相邻水分子互相吸引形成正四面体构形。分子间距比较大,有很多空隙,结构比较松散,不符合紧密堆积。
8
1、固体熔化时,必须破坏非极性共价键的是 ( )
A.冰 B.晶体硅 C.溴 D.二氧化硅
B
2、共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A. 干冰 B. 氯化钠
C. 氢氧化钠 D. 碘
B
练习
4、SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子是由极性键形成的非极性分子
D.SiCl4的熔点高于CCl4
B
3、下列物质的熔点高低顺序,正确的是( )
A.金刚石>晶体硅>碳化硅
B.K>Na>Li
C.NaF<NaCl<NaBr
D.CI4>CBr4>CCl4>CH4
D
5.下列有关分子晶体的说法中一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积
B
6.分子晶体在通常情况下不具有的性质是( )
A.晶体构成微粒是分子
B.干燥或熔化时均能导电
C.微粒间以范德华力结合
D.熔点、沸点一般低于原子晶体和离子晶体
B
7、下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力不相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-23.2 ℃,沸点136.2 ℃,所以TiCl4 属于分子晶体
D
7、下表列举了几种物质的性质,据此判断属于分子晶体的是 。
物质 性 质
X 熔点为10.31 ℃,液态不导电,水溶液导电
Y 易溶于CCl4,熔点为11.2 ℃,沸点为44.8 ℃
Z 常温下为气态,极易溶于水,溶液pH>7
W 常温下为固体,加热变为紫红色蒸气,遇冷变为紫黑色固体
M 熔点为1 170 ℃,易溶于水,水溶液导电
N 熔点为97.81℃,质软,导电,密度为0.97g·cm-3
X、Y、Z、W
8、 下列数据对应物质的熔点,据此作出下列判断中错误的是( )
Na2O NaCl AlF3 AlCl3
920 ℃ 801 ℃ 1 292 ℃ 190 ℃
BCl3 Al2O3 CO2 SiO2
-107 ℃ 2 073 ℃ -57 ℃ 1 723 ℃
A.铝的化合物的晶体中有离子晶体
B.表中只有BCl3和AlCl3是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
B
THANKS
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第4课时 分子晶体
学习目标 核心素养培养
1.了解分子晶体的结构特点及性质。 宏观辨识与微观探析
2.通过干冰、冰、碘晶体的结构模型,认识由范德华力和氢键形成分子晶体的结构特点的不同,能解释分子晶体的性质。 证据推理与模型认知
知识体系
铜、钠、镁等金属的晶体是由金属阳离子和自由电子之间通过金属键的作用形成的,由于金属键没有方向性和饱和性,因此金属晶体可以看成等径圆球的密堆积。
复习 回顾
离子晶体是由阴、阳离子通过离子键的作用形成的晶体。由于阴、阳离子的半径大小不同,离子晶体属于不等径圆球的堆积,其中较大的离子按照等径圆球的方式进行密堆积,较小的离子有序地填充在半径大的离子所形成的空隙中。
金刚石 碳化硅 二氧化硅
晶胞
中心原子杂化类型 sp3 sp3 sp3
键角 109°28' 109°28' 109°28'
晶胞中微粒数目 8个C C:4个Si:4个 Si:8个O:16个
1 mol物质中化学键物质的量 2 mol C—C键 2 mol C—Si键 4 mol
Si—O键
共价晶体是由原子通过共价键结合形成的晶体,由于共价键键具有方向性和饱和性,晶体中,在一个原子周围的其它原子的数目是有限的,原子的堆积方向也是确定的,因此,共价晶体中的微粒堆积不服从紧密密堆积原理。
联想 质疑
相邻原子间通过共价键形成分子,分子间通过分子间作用力(范德华力和氢键)结合形成分子晶体。
碘晶体、干冰晶体、冰等都是分子晶体,在这些在分子晶体的结构中,分子的排列又有怎样的规律和特点呢?从结构上分析为什么冰易融化,干冰易气化,碘晶体易升华?常见的分子晶体有哪些物质?以干冰晶体和碘晶体为例了解分子晶体中微粒间的数目、晶体的空间构型、晶体中微粒间的位置关系。
四、分子晶体
⑴定义:分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。
⑵构成晶体的微粒:分子(相邻原子间以共价键结合构成分子)。
⑶晶体微粒间的作用力:分子间作用力(包含范德华力和氢键)。
1、分子晶体的概念:
分子晶体气化或熔化时破坏的作用力:分子间作用力。
2.典型的分子晶体
(1)部分非金属单质: X2,O2,H2, S8,P4, C60 等
(2)非金属氢化物:H2O,NH3,CH4,HX 某些非金属氧化物:CO2, SO2, NO2,常见的的酸:H2SO4,HNO3,H3PO4等
(3)绝大多数有机物:乙醇,冰醋酸,蔗糖等
3、几种典型的分子晶体的结构
分子间以范德华力相结合的分子晶体,由于分子间作用力没有方向性和饱和性,分子构成晶体时尽可能地采取紧密堆积的方式形成晶体。如碘晶体、干冰晶体等。
⑴碘晶体
①碘晶体的晶胞:
晶胞为长方体(是一种变形的面心立方),8个顶点和6个面心各有一个碘分子,分子的方向有两种取向。氯单质、溴单质的晶体结构和碘非常类似,只是大小不同。
②晶胞的微粒数:
I2 8×1/8 + 6×1/2 =4
碘分子间以范德华力相结合,晶体熔化时只破坏范德华力,不影响分子内的化学键。
⑵干冰晶体
①干冰晶体的晶胞:
干冰晶胞为面心立方,8个顶点和6个面心各有一个分子。
②晶胞的微粒数:
CO2 8×1/8 + 6×1/2 =4
③和CO2 分子距离相等且最近的CO2 分子数是12个。
CO2 分子间以范德华力相结合,晶体熔化时只破坏范德华力,不影响分子内的化学键。
和碘晶体、干冰晶体一样,甲烷、碳-60的晶体,分子间以范德华力相结合的分子晶体,分子构成晶体时尽可能地采取紧密堆积的方式形成晶体。
冰晶体中水分子间存在哪几种相互作用?对冰晶体的结构与性质产生怎样的影响?
观察 思考
⑶冰的晶体结构
冰晶体是分子间以氢键相结合的分子晶体,由于氢键有方向性和饱和性,分子构成晶体时不采取紧密堆积的方式形成晶体。
冰晶体主要是水分子依靠氢键形成的(亦有范德华力),氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子互相吸引。由于氢键的方向性和饱和性,分子间距比较大,有很多空隙,结构比较松散,不符合紧密堆积。每个水分子周周有4个水分子,故配位数为4。
典型的分子晶体是指有限数目的原子以共价键结合为分子后,这些分子再通过分子间作用力结合形成晶体。一般来说,分子在无方向性的分子间作用力的作用下堆积时,尽可能利用空间紧密地堆积在一起,这一点与金属晶体相似。但是,分子的形状、分子的极性以及分子之间是否存在氢键等都会影响分子的堆积方式。
归纳 总结
如苯甲酸晶体中,苯甲酸分子排列形成层状结构,同一平面内分子之间通过氢键相互作用连接,平面之间的分子依靠范德华力维系。
⑴对于组成和结构相似、晶体中又不含氢键的分子晶体,相对分子质量越大,分子间作用力越 强,熔沸点越高;
如:烃的同分异构体中,支链越多,沸点越低。
4、分子晶体的物理性质
⑵由于分子间作用力很弱,所以分子晶体一般具有:
① 较低的熔点、沸点 ② 较小的硬度
③ 一般都是绝缘体,熔融状态不导电。
⑶对于能够形成分子间氢键的分子晶体,熔沸点显著升高。
例1、分子晶体具有的本质特征是( )
A.组成晶体的基本构成微粒是分子
B.熔融时不导电
C.晶体内微粒间以分子间作用力相结合,这种作用很弱
D.熔点一般比原子晶体低
C
典型例题
例2、下列分子晶体,关于熔点、沸点高低的叙述中,正确的是( )
A.Cl2>I2 B.SiCl4>CCl4
C.NH3<PH3 D.C(CH3)4>CH3CH2CH2CH2CH3
B
例3、SiCl4的分子结构与CCl4的相似,下列对SiCl4的推测不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子是由极性键形成的非极性分子
D.SiCl4为正四面体结构
例4、当SO3晶体熔化时,下述各项发生变化的是( )
A.化学键 B.硫与氧的原子个数之比
C.分子构型 D.分子间作用力
B
D
例5、某化学兴趣小组在学习分子晶体后,查阅了几种氯化物的熔点,记录如下:
NaCl MgCl2 AlCl3 SiCl4 CaCl2
熔点/℃ 801 712 190 -68 782
根据这些数据分析,他们认为属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2 B.AlCl3、SiCl4
C.NaCl、CaCl2 D.全部
B
例6、冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
在金刚石中每个碳原子以sp3杂化轨道与周围4个碳原子以共价键相结合形成正四面体结构,C—C键间的夹角为109°28'。冰晶体主要是水分子依靠氢键结合,氢键有方向性和饱和性,每个水分子与四面体顶点方向的4个相邻水分子互相吸引形成正四面体构形。分子间距比较大,有很多空隙,结构比较松散,不符合紧密堆积。
8
1、固体熔化时,必须破坏非极性共价键的是 ( )
A.冰 B.晶体硅 C.溴 D.二氧化硅
B
2、共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A. 干冰 B. 氯化钠
C. 氢氧化钠 D. 碘
B
练习
4、SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子是由极性键形成的非极性分子
D.SiCl4的熔点高于CCl4
B
3、下列物质的熔点高低顺序,正确的是( )
A.金刚石>晶体硅>碳化硅
B.K>Na>Li
C.NaF<NaCl<NaBr
D.CI4>CBr4>CCl4>CH4
D
5.下列有关分子晶体的说法中一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积
B
6.分子晶体在通常情况下不具有的性质是( )
A.晶体构成微粒是分子
B.干燥或熔化时均能导电
C.微粒间以范德华力结合
D.熔点、沸点一般低于原子晶体和离子晶体
B
7、下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力不相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-23.2 ℃,沸点136.2 ℃,所以TiCl4 属于分子晶体
D
7、下表列举了几种物质的性质,据此判断属于分子晶体的是 。
物质 性 质
X 熔点为10.31 ℃,液态不导电,水溶液导电
Y 易溶于CCl4,熔点为11.2 ℃,沸点为44.8 ℃
Z 常温下为气态,极易溶于水,溶液pH>7
W 常温下为固体,加热变为紫红色蒸气,遇冷变为紫黑色固体
M 熔点为1 170 ℃,易溶于水,水溶液导电
N 熔点为97.81℃,质软,导电,密度为0.97g·cm-3
X、Y、Z、W
8、 下列数据对应物质的熔点,据此作出下列判断中错误的是( )
Na2O NaCl AlF3 AlCl3
920 ℃ 801 ℃ 1 292 ℃ 190 ℃
BCl3 Al2O3 CO2 SiO2
-107 ℃ 2 073 ℃ -57 ℃ 1 723 ℃
A.铝的化合物的晶体中有离子晶体
B.表中只有BCl3和AlCl3是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
B
THANKS
