3.2.5 晶体结构的复杂性(共20张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件
文档属性
| 名称 | 3.2.5 晶体结构的复杂性(共20张PPT)-2023-2024学年高二化学鲁科版选择性必修第二册课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-19 21:20:17 | ||
图片预览




文档简介
(共20张PPT)
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第5课时 晶体结构的复杂性
学习目标 核心素养培养
1、认识石墨晶体的特殊结构,部分硅酸盐的的阴离子结构的丰富多样性。 宏观辨识与微观探析
2、知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的 证据推理与模型认知
变化观念与平衡思想
知识体系
五、晶体结构的复杂性
通过前面学习,我们知道金属晶体易导电、有延展性;原子晶体熔沸点高、硬度大;分子晶体不导电、熔沸点低、硬度小,而石墨能导电、熔点高、具有润滑性等特性,从结构上如何解释呢?
联想 质疑
阅读课本第103—104页相关内容,从结构上分析石墨高熔点、导电、质软、原因?石墨属于什么类型晶体?
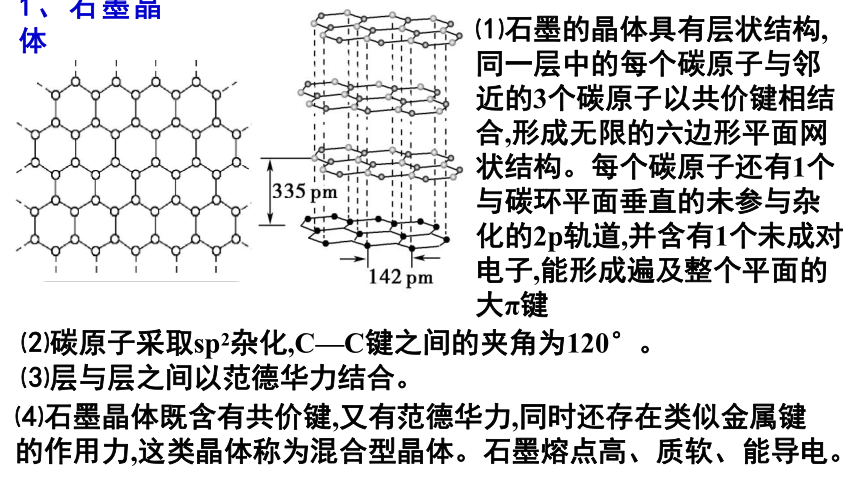
1、石墨晶体
⑵碳原子采取sp2杂化,C—C键之间的夹角为120°。
⑶层与层之间以范德华力结合。
⑴石墨的晶体具有层状结构,同一层中的每个碳原子与邻近的3个碳原子以共价键相结合,形成无限的六边形平面网状结构。每个碳原子还有1个
与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,能形成遍及整个平面的大π键
⑷石墨晶体既含有共价键,又有范德华力,同时还存在类似金属键的作用力,这类晶体称为混合型晶体。石墨熔点高、质软、能导电。
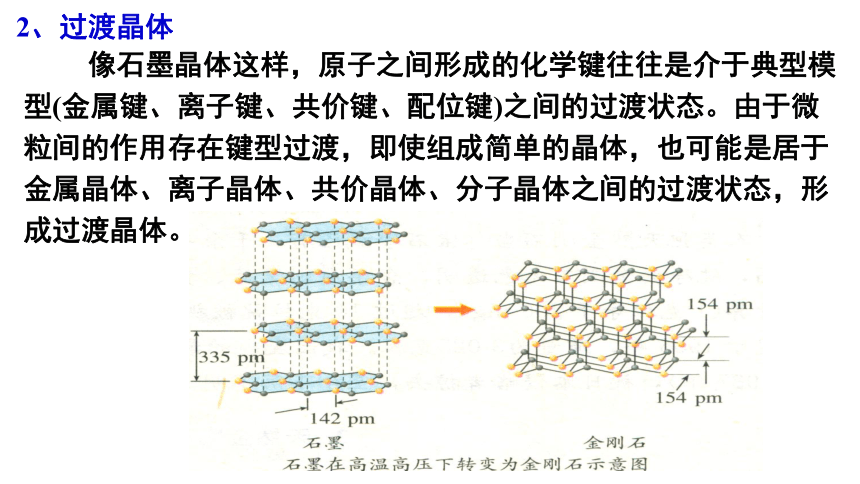
像石墨晶体这样,原子之间形成的化学键往往是介于典型模型(金属键、离子键、共价键、配位键)之间的过渡状态。由于微粒间的作用存在键型过渡,即使组成简单的晶体,也可能是居于金属晶体、离子晶体、共价晶体、分子晶体之间的过渡状态,形成过渡晶体。
2、过渡晶体
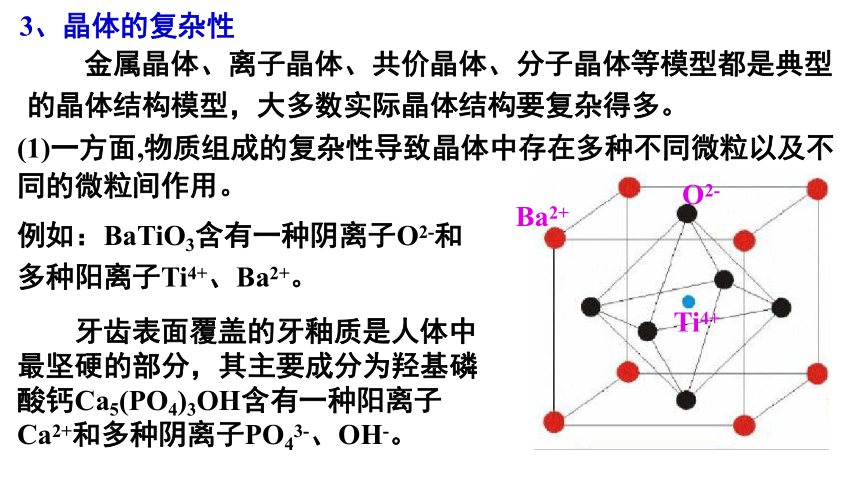
(1)一方面,物质组成的复杂性导致晶体中存在多种不同微粒以及不同的微粒间作用。
3、晶体的复杂性
例如:BaTiO3含有一种阴离子O2-和多种阳离子Ti4+、Ba2+。
金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多。
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,其主要成分为羟基磷酸钙Ca5(PO4)3OH含有一种阳离子Ca2+和多种阴离子PO43-、OH-。
O2-
Ba2+
Ti4+
又如:在Na2SiO3固体中并不存在单个的简单SiO32-,Si通过共价键与4个O原子相连,形成硅氧四面体。硅氧四面体通过共用顶角O原子而连成较大的链状硅酸盐{SiO32-}∞单元(如图所示),带负电的链状硅酸盐{SiO32-}∞单元与金属阳离子以离子键相互作用。
(2)另一方面,金属键、离子键、共价键、配位键等都是化学键的典型模型,但是原子之间形成的化学键往往是介于典型模型之间的过渡状态。即使组成简单的晶体,也可能是居于金属晶体、离子晶体、共价晶体、分子晶体之间的过渡晶体。
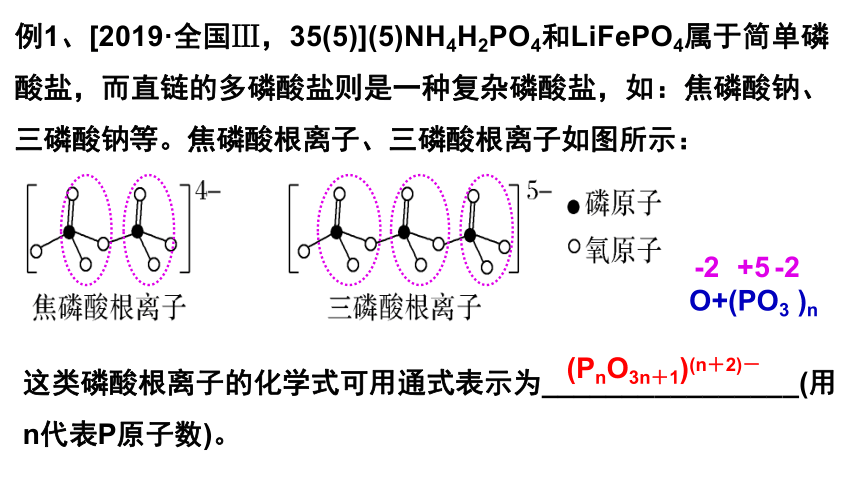
例1、[2019·全国Ⅲ,35(5)](5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
(PnO3n+1)(n+2)-
O+(PO3 )n
-2
+5
-2
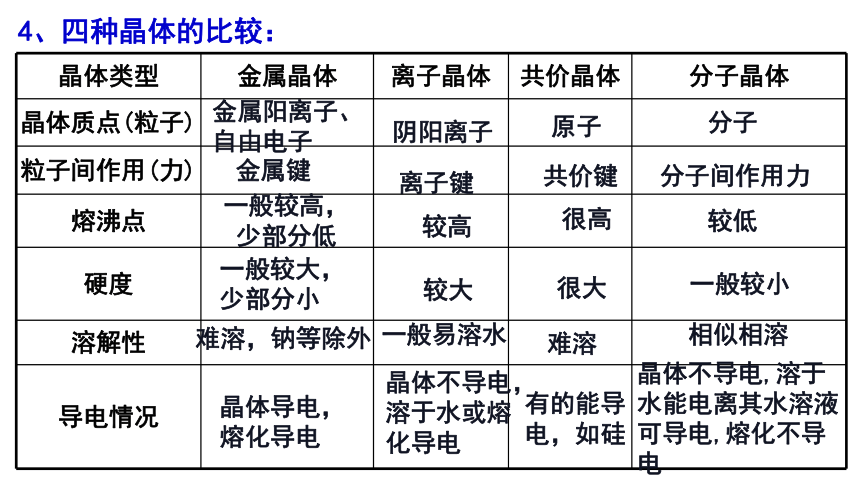
4、四种晶体的比较:
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
晶体质点(粒子)
粒子间作用(力)
熔沸点
硬度
溶解性
导电情况
阴阳离子
原子
分子
金属阳离子、自由电子
离子键
共价键
分子间作用力
金属键
一般较高,少部分低
较高
很高
较低
较大
很大
一般较小
一般较大,少部分小
一般易溶水
难溶
相似相溶
难溶,钠等除外
晶体不导电,溶于水能电离其水溶液可导电,熔化不导电
晶体不导电, 溶于水或熔化导电
有的能导电,如硅
晶体导电,熔化导电
2、根据物质不同结构特点判断
1、根据物质状态判断
即物质沸点高低按常温下的状态:固体>液体>气体。
如:NaCl>H2O>CO2。
六、各类晶体的熔点大小比较
⑷分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。如:CH4<SiH4<GeH4<SnH4。
②因为氢键>范德华力,所以存在分子间氢键的物质沸点高于只存在范德华力的物质。如:乙醇>氯乙烷;HF>HCl。
⑵离子晶体:阴、阳离子半径越小,电荷数越多,则离子键越强,晶格能越大,熔、沸点越高,反之越低。如KCl>KBr。
⑶共价晶体:共价晶体间键长越短、键能越大,共价键越稳定,物质熔、沸点越高,反之越低。如:金刚石(C—C)>晶体硅(Si—Si)。
⑴金属晶体:原子半径越小,价电子数越多,金属键越强,晶体熔、沸点越高,硬度越大,反之越低。如:熔点、硬度:钠<镁<铝。
例2、下列表述不正确的是( )
A、熔点:CF4B、硬度:金刚石>碳化硅>晶体硅
C、晶格能:NaF>NaCl>NaBr>NaI
D、熔点:Na>Mg>Al
D
例3、在40 GPa的高压下,用激光加热到1 800 K,人们成功制得了共价晶体CO2,下列对该物质的推断一定不正确的是( )
A.该共价晶体中含有极性键
B.该共价晶体易汽化,可用作制冷材料
C.该共价晶体有很高的熔点、沸点
D.该共价晶体硬度大,可用作耐磨材料
B
例4、碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
同素异形体
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、_______。
sp2
sp3
(3)C60属于________晶体,石墨属于________晶体。
分子
混合型
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的_____共价键,而石墨层内的C—C间不仅存在_____共价键,还有____键。
σ
σ
π
(5)C60的晶体结构类似于干冰,则每个C60晶胞的质量为________g(用含NA的式子表示,NA为阿伏加德罗常数的值)。
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= a,列式表示碳原子在晶胞中的空间占有率 (列出计算式即可)。
8
(7)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是____NA个(NA为阿伏加德罗常数的值)
2
C—C键的键长2r=
r=
七、有关晶胞计算的思维流程
核查长度单位!
各类晶胞的体积计算
作业:
THANKS
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第5课时 晶体结构的复杂性
学习目标 核心素养培养
1、认识石墨晶体的特殊结构,部分硅酸盐的的阴离子结构的丰富多样性。 宏观辨识与微观探析
2、知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的 证据推理与模型认知
变化观念与平衡思想
知识体系
五、晶体结构的复杂性
通过前面学习,我们知道金属晶体易导电、有延展性;原子晶体熔沸点高、硬度大;分子晶体不导电、熔沸点低、硬度小,而石墨能导电、熔点高、具有润滑性等特性,从结构上如何解释呢?
联想 质疑
阅读课本第103—104页相关内容,从结构上分析石墨高熔点、导电、质软、原因?石墨属于什么类型晶体?
1、石墨晶体
⑵碳原子采取sp2杂化,C—C键之间的夹角为120°。
⑶层与层之间以范德华力结合。
⑴石墨的晶体具有层状结构,同一层中的每个碳原子与邻近的3个碳原子以共价键相结合,形成无限的六边形平面网状结构。每个碳原子还有1个
与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,能形成遍及整个平面的大π键
⑷石墨晶体既含有共价键,又有范德华力,同时还存在类似金属键的作用力,这类晶体称为混合型晶体。石墨熔点高、质软、能导电。
像石墨晶体这样,原子之间形成的化学键往往是介于典型模型(金属键、离子键、共价键、配位键)之间的过渡状态。由于微粒间的作用存在键型过渡,即使组成简单的晶体,也可能是居于金属晶体、离子晶体、共价晶体、分子晶体之间的过渡状态,形成过渡晶体。
2、过渡晶体
(1)一方面,物质组成的复杂性导致晶体中存在多种不同微粒以及不同的微粒间作用。
3、晶体的复杂性
例如:BaTiO3含有一种阴离子O2-和多种阳离子Ti4+、Ba2+。
金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多。
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,其主要成分为羟基磷酸钙Ca5(PO4)3OH含有一种阳离子Ca2+和多种阴离子PO43-、OH-。
O2-
Ba2+
Ti4+
又如:在Na2SiO3固体中并不存在单个的简单SiO32-,Si通过共价键与4个O原子相连,形成硅氧四面体。硅氧四面体通过共用顶角O原子而连成较大的链状硅酸盐{SiO32-}∞单元(如图所示),带负电的链状硅酸盐{SiO32-}∞单元与金属阳离子以离子键相互作用。
(2)另一方面,金属键、离子键、共价键、配位键等都是化学键的典型模型,但是原子之间形成的化学键往往是介于典型模型之间的过渡状态。即使组成简单的晶体,也可能是居于金属晶体、离子晶体、共价晶体、分子晶体之间的过渡晶体。
例1、[2019·全国Ⅲ,35(5)](5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
(PnO3n+1)(n+2)-
O+(PO3 )n
-2
+5
-2
4、四种晶体的比较:
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
晶体质点(粒子)
粒子间作用(力)
熔沸点
硬度
溶解性
导电情况
阴阳离子
原子
分子
金属阳离子、自由电子
离子键
共价键
分子间作用力
金属键
一般较高,少部分低
较高
很高
较低
较大
很大
一般较小
一般较大,少部分小
一般易溶水
难溶
相似相溶
难溶,钠等除外
晶体不导电,溶于水能电离其水溶液可导电,熔化不导电
晶体不导电, 溶于水或熔化导电
有的能导电,如硅
晶体导电,熔化导电
2、根据物质不同结构特点判断
1、根据物质状态判断
即物质沸点高低按常温下的状态:固体>液体>气体。
如:NaCl>H2O>CO2。
六、各类晶体的熔点大小比较
⑷分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。如:CH4<SiH4<GeH4<SnH4。
②因为氢键>范德华力,所以存在分子间氢键的物质沸点高于只存在范德华力的物质。如:乙醇>氯乙烷;HF>HCl。
⑵离子晶体:阴、阳离子半径越小,电荷数越多,则离子键越强,晶格能越大,熔、沸点越高,反之越低。如KCl>KBr。
⑶共价晶体:共价晶体间键长越短、键能越大,共价键越稳定,物质熔、沸点越高,反之越低。如:金刚石(C—C)>晶体硅(Si—Si)。
⑴金属晶体:原子半径越小,价电子数越多,金属键越强,晶体熔、沸点越高,硬度越大,反之越低。如:熔点、硬度:钠<镁<铝。
例2、下列表述不正确的是( )
A、熔点:CF4
C、晶格能:NaF>NaCl>NaBr>NaI
D、熔点:Na>Mg>Al
D
例3、在40 GPa的高压下,用激光加热到1 800 K,人们成功制得了共价晶体CO2,下列对该物质的推断一定不正确的是( )
A.该共价晶体中含有极性键
B.该共价晶体易汽化,可用作制冷材料
C.该共价晶体有很高的熔点、沸点
D.该共价晶体硬度大,可用作耐磨材料
B
例4、碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
同素异形体
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、_______。
sp2
sp3
(3)C60属于________晶体,石墨属于________晶体。
分子
混合型
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的_____共价键,而石墨层内的C—C间不仅存在_____共价键,还有____键。
σ
σ
π
(5)C60的晶体结构类似于干冰,则每个C60晶胞的质量为________g(用含NA的式子表示,NA为阿伏加德罗常数的值)。
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= a,列式表示碳原子在晶胞中的空间占有率 (列出计算式即可)。
8
(7)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是____NA个(NA为阿伏加德罗常数的值)
2
C—C键的键长2r=
r=
七、有关晶胞计算的思维流程
核查长度单位!
各类晶胞的体积计算
作业:
THANKS
