2024人教版高中化学选择性必修2同步练习题--第2课时 杂化轨道理论(含解析)
文档属性
| 名称 | 2024人教版高中化学选择性必修2同步练习题--第2课时 杂化轨道理论(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 09:02:05 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024人教版高中化学选择性必修2同步
第二章 分子结构与性质
第二节 分子的空间结构
第2课时 杂化轨道理论
基础过关练
题组一 杂化轨道理论
1.(原创题)下列说法中,错误的是( )
A.H原子成键时不可能有杂化轨道
B.2s轨道与3p轨道能形成杂化轨道
C.s轨道和p轨道杂化不可能有sp4杂化轨道出现
D.杂化轨道理论是一种价键理论,是为了解释分子的空间结构提出的
2.(2023江西新余一中期末)关于H2O2、CO2、BF3、CH3COOH的下列说法正确的是( )
A.H2O2分子中的O为sp2杂化
B.CO2分子中的C原子为sp杂化
C.BF3分子中的B原子为sp3杂化
D.CH3COOH分子中的C原子均为sp2杂化
3.(2023吉林长春五中期末)下列有机物分子中的碳原子既有sp3杂化又有sp杂化的是( )
A.CH3CH CH2 B.
C.CH3CH2OH D.
4.(2023湖北武汉六中月考)乙烯分子结构如图所示,其一个分子中有5个σ键、1个π键,下列表述正确的是( )
A.C原子的sp2杂化轨道与H原子的1s轨道形成σ键
B.C原子的sp2杂化轨道与H原子的1s轨道形成π键
C.C原子的2p轨道与C原子的2p轨道形成σ键
D.C原子的sp2杂化轨道与C原子的sp2杂化轨道形成π键
5.下列叙述中,不正确的是( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道用于形成σ键或用于容纳未参与成键的孤电子对
C.NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键
D.用杂化轨道理论与VSEPR模型分析分子空间结构的结果常常相互矛盾
题组二 杂化轨道理论与分子空间结构的关系
6.(2022浙江诸暨中学期中)下列说法中正确的是 ( )
A.PCl3分子是三角锥形,这是因为P原子采取sp2杂化
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混杂形成的
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形
D.AB3型分子的空间结构必为平面三角形
7.(1)在SO2分子中,S原子采取 杂化,SO2的键角 (填“大于”“等于”或“小于”)120°,SO3分子中S原子采取 杂化,SO3分子的空间结构为 。
(2)N的空间结构是 ,N原子采取 杂化。
(3)S、S的空间结构分别为 、 ,S原子的杂化轨道类型分别为 、 。
能力提升练
题组 杂化轨道理论的理解及应用
1.下列关于原子轨道的说法正确的是( )
A.中心原子采取sp3杂化的分子,其空间结构都是四面体形
B.CH4中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混杂而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混杂形成的一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采取sp3杂化
2.(2023福建龙岩一中月考)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在,三者的结构依次如图所示。其单体、二聚体和多聚体中Be的杂化轨道类型依次为( )
Cl—Be—Cl、、
A.sp3、sp2、sp B.sp2、sp、sp3
C.sp2、sp3、sp D.sp、sp2、sp3
3.(2023吉林田家炳中学期末)下列分子中,中心原子的杂化类型相同,分子空间结构也相同的是( )
A.BeCl2、CO2 B.H2O、NH3
C.NH3、HCHO D.H2O、SO2
4.推理是学习化学知识的一种重要方法。下列推理合理的是( )
A.SO2中硫原子采取sp2杂化,则CO2中碳原子也采取sp2杂化
B.NH3分子的空间结构是三角锥形,则NCl3分子的空间结构也是三角锥形
C.H2O分子的键角是105°,则H2S分子的键角也是105°
D.PCl3分子中所有原子最外层都达到8电子稳定结构,则BF3分子中所有原子最外层也都达到8电子稳定结构
5.(经典题)已知XY2为V形分子,下列说法正确的是( )
A.X原子一定采取sp2杂化
B.X原子一定采取sp3杂化
C.X原子上一定存在孤电子对
D.VSEPR模型一定是平面三角形
6.(2023重庆八中月考)下列描述中错误的是( )
A.BF3和B的中心原子杂化方式不同
B.C和Cl具有相同的空间结构
C.BBr3和SF6的中心原子均不满足8电子结构
D.三氧化硫的三聚分子()中S原子的杂化轨道类型为sp3
7.(2023辽宁部分重点中学期末联考)下列关于N、NH3、N三种微粒的说法不正确的是( )
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同
D.键角大小关系:N>NH3>N
8.化合物A是近年来采用的锅炉水添加剂,其结构式如图所示,A能除去锅炉水中溶解的氧气。下列说法正确的是( )
A.A分子中所有原子都在同一平面内
B.A分子中所含的σ键与π键个数之比为10∶1
C.A分子中C、N均为sp2杂化
D.A与足量O2反应生成CO2、N2、H2O的物质的量之比为1∶2∶3
9.(原创题)聚氯乙烯的一种制备流程如下:
对于该流程中涉及的几种物质及反应,下列说法正确的是( )
A.乙炔分子中的C原子用sp杂化轨道形成了一个σ键和两个π键
B.氯乙烯分子中所有原子都在同一平面上
C.氯乙烯和聚氯乙烯分子中C原子采取的杂化方式相同
D.上述流程中发生加成反应和加聚反应的过程中,C原子的杂化方式不一定发生改变
10.(2023山东济南学情检测)关于CH3OH、N2H4和(CH3)2NNH2,下列说法错误的是( )
A.1 mol CH3OH中含5 mol σ键
B.N2H4分子中所有原子不可能处于同一平面
C.三者孤电子对数相同
D.三者中C、O、N杂化方式不相同
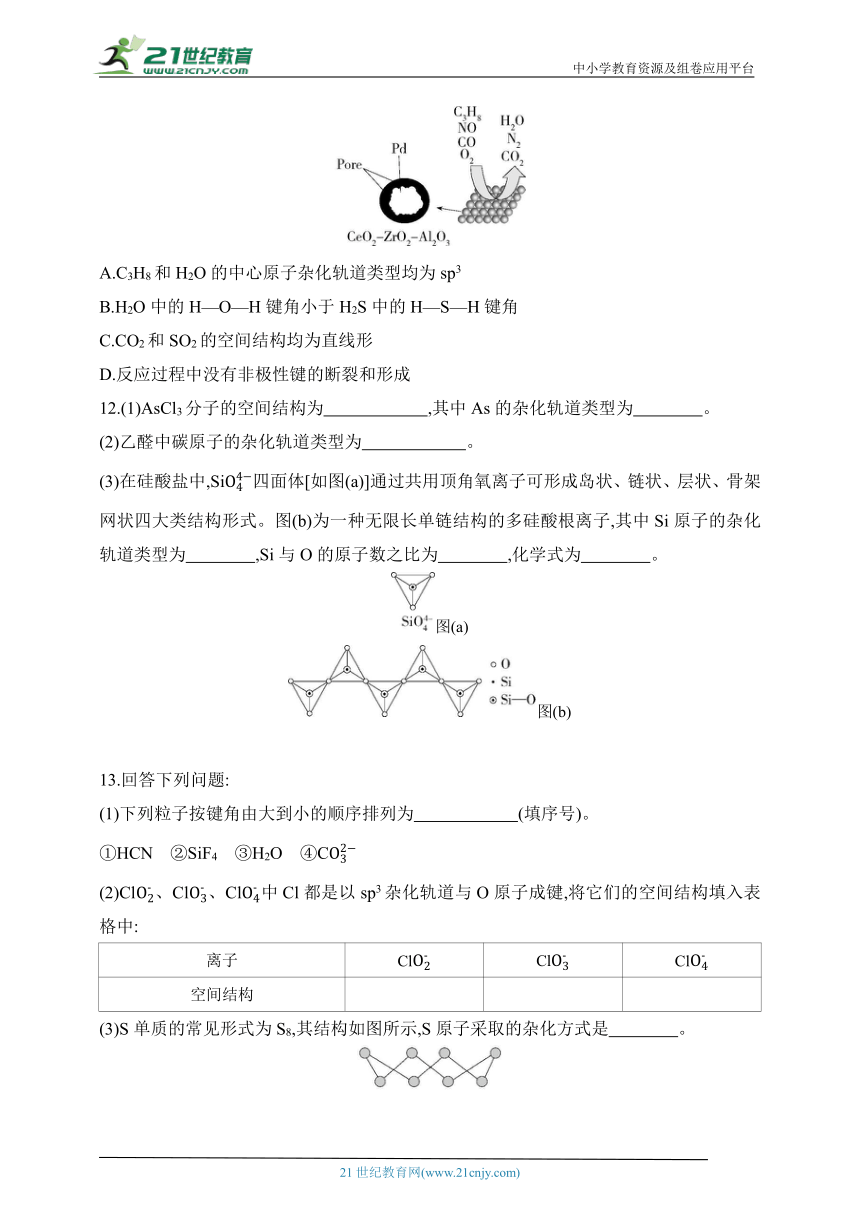
11.(2022山东聊城期末)目前我国研制的稀土催化剂转化汽车尾气过程示意图如下,汽车尾气的主要成分有CO、NO等。下列有关说法正确的是( )
A.C3H8和H2O的中心原子杂化轨道类型均为sp3
B.H2O中的H—O—H键角小于H2S中的H—S—H键角
C.CO2和SO2的空间结构均为直线形
D.反应过程中没有非极性键的断裂和形成
12.(1)AsCl3分子的空间结构为 ,其中As的杂化轨道类型为 。
(2)乙醛中碳原子的杂化轨道类型为 。
(3)在硅酸盐中,Si四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构形式。图(b)为一种无限长单链结构的多硅酸根离子,其中Si原子的杂化轨道类型为 ,Si与O的原子数之比为 ,化学式为 。
图(a)
图(b)
13.回答下列问题:
(1)下列粒子按键角由大到小的顺序排列为 (填序号)。
①HCN ②SiF4 ③H2O ④C
(2)Cl、Cl、Cl中Cl都是以sp3杂化轨道与O原子成键,将它们的空间结构填入表格中:
离子 Cl Cl Cl
空间结构
(3)S单质的常见形式为S8,其结构如图所示,S原子采取的杂化方式是 。
答案与分层梯度式解析
第二章 分子结构与性质
第二节 分子的空间结构
第2课时 杂化轨道理论
基础过关练
1.B 2.B 3.B 4.A 5.D 6.C
1.B H原子只有一个电子,在1s能级上,不可能杂化,A项正确;只有能量相近的轨道才能杂化,B项错误;p能级只有3个p轨道,s轨道和p轨道杂化不可能有sp4杂化轨道,C项正确。
2.B H2O2分子中O为sp3杂化,A错误;CO2分子中C原子为sp杂化,B正确;BF3分子中B原子为sp2杂化,C错误;CH3COOH分子羧基中的C原子是sp2杂化,甲基中的碳原子是sp3杂化,D错误。
3.B CH3CH CH2中碳原子为sp2杂化和sp3杂化,A不符合题意;中碳原子为sp3杂化和sp杂化,B符合题意;CH3CH2OH中碳原子为sp3杂化,C不符合题意;中碳原子为sp杂化,D不符合题意。
4.A C—H键是C原子的sp2杂化轨道与H原子的1s轨道形成的σ键,故A正确;C C键中一个C原子的2p轨道与另一个C原子的2p轨道形成π键,故B、D错误;C C键中C原子的sp2杂化轨道与另一个C原子的sp2杂化轨道形成σ键,故C错误。
归纳总结 杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对,不能用于形成π键;未参与杂化的p轨道可用于形成π键。
5.D 中心原子通过sp3杂化轨道成键的分子可能是正四面体形(如CH4)、三角锥形(如NH3)或者V形(如H2O),A正确;杂化轨道用于形成σ键或用于容纳孤电子对,B正确;正四面体形的CH4和三角锥形的NH3中,中心原子C和N都是通过sp3杂化轨道成键,C正确;杂化轨道理论和VSEPR模型都是为了解释分子的空间结构而提出的,两者不矛盾,可以通过VSEPR模型确定中心原子的杂化轨道类型,D错误。
特别提醒 (1)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化的原子轨道数目相等。
(2)杂化过程中,轨道的形状发生变化,杂化轨道的形状相同,能量相同,方向不同。
6.C PCl3分子的中心原子P含有3个成键电子对和1个孤电子对,属于sp3杂化,含有1个孤电子对,所以空间结构为三角锥形,A错误;能量相近的s轨道和p轨道形成杂化轨道,则sp3杂化轨道是能量相近的1个s轨道和3个p轨道混杂形成的,B错误;中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形,C正确;AB3型分子的空间结构与中心原子的孤电子对数有关,如BF3中B原子没有孤电子对,为平面三角形,NH3中N原子有1个孤电子对,为三角锥形,D错误。
7.答案 (1)sp2 小于 sp2 平面三角形
(2)V形 sp2
(3)正四面体形 三角锥形 sp3 sp3
解析 (1)SO2分子中,S原子的孤电子对数=(6-2×2)=1,价层电子对数=2+1=3,S原子采取sp2杂化,因有1个孤电子对,所以键角小于120°。SO3分子中S原子的孤电子对数为0,价层电子对数为3,S原子采取sp2杂化,SO3的空间结构为平面三角形。(2)N中N的杂化轨道数为3,N原子含有1个孤电子对,采取sp2杂化,故N的空间结构为V形。(3)S中S原子的杂化轨道数为4,S原子采取sp3杂化,S的空间结构为正四面体形。S中S原子杂化轨道数为4,采取sp3杂化,S原子含有1个孤电子对,S的空间结构为三角锥形。
能力提升练
1.C 2.D 3.A 4.B 5.C 6.B 7.C 8.D
9.B 10.D 11.A
1.C 中心原子采取sp3杂化的分子,VSEPR模型是四面体形,但其空间结构不一定是四面体形,如:水和氨分子中中心原子均采取sp3杂化,但H2O是V形分子,NH3是三角锥形分子,故A错误;CH4中sp3杂化轨道是由中心碳原子的能量相近的2s轨道和3个2p轨道杂化形成的,故B错误;同一个原子中能量相近的s轨道和p轨道混杂可形成一组能量相同的新轨道,故C正确;BF3中B原子的价层电子对数为3,杂化轨道类型为sp2,故D错误。
2.D Cl—Be—Cl中Be原子形成2个Be—Cl键,中心原子没有孤电子对,杂化轨道数目为2,杂化轨道类型为sp;中每个Be原子形成3个Be—Cl键,中心原子没有孤电子对,杂化轨道数目为3,杂化轨道类型为sp2;中每个Be原子形成4个Be—Cl键,中心原子没有孤电子对,杂化轨道数目为4,杂化轨道类型为sp3。
3.A 氯化铍分子中铍原子的价层电子对数为2、孤电子对数为0,铍原子的杂化方式为sp,分子的空间结构为直线形,二氧化碳分子中碳原子的价层电子对数为2、孤电子对数为0,碳原子的杂化方式为sp,分子的空间结构为直线形,则两者中心原子的杂化轨道类型相同,空间结构也相同,A符合题意;水分子中氧原子的价层电子对数为4、孤电子对数为2,分子的空间结构为V形,氨分子中氮原子的价层电子对数为4、孤电子对数为1,分子的空间结构为三角锥形,两者的空间结构不同,B不符合题意;氨分子中氮原子的杂化方式为sp3,甲醛分子中碳原子的杂化方式为sp2,两者中心原子的杂化方式不同,C不符合题意;水分子中氧原子的杂化方式为sp3,二氧化硫分子中硫原子的杂化方式为sp2,两者中心原子的杂化方式不同,D不符合题意。
4.B 一个二氧化碳分子中含有2个σ键且中心原子不含孤电子对,所以碳原子采取sp杂化而不是sp2杂化,A错误;NH3、NCl3中N原子都采取sp3杂化,有1个孤电子对,所以分子的空间结构都是三角锥形,B正确;S的电负性比O小,而且原子半径大,所以S—H键上的电子对偏向S并没有H2O中O—H键上的电子对偏向O那么严重,所以排斥力也相应比较小,键角也稍小,C错误;BF3分子中B元素化合价为+3价,B原子最外层未达到8电子稳定结构,D错误。
5.C 解法1:理论分析法
则A、B项错误,C项正确。若X原子采用sp2杂化,则VSEPR模型是平面三角形;若X原子采用sp3杂化,则VSEPR模型为四面体形,D项错误。
解法2:列举实例法
若XY2为SO2,SO2中S原子采用sp2杂化,S原子上有1个孤电子对,其VSEPR模型为平面三角形,空间结构为V形;若XY2为OF2,OF2中O原子采用sp3杂化,O原子上有2个孤电子对,其VSEPR模型为四面体形,空间结构为V形。由以上分析可知,C项正确。
6.B BF3和B的中心原子杂化方式不同,前者形成3个σ键,没有孤电子对,是sp2杂化,后者形成4个σ键,没有孤电子对,是sp3杂化,故A正确;C和Cl具有不同的空间结构,前者形成3个σ键,中心原子没有孤电子对,是平面三角形,后者形成3个σ键,中心原子有一个孤电子对,是三角锥形,故B错误;BBr3和SF6的中心原子均不满足8电子结构,前者形成3个σ键,没有孤电子对,是6电子结构,后者形成6个σ键,中心原子没有孤电子对,是12电子结构,故C正确;三氧化硫的三聚分子()中S原子均形成4个σ键,没有孤电子对,杂化轨道类型为sp3,故D正确。
7.C N、NH3、N都是10e-微粒,中心原子都是sp3杂化,A、B正确;N不含孤电子对,NH3中含1个孤电子对,N中含2个孤电子对,故N为正四面体形,NH3为三角锥形,N为V形,C错误;微粒的中心原子含有孤电子对数越多,分子中的键角越小,故键角大小关系:N,D正确。
8.D 因氨分子空间结构为三角锥形,即氮原子与所连的三个原子不在同一平面,所以A分子中所有原子不可能共平面,A错误;1个A分子中含有11个σ键和1个π键,σ键与π键个数之比为11∶1,B错误;A分子中N为sp3杂化,C错误;1 mol A与足量O2反应生成CO2、N2、H2O的物质的量分别为1 mol、2 mol、3 mol,D正确。
9.B 乙炔分子中的C原子采用sp杂化,形成的杂化轨道用于形成σ键,没有杂化的p轨道“肩并肩”重叠形成π键,A项错误;氯乙烯分子中的C原子采用sp2杂化,整个分子呈平面形,所有原子都在同一平面上,B项正确;聚氯乙烯分子中的C原子全部形成单键,均采取sp3杂化,C项错误;由流程可知,加成反应和加聚反应中,均有π键的断裂,C原子的杂化方式也随之发生改变,D项错误。
10.D CH3OH的结构式为,1 mol CH3OH中含5 mol σ键,A正确;N2H4中两个N都是sp3杂化,分子中所有原子不可能处于同一平面,B正确;CH3OH中羟基氧上有2个孤电子对,N2H4有两个孤电子对,2个N上分别有1个,(CH3)2NNH2中有两个孤电子对,2个N上分别有1个,C正确;三者中C、O、N杂化方式相同,均为sp3杂化,D错误。
11.A C3H8中碳原子均为饱和碳原子,碳原子为sp3杂化,1个H2O分子中含有2个σ键,氧原子上有2个孤电子对,氧原子为sp3杂化,A正确;氧的电负性大于S,O与H之间的两对成键电子对比S与H之间的两对成键电子对更靠近中心原子,因此O与H之间的两对成键电子对排斥力大,键角大,B错误;SO2的价层电子对数=2+(6-2×2)=3,该分子为V形结构,CO2的价层电子对数=2+(4-2×2)=2,该分子是直线形结构,C错误;反应过程中有非极性键OO键的断裂和键的形成,D错误。
12.答案 (1)三角锥形 sp3
(2)sp3、sp2
(3)sp3 1∶3 [SiO3
解析 (1)AsCl3的中心原子(As原子)的价层电子对数为3+×(5-1×3)=4,所以As是sp3杂化,有1个孤电子对,AsCl3分子的空间结构为三角锥形。(2)乙醛分子结构简式为CH3CHO,甲基C原子为sp3杂化,醛基C原子为sp2杂化。(3)依据图(a)可知,Si的空间结构类似于甲烷分子,为正四面体形,硅原子的杂化轨道类型和甲烷分子中碳原子的杂化轨道类型相同,为sp3;图(b)是一种无限长单链结构的多硅酸根离子,每个结构单元中两个氧原子被两个结构单元顶角共用,所以每个结构单元含有1个Si原子、3个O原子,Si原子和O原子数之比为1∶3,化学式可表示为[SiO3。
13.答案 (1)①④②③
(2)V形 三角锥形 正四面体形
(3)sp3
解析 (1)①HCN中的C原子采取sp杂化,键角为180°;②SiF4中Si原子杂化轨道数为4,采取sp3杂化,键角为109°28';③H2O中O原子杂化轨道数为4,采取sp3杂化,含有2个孤电子对,分子为V形结构,键角为105°;④C中C原子的杂化轨道数为3,C原子采取sp2杂化,分子为平面三角形结构,键角为120°。所以各粒子按键角由大到小的顺序排列为①④②③。(2)Cl、Cl、Cl中Cl采取sp3杂化,孤电子对数分别为2、1、0,所以空间结构分别为V形、三角锥形、正四面体形。(3)由题图结构可知,每个硫原子形成2个共价键,且含有2个孤电子对,S原子的杂化轨道数为4,故硫原子采取sp3杂化。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版高中化学选择性必修2同步
第二章 分子结构与性质
第二节 分子的空间结构
第2课时 杂化轨道理论
基础过关练
题组一 杂化轨道理论
1.(原创题)下列说法中,错误的是( )
A.H原子成键时不可能有杂化轨道
B.2s轨道与3p轨道能形成杂化轨道
C.s轨道和p轨道杂化不可能有sp4杂化轨道出现
D.杂化轨道理论是一种价键理论,是为了解释分子的空间结构提出的
2.(2023江西新余一中期末)关于H2O2、CO2、BF3、CH3COOH的下列说法正确的是( )
A.H2O2分子中的O为sp2杂化
B.CO2分子中的C原子为sp杂化
C.BF3分子中的B原子为sp3杂化
D.CH3COOH分子中的C原子均为sp2杂化
3.(2023吉林长春五中期末)下列有机物分子中的碳原子既有sp3杂化又有sp杂化的是( )
A.CH3CH CH2 B.
C.CH3CH2OH D.
4.(2023湖北武汉六中月考)乙烯分子结构如图所示,其一个分子中有5个σ键、1个π键,下列表述正确的是( )
A.C原子的sp2杂化轨道与H原子的1s轨道形成σ键
B.C原子的sp2杂化轨道与H原子的1s轨道形成π键
C.C原子的2p轨道与C原子的2p轨道形成σ键
D.C原子的sp2杂化轨道与C原子的sp2杂化轨道形成π键
5.下列叙述中,不正确的是( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道用于形成σ键或用于容纳未参与成键的孤电子对
C.NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键
D.用杂化轨道理论与VSEPR模型分析分子空间结构的结果常常相互矛盾
题组二 杂化轨道理论与分子空间结构的关系
6.(2022浙江诸暨中学期中)下列说法中正确的是 ( )
A.PCl3分子是三角锥形,这是因为P原子采取sp2杂化
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混杂形成的
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形
D.AB3型分子的空间结构必为平面三角形
7.(1)在SO2分子中,S原子采取 杂化,SO2的键角 (填“大于”“等于”或“小于”)120°,SO3分子中S原子采取 杂化,SO3分子的空间结构为 。
(2)N的空间结构是 ,N原子采取 杂化。
(3)S、S的空间结构分别为 、 ,S原子的杂化轨道类型分别为 、 。
能力提升练
题组 杂化轨道理论的理解及应用
1.下列关于原子轨道的说法正确的是( )
A.中心原子采取sp3杂化的分子,其空间结构都是四面体形
B.CH4中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混杂而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混杂形成的一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采取sp3杂化
2.(2023福建龙岩一中月考)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在,三者的结构依次如图所示。其单体、二聚体和多聚体中Be的杂化轨道类型依次为( )
Cl—Be—Cl、、
A.sp3、sp2、sp B.sp2、sp、sp3
C.sp2、sp3、sp D.sp、sp2、sp3
3.(2023吉林田家炳中学期末)下列分子中,中心原子的杂化类型相同,分子空间结构也相同的是( )
A.BeCl2、CO2 B.H2O、NH3
C.NH3、HCHO D.H2O、SO2
4.推理是学习化学知识的一种重要方法。下列推理合理的是( )
A.SO2中硫原子采取sp2杂化,则CO2中碳原子也采取sp2杂化
B.NH3分子的空间结构是三角锥形,则NCl3分子的空间结构也是三角锥形
C.H2O分子的键角是105°,则H2S分子的键角也是105°
D.PCl3分子中所有原子最外层都达到8电子稳定结构,则BF3分子中所有原子最外层也都达到8电子稳定结构
5.(经典题)已知XY2为V形分子,下列说法正确的是( )
A.X原子一定采取sp2杂化
B.X原子一定采取sp3杂化
C.X原子上一定存在孤电子对
D.VSEPR模型一定是平面三角形
6.(2023重庆八中月考)下列描述中错误的是( )
A.BF3和B的中心原子杂化方式不同
B.C和Cl具有相同的空间结构
C.BBr3和SF6的中心原子均不满足8电子结构
D.三氧化硫的三聚分子()中S原子的杂化轨道类型为sp3
7.(2023辽宁部分重点中学期末联考)下列关于N、NH3、N三种微粒的说法不正确的是( )
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同
D.键角大小关系:N>NH3>N
8.化合物A是近年来采用的锅炉水添加剂,其结构式如图所示,A能除去锅炉水中溶解的氧气。下列说法正确的是( )
A.A分子中所有原子都在同一平面内
B.A分子中所含的σ键与π键个数之比为10∶1
C.A分子中C、N均为sp2杂化
D.A与足量O2反应生成CO2、N2、H2O的物质的量之比为1∶2∶3
9.(原创题)聚氯乙烯的一种制备流程如下:
对于该流程中涉及的几种物质及反应,下列说法正确的是( )
A.乙炔分子中的C原子用sp杂化轨道形成了一个σ键和两个π键
B.氯乙烯分子中所有原子都在同一平面上
C.氯乙烯和聚氯乙烯分子中C原子采取的杂化方式相同
D.上述流程中发生加成反应和加聚反应的过程中,C原子的杂化方式不一定发生改变
10.(2023山东济南学情检测)关于CH3OH、N2H4和(CH3)2NNH2,下列说法错误的是( )
A.1 mol CH3OH中含5 mol σ键
B.N2H4分子中所有原子不可能处于同一平面
C.三者孤电子对数相同
D.三者中C、O、N杂化方式不相同
11.(2022山东聊城期末)目前我国研制的稀土催化剂转化汽车尾气过程示意图如下,汽车尾气的主要成分有CO、NO等。下列有关说法正确的是( )
A.C3H8和H2O的中心原子杂化轨道类型均为sp3
B.H2O中的H—O—H键角小于H2S中的H—S—H键角
C.CO2和SO2的空间结构均为直线形
D.反应过程中没有非极性键的断裂和形成
12.(1)AsCl3分子的空间结构为 ,其中As的杂化轨道类型为 。
(2)乙醛中碳原子的杂化轨道类型为 。
(3)在硅酸盐中,Si四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构形式。图(b)为一种无限长单链结构的多硅酸根离子,其中Si原子的杂化轨道类型为 ,Si与O的原子数之比为 ,化学式为 。
图(a)
图(b)
13.回答下列问题:
(1)下列粒子按键角由大到小的顺序排列为 (填序号)。
①HCN ②SiF4 ③H2O ④C
(2)Cl、Cl、Cl中Cl都是以sp3杂化轨道与O原子成键,将它们的空间结构填入表格中:
离子 Cl Cl Cl
空间结构
(3)S单质的常见形式为S8,其结构如图所示,S原子采取的杂化方式是 。
答案与分层梯度式解析
第二章 分子结构与性质
第二节 分子的空间结构
第2课时 杂化轨道理论
基础过关练
1.B 2.B 3.B 4.A 5.D 6.C
1.B H原子只有一个电子,在1s能级上,不可能杂化,A项正确;只有能量相近的轨道才能杂化,B项错误;p能级只有3个p轨道,s轨道和p轨道杂化不可能有sp4杂化轨道,C项正确。
2.B H2O2分子中O为sp3杂化,A错误;CO2分子中C原子为sp杂化,B正确;BF3分子中B原子为sp2杂化,C错误;CH3COOH分子羧基中的C原子是sp2杂化,甲基中的碳原子是sp3杂化,D错误。
3.B CH3CH CH2中碳原子为sp2杂化和sp3杂化,A不符合题意;中碳原子为sp3杂化和sp杂化,B符合题意;CH3CH2OH中碳原子为sp3杂化,C不符合题意;中碳原子为sp杂化,D不符合题意。
4.A C—H键是C原子的sp2杂化轨道与H原子的1s轨道形成的σ键,故A正确;C C键中一个C原子的2p轨道与另一个C原子的2p轨道形成π键,故B、D错误;C C键中C原子的sp2杂化轨道与另一个C原子的sp2杂化轨道形成σ键,故C错误。
归纳总结 杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对,不能用于形成π键;未参与杂化的p轨道可用于形成π键。
5.D 中心原子通过sp3杂化轨道成键的分子可能是正四面体形(如CH4)、三角锥形(如NH3)或者V形(如H2O),A正确;杂化轨道用于形成σ键或用于容纳孤电子对,B正确;正四面体形的CH4和三角锥形的NH3中,中心原子C和N都是通过sp3杂化轨道成键,C正确;杂化轨道理论和VSEPR模型都是为了解释分子的空间结构而提出的,两者不矛盾,可以通过VSEPR模型确定中心原子的杂化轨道类型,D错误。
特别提醒 (1)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化的原子轨道数目相等。
(2)杂化过程中,轨道的形状发生变化,杂化轨道的形状相同,能量相同,方向不同。
6.C PCl3分子的中心原子P含有3个成键电子对和1个孤电子对,属于sp3杂化,含有1个孤电子对,所以空间结构为三角锥形,A错误;能量相近的s轨道和p轨道形成杂化轨道,则sp3杂化轨道是能量相近的1个s轨道和3个p轨道混杂形成的,B错误;中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形,C正确;AB3型分子的空间结构与中心原子的孤电子对数有关,如BF3中B原子没有孤电子对,为平面三角形,NH3中N原子有1个孤电子对,为三角锥形,D错误。
7.答案 (1)sp2 小于 sp2 平面三角形
(2)V形 sp2
(3)正四面体形 三角锥形 sp3 sp3
解析 (1)SO2分子中,S原子的孤电子对数=(6-2×2)=1,价层电子对数=2+1=3,S原子采取sp2杂化,因有1个孤电子对,所以键角小于120°。SO3分子中S原子的孤电子对数为0,价层电子对数为3,S原子采取sp2杂化,SO3的空间结构为平面三角形。(2)N中N的杂化轨道数为3,N原子含有1个孤电子对,采取sp2杂化,故N的空间结构为V形。(3)S中S原子的杂化轨道数为4,S原子采取sp3杂化,S的空间结构为正四面体形。S中S原子杂化轨道数为4,采取sp3杂化,S原子含有1个孤电子对,S的空间结构为三角锥形。
能力提升练
1.C 2.D 3.A 4.B 5.C 6.B 7.C 8.D
9.B 10.D 11.A
1.C 中心原子采取sp3杂化的分子,VSEPR模型是四面体形,但其空间结构不一定是四面体形,如:水和氨分子中中心原子均采取sp3杂化,但H2O是V形分子,NH3是三角锥形分子,故A错误;CH4中sp3杂化轨道是由中心碳原子的能量相近的2s轨道和3个2p轨道杂化形成的,故B错误;同一个原子中能量相近的s轨道和p轨道混杂可形成一组能量相同的新轨道,故C正确;BF3中B原子的价层电子对数为3,杂化轨道类型为sp2,故D错误。
2.D Cl—Be—Cl中Be原子形成2个Be—Cl键,中心原子没有孤电子对,杂化轨道数目为2,杂化轨道类型为sp;中每个Be原子形成3个Be—Cl键,中心原子没有孤电子对,杂化轨道数目为3,杂化轨道类型为sp2;中每个Be原子形成4个Be—Cl键,中心原子没有孤电子对,杂化轨道数目为4,杂化轨道类型为sp3。
3.A 氯化铍分子中铍原子的价层电子对数为2、孤电子对数为0,铍原子的杂化方式为sp,分子的空间结构为直线形,二氧化碳分子中碳原子的价层电子对数为2、孤电子对数为0,碳原子的杂化方式为sp,分子的空间结构为直线形,则两者中心原子的杂化轨道类型相同,空间结构也相同,A符合题意;水分子中氧原子的价层电子对数为4、孤电子对数为2,分子的空间结构为V形,氨分子中氮原子的价层电子对数为4、孤电子对数为1,分子的空间结构为三角锥形,两者的空间结构不同,B不符合题意;氨分子中氮原子的杂化方式为sp3,甲醛分子中碳原子的杂化方式为sp2,两者中心原子的杂化方式不同,C不符合题意;水分子中氧原子的杂化方式为sp3,二氧化硫分子中硫原子的杂化方式为sp2,两者中心原子的杂化方式不同,D不符合题意。
4.B 一个二氧化碳分子中含有2个σ键且中心原子不含孤电子对,所以碳原子采取sp杂化而不是sp2杂化,A错误;NH3、NCl3中N原子都采取sp3杂化,有1个孤电子对,所以分子的空间结构都是三角锥形,B正确;S的电负性比O小,而且原子半径大,所以S—H键上的电子对偏向S并没有H2O中O—H键上的电子对偏向O那么严重,所以排斥力也相应比较小,键角也稍小,C错误;BF3分子中B元素化合价为+3价,B原子最外层未达到8电子稳定结构,D错误。
5.C 解法1:理论分析法
则A、B项错误,C项正确。若X原子采用sp2杂化,则VSEPR模型是平面三角形;若X原子采用sp3杂化,则VSEPR模型为四面体形,D项错误。
解法2:列举实例法
若XY2为SO2,SO2中S原子采用sp2杂化,S原子上有1个孤电子对,其VSEPR模型为平面三角形,空间结构为V形;若XY2为OF2,OF2中O原子采用sp3杂化,O原子上有2个孤电子对,其VSEPR模型为四面体形,空间结构为V形。由以上分析可知,C项正确。
6.B BF3和B的中心原子杂化方式不同,前者形成3个σ键,没有孤电子对,是sp2杂化,后者形成4个σ键,没有孤电子对,是sp3杂化,故A正确;C和Cl具有不同的空间结构,前者形成3个σ键,中心原子没有孤电子对,是平面三角形,后者形成3个σ键,中心原子有一个孤电子对,是三角锥形,故B错误;BBr3和SF6的中心原子均不满足8电子结构,前者形成3个σ键,没有孤电子对,是6电子结构,后者形成6个σ键,中心原子没有孤电子对,是12电子结构,故C正确;三氧化硫的三聚分子()中S原子均形成4个σ键,没有孤电子对,杂化轨道类型为sp3,故D正确。
7.C N、NH3、N都是10e-微粒,中心原子都是sp3杂化,A、B正确;N不含孤电子对,NH3中含1个孤电子对,N中含2个孤电子对,故N为正四面体形,NH3为三角锥形,N为V形,C错误;微粒的中心原子含有孤电子对数越多,分子中的键角越小,故键角大小关系:N,D正确。
8.D 因氨分子空间结构为三角锥形,即氮原子与所连的三个原子不在同一平面,所以A分子中所有原子不可能共平面,A错误;1个A分子中含有11个σ键和1个π键,σ键与π键个数之比为11∶1,B错误;A分子中N为sp3杂化,C错误;1 mol A与足量O2反应生成CO2、N2、H2O的物质的量分别为1 mol、2 mol、3 mol,D正确。
9.B 乙炔分子中的C原子采用sp杂化,形成的杂化轨道用于形成σ键,没有杂化的p轨道“肩并肩”重叠形成π键,A项错误;氯乙烯分子中的C原子采用sp2杂化,整个分子呈平面形,所有原子都在同一平面上,B项正确;聚氯乙烯分子中的C原子全部形成单键,均采取sp3杂化,C项错误;由流程可知,加成反应和加聚反应中,均有π键的断裂,C原子的杂化方式也随之发生改变,D项错误。
10.D CH3OH的结构式为,1 mol CH3OH中含5 mol σ键,A正确;N2H4中两个N都是sp3杂化,分子中所有原子不可能处于同一平面,B正确;CH3OH中羟基氧上有2个孤电子对,N2H4有两个孤电子对,2个N上分别有1个,(CH3)2NNH2中有两个孤电子对,2个N上分别有1个,C正确;三者中C、O、N杂化方式相同,均为sp3杂化,D错误。
11.A C3H8中碳原子均为饱和碳原子,碳原子为sp3杂化,1个H2O分子中含有2个σ键,氧原子上有2个孤电子对,氧原子为sp3杂化,A正确;氧的电负性大于S,O与H之间的两对成键电子对比S与H之间的两对成键电子对更靠近中心原子,因此O与H之间的两对成键电子对排斥力大,键角大,B错误;SO2的价层电子对数=2+(6-2×2)=3,该分子为V形结构,CO2的价层电子对数=2+(4-2×2)=2,该分子是直线形结构,C错误;反应过程中有非极性键OO键的断裂和键的形成,D错误。
12.答案 (1)三角锥形 sp3
(2)sp3、sp2
(3)sp3 1∶3 [SiO3
解析 (1)AsCl3的中心原子(As原子)的价层电子对数为3+×(5-1×3)=4,所以As是sp3杂化,有1个孤电子对,AsCl3分子的空间结构为三角锥形。(2)乙醛分子结构简式为CH3CHO,甲基C原子为sp3杂化,醛基C原子为sp2杂化。(3)依据图(a)可知,Si的空间结构类似于甲烷分子,为正四面体形,硅原子的杂化轨道类型和甲烷分子中碳原子的杂化轨道类型相同,为sp3;图(b)是一种无限长单链结构的多硅酸根离子,每个结构单元中两个氧原子被两个结构单元顶角共用,所以每个结构单元含有1个Si原子、3个O原子,Si原子和O原子数之比为1∶3,化学式可表示为[SiO3。
13.答案 (1)①④②③
(2)V形 三角锥形 正四面体形
(3)sp3
解析 (1)①HCN中的C原子采取sp杂化,键角为180°;②SiF4中Si原子杂化轨道数为4,采取sp3杂化,键角为109°28';③H2O中O原子杂化轨道数为4,采取sp3杂化,含有2个孤电子对,分子为V形结构,键角为105°;④C中C原子的杂化轨道数为3,C原子采取sp2杂化,分子为平面三角形结构,键角为120°。所以各粒子按键角由大到小的顺序排列为①④②③。(2)Cl、Cl、Cl中Cl采取sp3杂化,孤电子对数分别为2、1、0,所以空间结构分别为V形、三角锥形、正四面体形。(3)由题图结构可知,每个硫原子形成2个共价键,且含有2个孤电子对,S原子的杂化轨道数为4,故硫原子采取sp3杂化。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
