2024人教版高中化学选择性必修3同步练习题--第2课时 炔烃(含解析)
文档属性
| 名称 | 2024人教版高中化学选择性必修3同步练习题--第2课时 炔烃(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 09:16:23 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024人教版高中化学选择性必修3同步
第2课时 炔烃
基础过关练
题组一 炔烃的结构与性质
1.下列说法中正确的是( )
A.炔烃分子中所有的碳原子都在同一条直线上
B.分子组成符合CnH2n-2的链烃,一定是炔烃
C.炔烃易溶于水
D.炔烃既可使溴水褪色,又可使酸性KMnO4溶液褪色
2.下列关于乙炔的说法错误的是( )
A.乙炔的键角为180°,是非极性分子
B.分子中碳原子的sp杂化轨道形成σ键,未参与杂化的2p轨道形成两个π键,且两个π键互相垂直
C.碳碳三键中三条键能量大小相同,其键长是碳碳单键的
D.乙炔分子中既有极性键也有非极性键
3.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.完全燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能被酸性高锰酸钾溶液氧化
D.能与氯化氢反应生成氯乙烯
4.(经典题)下列各选项的叙述中,能说明分子式为C4H6的烃是,而不是CH2CH—CHCH2的是( )
A.燃烧时有黑烟
B.能使酸性KMnO4溶液褪色
C.分子中所有原子都在同一平面上
D.与足量溴水反应,生成物分子中只有2个碳原子上有溴原子
5.以乙炔为原料制取CH2BrCHBrCl,可行的反应途径是( )
A.先与Cl2加成,再与Br2加成
B.先与Cl2加成,再与HBr加成
C.先与HCl加成,再与HBr加成
D.先与HCl加成,再与Br2加成
6.(2023安徽师大附中期末)0.5 mol某气态烃能与1 mol HCl完全加成,加成后产物分子中的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A. B.CH2CH2
C. D.CH2C(CH3)2
7.某烃的结构简式为,下列说法不正确的是( )
A.1 mol该烃完全燃烧消耗11 mol O2
B.与氢气完全加成后的产物分子中含2个甲基
C.1 mol该烃与Br2完全加成,消耗Br2的物质的量为3 mol
D.该烃的核磁共振氢谱图中有6组吸收峰
8.(2022江苏连云港期中)某链状单炔烃与足量的氢气加成,生成如图所示的烷烃,则符合条件的炔烃共有(不考虑立体异构)( )
A.6种 B.4种
C.3种 D.2种
(2022云南玉溪一中月考)已知1 mol某烃A完全燃烧可得到
3 mol CO2;在一定条件下,1 mol该烃能与2 mol HCl完全加成生成化合物B。下列说法正确的是( )
A.1 mol化合物B中的氢原子可被6 mol Cl2完全取代
B.实验室制取烃A的化学方程式为CaC2+2H2O Ca(OH)2+C2H2↑
C.化合物B可发生加聚反应
D.烃A为2-甲基丙烯
题组二 炔烃的命名
10.(经典题)有机物的命名为( )
A.3-甲基-4-己炔
B.4-乙基-2-戊炔
C.4-甲基-2-己炔
D.2-乙基-3-戊炔
11.某炔烃经催化加氢后可得到2-甲基丁烷,则该炔烃的名称是( )
A.2-甲基-1-丁炔
B.2-甲基-3-丁炔
C.3-甲基-1-丁炔
D.3-甲基-2-丁炔
题组三 乙炔的实验室制法
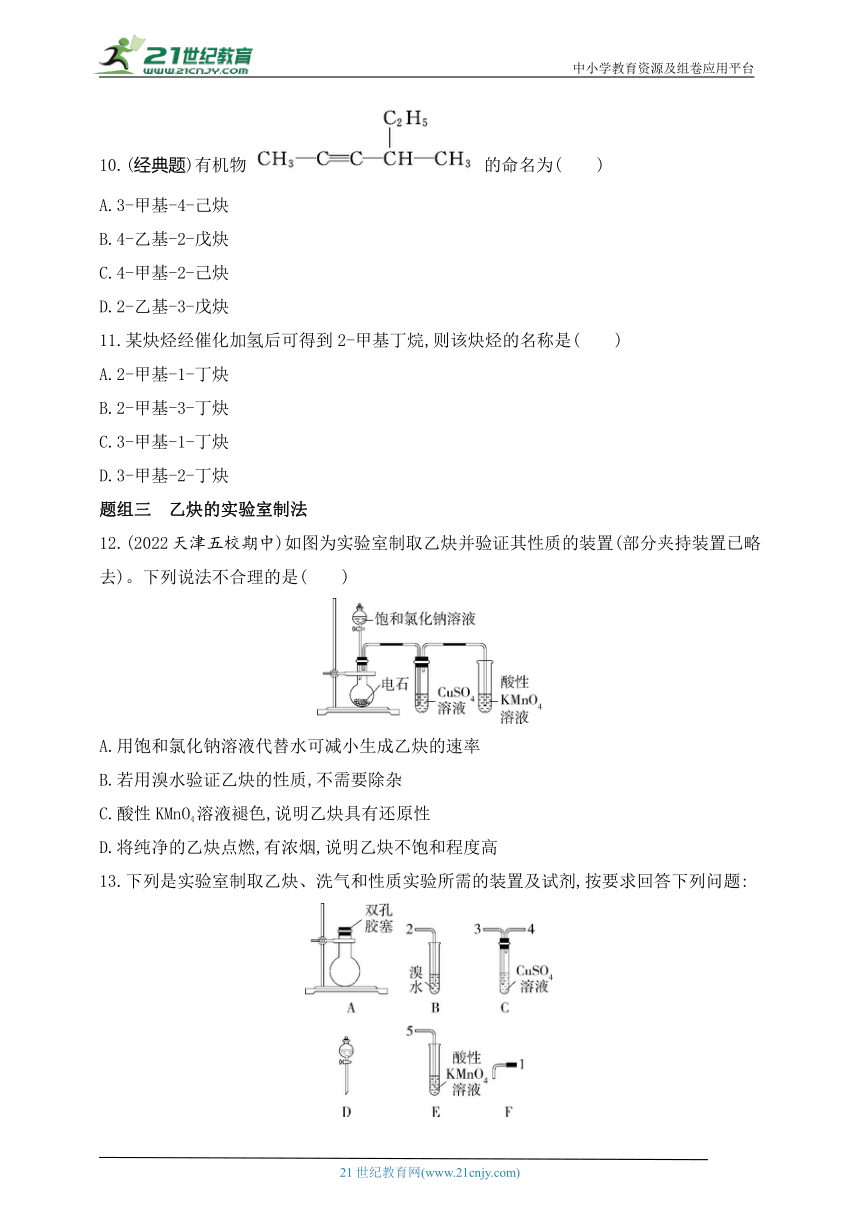
12.(2022天津五校期中)如图为实验室制取乙炔并验证其性质的装置(部分夹持装置已略去)。下列说法不合理的是( )
A.用饱和氯化钠溶液代替水可减小生成乙炔的速率
B.若用溴水验证乙炔的性质,不需要除杂
C.酸性KMnO4溶液褪色,说明乙炔具有还原性
D.将纯净的乙炔点燃,有浓烟,说明乙炔不饱和程度高
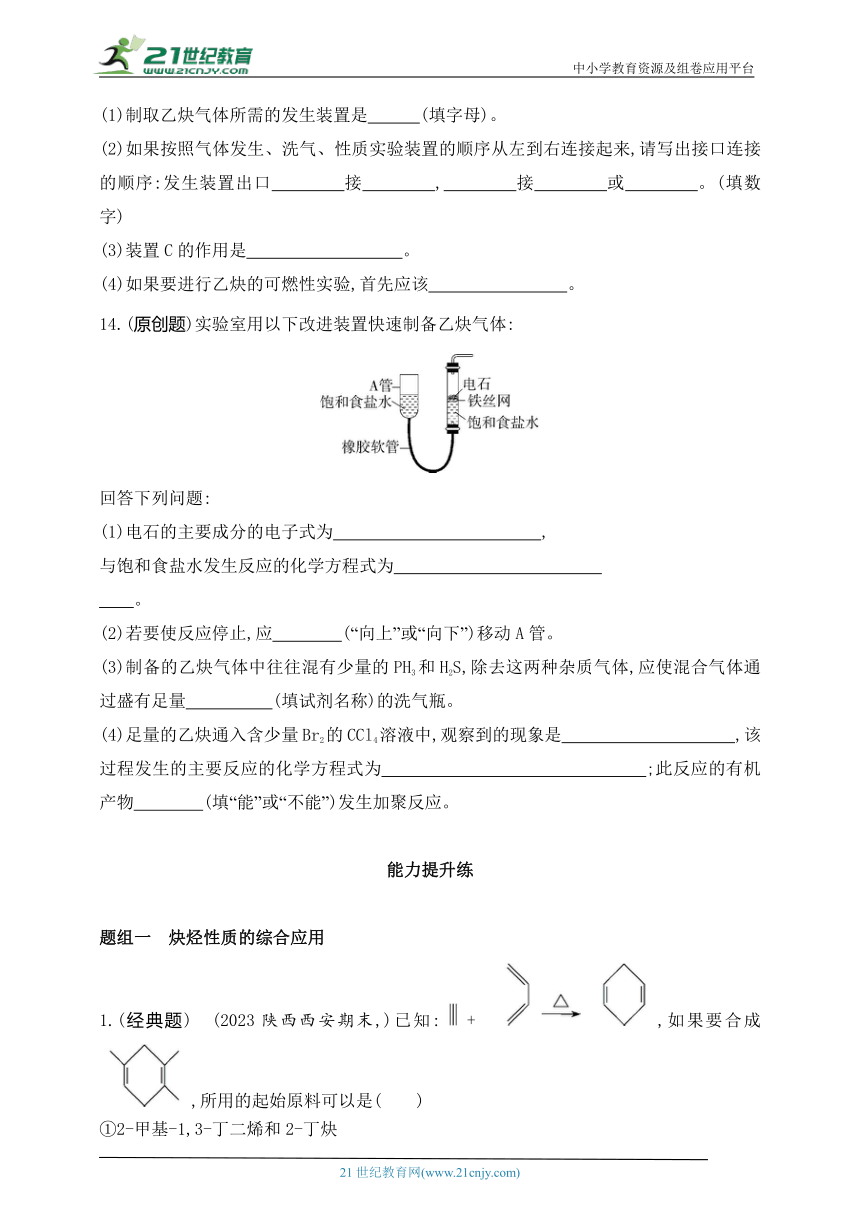
13.下列是实验室制取乙炔、洗气和性质实验所需的装置及试剂,按要求回答下列问题:
(1)制取乙炔气体所需的发生装置是 (填字母)。
(2)如果按照气体发生、洗气、性质实验装置的顺序从左到右连接起来,请写出接口连接的顺序:发生装置出口 接 , 接 或 。(填数字)
(3)装置C的作用是 。
(4)如果要进行乙炔的可燃性实验,首先应该 。
14.(原创题)实验室用以下改进装置快速制备乙炔气体:
回答下列问题:
(1)电石的主要成分的电子式为 ,
与饱和食盐水发生反应的化学方程式为
。
(2)若要使反应停止,应 (“向上”或“向下”)移动A管。
(3)制备的乙炔气体中往往混有少量的PH3和H2S,除去这两种杂质气体,应使混合气体通过盛有足量 (填试剂名称)的洗气瓶。
(4)足量的乙炔通入含少量Br2的CCl4溶液中,观察到的现象是 ,该过程发生的主要反应的化学方程式为 ;此反应的有机产物 (填“能”或“不能”)发生加聚反应。
能力提升练
题组一 炔烃性质的综合应用
1.(经典题) (2023陕西西安期末,)已知:+ ,如果要合成,所用的起始原料可以是( )
①2-甲基-1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔
④2,3-二甲基-1,3-丁二烯和丙炔
A.①④ B.②③ C.①③ D.②④
2.(2022山东聊城月考)请回答下列问题:
Ⅰ.乙烯基乙炔()在工业上主要用于制备合成橡胶的原料2-氯-1,3-丁二烯(结构简式为)。
(1)乙烯基乙炔中的官能团是 (写名称)。
(2)乙烯基乙炔生成2-氯-1,3-丁二烯的反应类型是 ,反应物除乙烯基乙炔外,还有 (写化学式)。
(3)1 mol乙烯基乙炔与氢气完全加成需要消耗氢气 mol,该反应的生成物的结构简式为 ,与该物质互为同分异构体的烷烃的系统命名为 。
Ⅱ.(4)请写出分子式为C5H8的属于炔烃的所有有机物的结构简式并命名: 。
(5)某炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该炔烃可能的结构简式为 。
题组二 乙炔的制备与性质实验综合考查
3.查文献知,Cu2C2(乙炔亚铜)呈红褐色,难溶于水。实验室制备原理:向亚铜氨盐溶液中通入乙炔。某小组设计如图实验制备乙炔亚铜。
下列说法错误的是( )
A.用饱和食盐水替代水的目的是减小反应速率
B.甲装置中烧瓶可以用启普发生器替代
C.乙装置的作用是除去乙炔中H2S等杂质
D.丙装置中发生反应过程中没有电子的转移
4.(2023广东汕尾月考,)乙炔是一种无色、无臭的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。回答下列问题:
利用电石制备乙炔的化学方程式为
。
用饱和食盐水代替蒸馏水的目的是
。
装置A的作用是 ,装置B中的现象是
。
(4)装置C中发生反应的类型是 ,完全反应的化学方程式为 。
(5)若称取a g电石,反应完全后,将生成的乙炔全部通入足量溴的四氯化碳溶液中,溶液增重b g,则电石的纯度为 (用含有a、b的式子表示)。
答案与分层梯度式解析
第2课时 炔烃
基础过关练
1.D 2.C 3.D 4.D 5.D 6.C 7.B 8.D
9.A 10.C 11.C 12.B
1.D 炔烃分子中的碳原子不一定都在同一直线上,如中甲基的碳原子与其他3个碳原子不在同一直线上,A错误;分子组成符合CnH2n-2的链烃可能是二烯烃,B错误;炔烃难溶于水,C错误;炔烃既可与溴单质发生加成反应而使溴水褪色,也可与酸性KMnO4溶液发生氧化反应而使酸性KMnO4溶液褪色,D正确。
2.C 乙炔为直线形分子,键角为180°,属于非极性分子,故A正确;乙炔分子中的碳原子均采取sp杂化,每个碳原子的一个2s轨道和一个2p轨道杂化形成两个sp杂化轨道,其中一个sp杂化轨道与氢原子的1s轨道“头碰头”重叠形成C—H σ键,另一个sp杂化轨道则与另一个碳原子的sp杂化轨道“头碰头”重叠形成C—C σ键,两个碳原子未参与杂化的2p轨道则“肩并肩”重叠形成两个π键,且这两个π键相互垂直,故B正确;碳碳三键的三条键能量大小不同,键长大于碳碳单键的,故C错误;乙炔中C—H键为极性共价键,碳碳三键为非极性共价键,故D正确。
3.D 乙烯、乙烷、乙炔完全燃烧都生成CO2和H2O,A项不符合题意;乙烯、乙炔都能与溴水发生加成反应、都能被酸性KMnO4溶液氧化,B、C项不符合题意;乙烯与HCl在一定条件下反应生成氯乙烷,乙炔在一定条件下能与HCl反应生成氯乙烯,乙烷与HCl不反应,D项符合题意。
4.D 1-丁炔和1,3-丁二烯分子中含碳量相同,燃烧都产生黑烟,故A错误;1-丁炔含碳碳三键,1,3-丁二烯含碳碳双键,均能使酸性KMnO4溶液褪色,故B错误;1,3-丁二烯分子中所有原子都在同一平面上,但1-丁炔分子中所有原子不在同一平面上,故C错误;与足量溴水反应,生成物分子中只有2个碳原子上有溴原子,说明该烃是1-丁炔,若是1,3-丁二烯,则生成物分子中会有4个碳原子上有溴原子,故D正确。
5.D 由乙炔()制CH2BrCHBrCl,CH2BrCHBrCl分子组成比乙炔分子多一个H、两个Br、一个Cl,据此分析可知需要由乙炔与HCl和Br2(或Br2和HCl)先后发生加成反应制得,选项A、B、C不符合题意,选D。
6.C 0.5 mol该烃能与1 mol HCl完全加成,说明烃分子中含有1个碳碳三键或2个碳碳双键;加成后产物分子中的氢原子又可被
3 mol Cl2完全取代,说明0.5 mol该烃与1 mol HCl完全加成后的产物分子中含有3 mol H原子,则0.5 mol该烃中含有2 mol H原子,即1 mol该烃中含有4 mol H原子,选项中符合要求的只有。
7.B 由该烃的结构简式可知分子式为C8H12,则1 mol该烃完全燃烧消耗O2的物质的量为(8+)mol=11 mol,故A正确;碳碳双键、碳碳三键均能与氢气发生加成反应,则该烃与H2完全加成后的产物分子中含3个甲基,故B错误;碳碳双键、碳碳三键均能与Br2发生加成反应,则1 mol该烃与Br2完全加成,消耗Br2的物质的量为3 mol,故C正确;该烃分子中含有6种不同化学环境的氢原子,则该烃的核磁共振氢谱图中有6组吸收峰,故D正确。
8.D 根据单炔烃与足量的氢气发生加成反应的特点,把烷烃分子内相邻的2个碳原子上各去掉2个氢原子后形成碳碳三键即可,故符合条件的单炔烃有、。
9.A 由1 mol烃A完全燃烧得到3 mol CO2,可知A分子中含3个C原子;由1 mol烃A能与2 mol HCl完全加成生成化合物B,可知A分子中含碳碳三键(不考虑),故A是,B是或或。1 mol B中含6 mol H,可被6 mol Cl2完全取代,A正确;反应CaC2+2H2O Ca(OH)2+C2H2↑可制备乙炔,不能制取烃A,B错误;B分子中不含碳碳不饱和键,不能发生加聚反应,C错误;烃A是丙炔,D错误。
10.C 中含有碳碳三键,含有碳碳三键的最长碳链上有6个碳原子,从左侧开始给主链上的碳原子编号,碳碳三键在2、3号碳原子之间,4号碳原子上有一个甲基,因此名称为4-甲基-2-己炔。
11.C 炔烃发生加成反应时,其碳骨架结构不变,所以该炔烃与2-甲基丁烷的碳骨架结构相同,2-甲基丁烷()中能插入碳碳三键的位置只有一个,即该炔烃的结构简式为,其名称为3-甲基-1-丁炔。
12.B 电石跟水反应比较剧烈,若向电石中滴加饱和氯化钠溶液,电石与水反应,消耗水,使得NaCl在电石表面析出,减小了电石与水的接触面积,减小了反应速率,故A正确;乙炔气体中混有的硫化氢可以被Br2氧化,对乙炔性质的检验产生干扰,所以需要用硫酸铜溶液除杂,故B错误;酸性KMnO4溶液具有强氧化性,乙炔使酸性KMnO4溶液褪色,体现了乙炔的还原性,故C正确;对于烃类物质而言,不饱和程度越高,则含碳量越高,燃烧时火焰越明亮,烟越浓,故D正确。
13.答案 (1)ADF
(2)1 3 4 2 5
(3)除去H2S等杂质气体
(4)验纯
解析 (1)实验室用电石和饱和氯化钠溶液反应制取乙炔,此反应不需加热,故所需的发生装置为ADF。
(2)制取的乙炔中含少量的H2S等杂质气体,故先用CuSO4溶液洗气,再用溴水或酸性高锰酸钾溶液来检验乙炔性质,则实验装置接口的连接顺序为发生装置出口1接3,4接2或5。
(3)电石中含CaS等杂质,会导致制得的乙炔中含H2S等杂质气体,对乙炔的检验造成干扰,故硫酸铜溶液的作用是除去H2S等杂质气体。
(4)可燃性气体在点燃前必须验纯。
14.答案 (1)Ca2+[··C……C··]2- CaC2+2H2O C2H2↑+Ca(OH)2
(2)向下 (3)硫酸铜溶液 (4)溶液褪色 +Br2 CHBrCHBr 能
解析 (1)电石的主要成分为CaC2,其电子式为Ca2+[··C……C··]2-,其与水反应生成乙炔和氢氧化钙。
(2)根据连通器原理,向上移动A管,A管液面下降,右侧管内液面上升,与电石接触发生反应;向下移动A管,A管中液面上升,右侧管内液面下降,饱和食盐水与电石不再接触,反应停止。
(3)H2S、PH3等具有还原性,会影响乙炔的检验,可以用硫酸铜溶液除去。
(4)乙炔和Br2发生加成反应而使Br2的CCl4溶液褪色,少量溴单质与足量乙炔发生不完全的加成反应,发生的主要反应的化学方程式为+Br2 CHBrCHBr,产物1,2-二溴乙烯含有碳碳双键,可以发生加聚反应。
能力提升练
1.A 第1步:读信息,确定反应的位置与方式。断键后可得到和。第2步:类比所给信息的反应方式,迁移应用。的断键方式有:、。若按①断键可得到(丙炔)和(2,3-二甲基-1,3-丁二烯);若按②断键可得(2-甲基-1,3-丁二烯)和(2-丁炔)。
2.答案 (1)碳碳双键、碳碳三键
(2)加成反应 HCl
(3)3 CH3CH2CH2CH3 2-甲基丙烷
(4) 1-戊炔、 2-戊炔、 3-甲基-1-丁炔
(5)、
解析 (1)中含有的官能团是碳碳双键、碳碳三键。(2) ,碳碳三键转变为碳碳双键,H、Cl分别与三键碳原子直接相连,该反应为加成反应;该反应的反应物除乙烯基乙炔外,还有HCl。(3)中碳碳双键、碳碳三键均能与H2发生加成反应,即1 mol 完全加成时消耗3 mol H2;乙烯基乙炔与氢气完全加成的生成物的结构简式为CH3CH2CH2CH3,该物质为正丁烷,其同分异构体为异丁烷,异丁烷的系统命名为2-甲基丙烷。(5)2-甲基戊烷的结构简式为,根据单炔烃发生催化加氢反应的特点,将中相邻的2个碳原子上各去掉2个氢原子后形成碳碳三键即可,则该炔烃的结构简式为、。
3.B 电石的主要成分是碳化钙,含少量硫化钙等杂质,为了减缓碳化钙与水的反应速率,常用饱和食盐水替代水,A项正确;不能用启普发生器替代烧瓶,B项错误;电石与水反应生成的乙炔中混有硫化氢等杂质,用硫酸铜溶液除杂,C项正确;丙装置中发生反应:2[Cu(NH3)2]Cl++2H2O +2NH4Cl+2NH3·H2O,元素化合价没有变化,不属于氧化还原反应,D项正确。
4.答案 (1)CaC2+2H2O +Ca(OH)2 (2)减小反应速率,使产生的乙炔气流平稳 (3)除去乙炔中的杂质气体 溶液的紫红色褪去 (4)加成反应 +2Br2 CHBr2CHBr2 (5)×100%
解析 (1)电石的主要成分是CaC2,与水反应生成乙炔和氢氧化钙,化学方程式为CaC2+2H2O +Ca(OH)2。(2)电石和水反应非常剧烈,用饱和食盐水代替蒸馏水,可以减小反应速率,使产生的乙炔气流平稳。(3)装置A中CuSO4溶液用来除去乙炔中的H2S、PH3等杂质气体;乙炔能被酸性KMnO4溶液氧化,装置B中的现象是溶液的紫红色褪去。(4)装置C中乙炔和Br2发生加成反应,完全加成的化学方程式为+2Br2 CHBr2CHBr2。(5)根据题意可知,溴的四氯化碳溶液增重b g,即生成乙炔的质量为b g,乙炔的物质的量为 mol,根据CaC2+2H2O +Ca(OH)2可知参加反应的CaC2的物质的量为 mol,故m(CaC2)=×64 g,则CaC2的纯度为×100%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版高中化学选择性必修3同步
第2课时 炔烃
基础过关练
题组一 炔烃的结构与性质
1.下列说法中正确的是( )
A.炔烃分子中所有的碳原子都在同一条直线上
B.分子组成符合CnH2n-2的链烃,一定是炔烃
C.炔烃易溶于水
D.炔烃既可使溴水褪色,又可使酸性KMnO4溶液褪色
2.下列关于乙炔的说法错误的是( )
A.乙炔的键角为180°,是非极性分子
B.分子中碳原子的sp杂化轨道形成σ键,未参与杂化的2p轨道形成两个π键,且两个π键互相垂直
C.碳碳三键中三条键能量大小相同,其键长是碳碳单键的
D.乙炔分子中既有极性键也有非极性键
3.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.完全燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能被酸性高锰酸钾溶液氧化
D.能与氯化氢反应生成氯乙烯
4.(经典题)下列各选项的叙述中,能说明分子式为C4H6的烃是,而不是CH2CH—CHCH2的是( )
A.燃烧时有黑烟
B.能使酸性KMnO4溶液褪色
C.分子中所有原子都在同一平面上
D.与足量溴水反应,生成物分子中只有2个碳原子上有溴原子
5.以乙炔为原料制取CH2BrCHBrCl,可行的反应途径是( )
A.先与Cl2加成,再与Br2加成
B.先与Cl2加成,再与HBr加成
C.先与HCl加成,再与HBr加成
D.先与HCl加成,再与Br2加成
6.(2023安徽师大附中期末)0.5 mol某气态烃能与1 mol HCl完全加成,加成后产物分子中的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A. B.CH2CH2
C. D.CH2C(CH3)2
7.某烃的结构简式为,下列说法不正确的是( )
A.1 mol该烃完全燃烧消耗11 mol O2
B.与氢气完全加成后的产物分子中含2个甲基
C.1 mol该烃与Br2完全加成,消耗Br2的物质的量为3 mol
D.该烃的核磁共振氢谱图中有6组吸收峰
8.(2022江苏连云港期中)某链状单炔烃与足量的氢气加成,生成如图所示的烷烃,则符合条件的炔烃共有(不考虑立体异构)( )
A.6种 B.4种
C.3种 D.2种
(2022云南玉溪一中月考)已知1 mol某烃A完全燃烧可得到
3 mol CO2;在一定条件下,1 mol该烃能与2 mol HCl完全加成生成化合物B。下列说法正确的是( )
A.1 mol化合物B中的氢原子可被6 mol Cl2完全取代
B.实验室制取烃A的化学方程式为CaC2+2H2O Ca(OH)2+C2H2↑
C.化合物B可发生加聚反应
D.烃A为2-甲基丙烯
题组二 炔烃的命名
10.(经典题)有机物的命名为( )
A.3-甲基-4-己炔
B.4-乙基-2-戊炔
C.4-甲基-2-己炔
D.2-乙基-3-戊炔
11.某炔烃经催化加氢后可得到2-甲基丁烷,则该炔烃的名称是( )
A.2-甲基-1-丁炔
B.2-甲基-3-丁炔
C.3-甲基-1-丁炔
D.3-甲基-2-丁炔
题组三 乙炔的实验室制法
12.(2022天津五校期中)如图为实验室制取乙炔并验证其性质的装置(部分夹持装置已略去)。下列说法不合理的是( )
A.用饱和氯化钠溶液代替水可减小生成乙炔的速率
B.若用溴水验证乙炔的性质,不需要除杂
C.酸性KMnO4溶液褪色,说明乙炔具有还原性
D.将纯净的乙炔点燃,有浓烟,说明乙炔不饱和程度高
13.下列是实验室制取乙炔、洗气和性质实验所需的装置及试剂,按要求回答下列问题:
(1)制取乙炔气体所需的发生装置是 (填字母)。
(2)如果按照气体发生、洗气、性质实验装置的顺序从左到右连接起来,请写出接口连接的顺序:发生装置出口 接 , 接 或 。(填数字)
(3)装置C的作用是 。
(4)如果要进行乙炔的可燃性实验,首先应该 。
14.(原创题)实验室用以下改进装置快速制备乙炔气体:
回答下列问题:
(1)电石的主要成分的电子式为 ,
与饱和食盐水发生反应的化学方程式为
。
(2)若要使反应停止,应 (“向上”或“向下”)移动A管。
(3)制备的乙炔气体中往往混有少量的PH3和H2S,除去这两种杂质气体,应使混合气体通过盛有足量 (填试剂名称)的洗气瓶。
(4)足量的乙炔通入含少量Br2的CCl4溶液中,观察到的现象是 ,该过程发生的主要反应的化学方程式为 ;此反应的有机产物 (填“能”或“不能”)发生加聚反应。
能力提升练
题组一 炔烃性质的综合应用
1.(经典题) (2023陕西西安期末,)已知:+ ,如果要合成,所用的起始原料可以是( )
①2-甲基-1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔
④2,3-二甲基-1,3-丁二烯和丙炔
A.①④ B.②③ C.①③ D.②④
2.(2022山东聊城月考)请回答下列问题:
Ⅰ.乙烯基乙炔()在工业上主要用于制备合成橡胶的原料2-氯-1,3-丁二烯(结构简式为)。
(1)乙烯基乙炔中的官能团是 (写名称)。
(2)乙烯基乙炔生成2-氯-1,3-丁二烯的反应类型是 ,反应物除乙烯基乙炔外,还有 (写化学式)。
(3)1 mol乙烯基乙炔与氢气完全加成需要消耗氢气 mol,该反应的生成物的结构简式为 ,与该物质互为同分异构体的烷烃的系统命名为 。
Ⅱ.(4)请写出分子式为C5H8的属于炔烃的所有有机物的结构简式并命名: 。
(5)某炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该炔烃可能的结构简式为 。
题组二 乙炔的制备与性质实验综合考查
3.查文献知,Cu2C2(乙炔亚铜)呈红褐色,难溶于水。实验室制备原理:向亚铜氨盐溶液中通入乙炔。某小组设计如图实验制备乙炔亚铜。
下列说法错误的是( )
A.用饱和食盐水替代水的目的是减小反应速率
B.甲装置中烧瓶可以用启普发生器替代
C.乙装置的作用是除去乙炔中H2S等杂质
D.丙装置中发生反应过程中没有电子的转移
4.(2023广东汕尾月考,)乙炔是一种无色、无臭的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。回答下列问题:
利用电石制备乙炔的化学方程式为
。
用饱和食盐水代替蒸馏水的目的是
。
装置A的作用是 ,装置B中的现象是
。
(4)装置C中发生反应的类型是 ,完全反应的化学方程式为 。
(5)若称取a g电石,反应完全后,将生成的乙炔全部通入足量溴的四氯化碳溶液中,溶液增重b g,则电石的纯度为 (用含有a、b的式子表示)。
答案与分层梯度式解析
第2课时 炔烃
基础过关练
1.D 2.C 3.D 4.D 5.D 6.C 7.B 8.D
9.A 10.C 11.C 12.B
1.D 炔烃分子中的碳原子不一定都在同一直线上,如中甲基的碳原子与其他3个碳原子不在同一直线上,A错误;分子组成符合CnH2n-2的链烃可能是二烯烃,B错误;炔烃难溶于水,C错误;炔烃既可与溴单质发生加成反应而使溴水褪色,也可与酸性KMnO4溶液发生氧化反应而使酸性KMnO4溶液褪色,D正确。
2.C 乙炔为直线形分子,键角为180°,属于非极性分子,故A正确;乙炔分子中的碳原子均采取sp杂化,每个碳原子的一个2s轨道和一个2p轨道杂化形成两个sp杂化轨道,其中一个sp杂化轨道与氢原子的1s轨道“头碰头”重叠形成C—H σ键,另一个sp杂化轨道则与另一个碳原子的sp杂化轨道“头碰头”重叠形成C—C σ键,两个碳原子未参与杂化的2p轨道则“肩并肩”重叠形成两个π键,且这两个π键相互垂直,故B正确;碳碳三键的三条键能量大小不同,键长大于碳碳单键的,故C错误;乙炔中C—H键为极性共价键,碳碳三键为非极性共价键,故D正确。
3.D 乙烯、乙烷、乙炔完全燃烧都生成CO2和H2O,A项不符合题意;乙烯、乙炔都能与溴水发生加成反应、都能被酸性KMnO4溶液氧化,B、C项不符合题意;乙烯与HCl在一定条件下反应生成氯乙烷,乙炔在一定条件下能与HCl反应生成氯乙烯,乙烷与HCl不反应,D项符合题意。
4.D 1-丁炔和1,3-丁二烯分子中含碳量相同,燃烧都产生黑烟,故A错误;1-丁炔含碳碳三键,1,3-丁二烯含碳碳双键,均能使酸性KMnO4溶液褪色,故B错误;1,3-丁二烯分子中所有原子都在同一平面上,但1-丁炔分子中所有原子不在同一平面上,故C错误;与足量溴水反应,生成物分子中只有2个碳原子上有溴原子,说明该烃是1-丁炔,若是1,3-丁二烯,则生成物分子中会有4个碳原子上有溴原子,故D正确。
5.D 由乙炔()制CH2BrCHBrCl,CH2BrCHBrCl分子组成比乙炔分子多一个H、两个Br、一个Cl,据此分析可知需要由乙炔与HCl和Br2(或Br2和HCl)先后发生加成反应制得,选项A、B、C不符合题意,选D。
6.C 0.5 mol该烃能与1 mol HCl完全加成,说明烃分子中含有1个碳碳三键或2个碳碳双键;加成后产物分子中的氢原子又可被
3 mol Cl2完全取代,说明0.5 mol该烃与1 mol HCl完全加成后的产物分子中含有3 mol H原子,则0.5 mol该烃中含有2 mol H原子,即1 mol该烃中含有4 mol H原子,选项中符合要求的只有。
7.B 由该烃的结构简式可知分子式为C8H12,则1 mol该烃完全燃烧消耗O2的物质的量为(8+)mol=11 mol,故A正确;碳碳双键、碳碳三键均能与氢气发生加成反应,则该烃与H2完全加成后的产物分子中含3个甲基,故B错误;碳碳双键、碳碳三键均能与Br2发生加成反应,则1 mol该烃与Br2完全加成,消耗Br2的物质的量为3 mol,故C正确;该烃分子中含有6种不同化学环境的氢原子,则该烃的核磁共振氢谱图中有6组吸收峰,故D正确。
8.D 根据单炔烃与足量的氢气发生加成反应的特点,把烷烃分子内相邻的2个碳原子上各去掉2个氢原子后形成碳碳三键即可,故符合条件的单炔烃有、。
9.A 由1 mol烃A完全燃烧得到3 mol CO2,可知A分子中含3个C原子;由1 mol烃A能与2 mol HCl完全加成生成化合物B,可知A分子中含碳碳三键(不考虑),故A是,B是或或。1 mol B中含6 mol H,可被6 mol Cl2完全取代,A正确;反应CaC2+2H2O Ca(OH)2+C2H2↑可制备乙炔,不能制取烃A,B错误;B分子中不含碳碳不饱和键,不能发生加聚反应,C错误;烃A是丙炔,D错误。
10.C 中含有碳碳三键,含有碳碳三键的最长碳链上有6个碳原子,从左侧开始给主链上的碳原子编号,碳碳三键在2、3号碳原子之间,4号碳原子上有一个甲基,因此名称为4-甲基-2-己炔。
11.C 炔烃发生加成反应时,其碳骨架结构不变,所以该炔烃与2-甲基丁烷的碳骨架结构相同,2-甲基丁烷()中能插入碳碳三键的位置只有一个,即该炔烃的结构简式为,其名称为3-甲基-1-丁炔。
12.B 电石跟水反应比较剧烈,若向电石中滴加饱和氯化钠溶液,电石与水反应,消耗水,使得NaCl在电石表面析出,减小了电石与水的接触面积,减小了反应速率,故A正确;乙炔气体中混有的硫化氢可以被Br2氧化,对乙炔性质的检验产生干扰,所以需要用硫酸铜溶液除杂,故B错误;酸性KMnO4溶液具有强氧化性,乙炔使酸性KMnO4溶液褪色,体现了乙炔的还原性,故C正确;对于烃类物质而言,不饱和程度越高,则含碳量越高,燃烧时火焰越明亮,烟越浓,故D正确。
13.答案 (1)ADF
(2)1 3 4 2 5
(3)除去H2S等杂质气体
(4)验纯
解析 (1)实验室用电石和饱和氯化钠溶液反应制取乙炔,此反应不需加热,故所需的发生装置为ADF。
(2)制取的乙炔中含少量的H2S等杂质气体,故先用CuSO4溶液洗气,再用溴水或酸性高锰酸钾溶液来检验乙炔性质,则实验装置接口的连接顺序为发生装置出口1接3,4接2或5。
(3)电石中含CaS等杂质,会导致制得的乙炔中含H2S等杂质气体,对乙炔的检验造成干扰,故硫酸铜溶液的作用是除去H2S等杂质气体。
(4)可燃性气体在点燃前必须验纯。
14.答案 (1)Ca2+[··C……C··]2- CaC2+2H2O C2H2↑+Ca(OH)2
(2)向下 (3)硫酸铜溶液 (4)溶液褪色 +Br2 CHBrCHBr 能
解析 (1)电石的主要成分为CaC2,其电子式为Ca2+[··C……C··]2-,其与水反应生成乙炔和氢氧化钙。
(2)根据连通器原理,向上移动A管,A管液面下降,右侧管内液面上升,与电石接触发生反应;向下移动A管,A管中液面上升,右侧管内液面下降,饱和食盐水与电石不再接触,反应停止。
(3)H2S、PH3等具有还原性,会影响乙炔的检验,可以用硫酸铜溶液除去。
(4)乙炔和Br2发生加成反应而使Br2的CCl4溶液褪色,少量溴单质与足量乙炔发生不完全的加成反应,发生的主要反应的化学方程式为+Br2 CHBrCHBr,产物1,2-二溴乙烯含有碳碳双键,可以发生加聚反应。
能力提升练
1.A 第1步:读信息,确定反应的位置与方式。断键后可得到和。第2步:类比所给信息的反应方式,迁移应用。的断键方式有:、。若按①断键可得到(丙炔)和(2,3-二甲基-1,3-丁二烯);若按②断键可得(2-甲基-1,3-丁二烯)和(2-丁炔)。
2.答案 (1)碳碳双键、碳碳三键
(2)加成反应 HCl
(3)3 CH3CH2CH2CH3 2-甲基丙烷
(4) 1-戊炔、 2-戊炔、 3-甲基-1-丁炔
(5)、
解析 (1)中含有的官能团是碳碳双键、碳碳三键。(2) ,碳碳三键转变为碳碳双键,H、Cl分别与三键碳原子直接相连,该反应为加成反应;该反应的反应物除乙烯基乙炔外,还有HCl。(3)中碳碳双键、碳碳三键均能与H2发生加成反应,即1 mol 完全加成时消耗3 mol H2;乙烯基乙炔与氢气完全加成的生成物的结构简式为CH3CH2CH2CH3,该物质为正丁烷,其同分异构体为异丁烷,异丁烷的系统命名为2-甲基丙烷。(5)2-甲基戊烷的结构简式为,根据单炔烃发生催化加氢反应的特点,将中相邻的2个碳原子上各去掉2个氢原子后形成碳碳三键即可,则该炔烃的结构简式为、。
3.B 电石的主要成分是碳化钙,含少量硫化钙等杂质,为了减缓碳化钙与水的反应速率,常用饱和食盐水替代水,A项正确;不能用启普发生器替代烧瓶,B项错误;电石与水反应生成的乙炔中混有硫化氢等杂质,用硫酸铜溶液除杂,C项正确;丙装置中发生反应:2[Cu(NH3)2]Cl++2H2O +2NH4Cl+2NH3·H2O,元素化合价没有变化,不属于氧化还原反应,D项正确。
4.答案 (1)CaC2+2H2O +Ca(OH)2 (2)减小反应速率,使产生的乙炔气流平稳 (3)除去乙炔中的杂质气体 溶液的紫红色褪去 (4)加成反应 +2Br2 CHBr2CHBr2 (5)×100%
解析 (1)电石的主要成分是CaC2,与水反应生成乙炔和氢氧化钙,化学方程式为CaC2+2H2O +Ca(OH)2。(2)电石和水反应非常剧烈,用饱和食盐水代替蒸馏水,可以减小反应速率,使产生的乙炔气流平稳。(3)装置A中CuSO4溶液用来除去乙炔中的H2S、PH3等杂质气体;乙炔能被酸性KMnO4溶液氧化,装置B中的现象是溶液的紫红色褪去。(4)装置C中乙炔和Br2发生加成反应,完全加成的化学方程式为+2Br2 CHBr2CHBr2。(5)根据题意可知,溴的四氯化碳溶液增重b g,即生成乙炔的质量为b g,乙炔的物质的量为 mol,根据CaC2+2H2O +Ca(OH)2可知参加反应的CaC2的物质的量为 mol,故m(CaC2)=×64 g,则CaC2的纯度为×100%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
