4.1.2元素周期表 核素课件(共27张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.2元素周期表 核素课件(共27张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 912.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 00:00:00 | ||
图片预览





文档简介
(共27张PPT)
元素周期表 核素
学习目标:
1.知道元素周期表的结构,认识原子结构与元素在元素周期表中位置的关系。
2.了解元素、核素、同位素的概念。
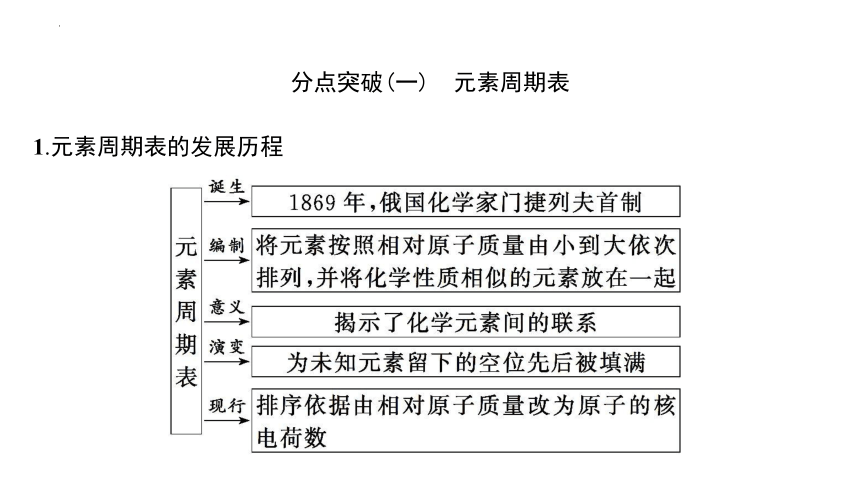
分点突破(一) 元素周期表
1.元素周期表的发展历程
2.元素周期表的编排原则
(1)原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数。
(2)原子序数= 核电荷数 = 质子数 =核外电子数。
(3)横行原则:把 电子层数目 相同的元素,按 原子序数 递增的顺序从左到右排列。
(4)纵列原则:把不同横行中 最外层电子数 相同的元素,按电子层数递增的顺序由上而下排列。
核电荷数
质子数
电子层数目
原子序数
最外层电子数
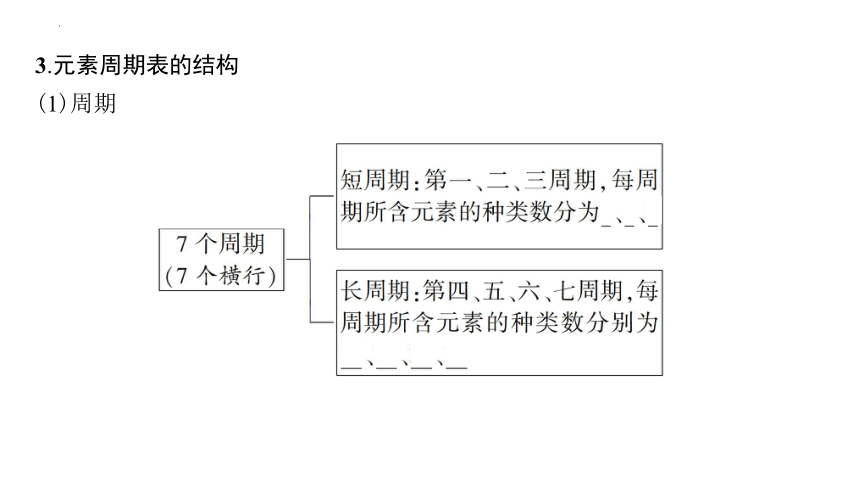
3.元素周期表的结构
(1)周期
(2)族
个数 元素周期表中有18个纵列,共有 16 个族
特点 主族元素的族序数= 最外层电子数
分类 主族 包括第 ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA 族
副族 包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族和第Ⅷ族(包括 8、9、10 三个纵列)
0族 占据元素周期表的第 18 纵列,最外层电子数为 8 (He为2)
16
最外层电子数
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
8、
9、10
18
8
(3)常见族的别称
族 别名
第ⅠA族(除氢外) 碱金属 元素
第ⅦA族 卤族 元素
0族 稀有气体元素
碱金属
卤族
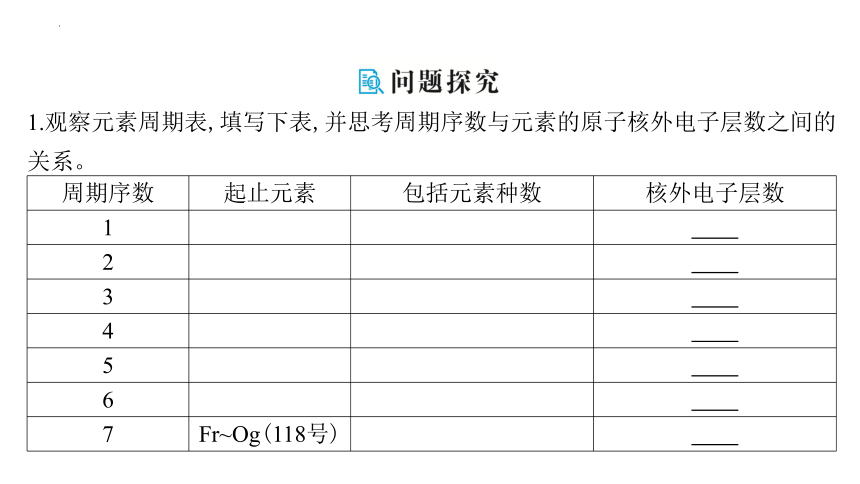
1.观察元素周期表,填写下表,并思考周期序数与元素的原子核外电子层数之间的关系。
周期序数 起止元素 包括元素种数 核外电子层数
1
2
3
4
5
6
7 Fr~Og(118号)
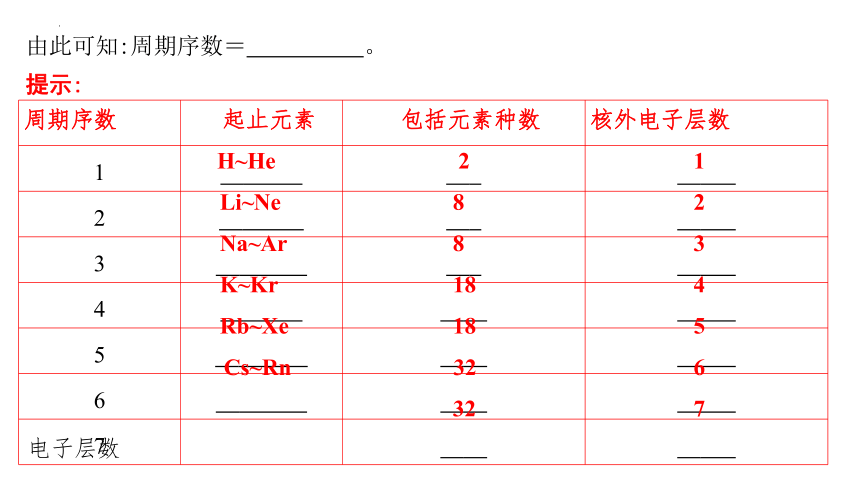
由此可知:周期序数= 。
提示:
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2 Li~Ne 8 2
3 Na~Ar 8 3
4 K~Kr 18 4
5 Rb~Xe 18 5
6 Cs~Rn 32 6
7 32 7
电子层数
周期序数
起止元素
包括元素种数
核外电子层数
H~He
2
1
Li~Ne
8
2
Na~Ar
8
3
K~Kr
18
4
Rb~Xe
18
5
Cs~Rn
32
6
32
7
2.同周期的第ⅡA、ⅢA族元素间原子序数差值可能为多少 并说明原因。
提示:第二、三周期差1,第四、五周期差11,原因是中间隔10格过渡元素,第六、七周期差25,原因是中间隔10格过渡元素,且第ⅢB族一格为15种元素。
3.元素周期表中同主族某相邻两元素的原子序数差值为 。
提示:2或8或18或32
4.34号元素R在周期表中的位置是 。
提示:R原子(34号)核外含有4个电子层,最外层含有6个电子,则元素R在周期表中位于第四周期第ⅥA族。
元素周期表的结构
1.三个定量关系
(1)周期序数=电子层数
(2)主族序数=最外层电子数
(3)原子序数=核电荷数=质子数
=核外电子数
2.原子序数的定量关系
(1)同周期:ⅡA与ⅢA族原子序数差可能为1、11、25。
(2)同主族相邻周期原子序数差:ⅠA~ⅡA:上一周期元素种类数;ⅢA~0族:下一周期元素种类数。如Na与K相差8,Cl与Br相差18。
1.下列关于元素周期表的叙述正确的是( )
A.在元素周期表中共有18个纵行,18个族
B.同族元素的最外层电子数一定相同
C.同周期元素的电子层数相同
D.元素周期表有7个周期,8个主族
解析:C A项,元素周期表中共有18个纵行,有7个主族、8个副族、1个0族,共有16个族,错误;B项,对于0族元素、过渡元素而言,同族元素的最外层电子数不一定相同,如He、Ne,错误;D项,元素周期表有7个周期,有7个主族,错误。
2.主族元素在周期表的位置,取决于元素原子的( )
A.相对原子质量和核电荷数
B.电子层数和最外层电子数
C.电子层数和质量数
D.原子序数和最外层电子数
解析:B 原子结构中,电子层数=周期序数,最外层电子数=主族序数,则原子结构中的电子层数、最外层电子数决定主族元素在周期表中的位置。
3.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为( )
A.X+2 B.X+4
C.X+8 D.X+10
解析:B 由元素周期表结构可知,对于ⅠA、ⅡA元素而言,同主族相邻周期原子序数之差为上一周期元素的种类数;对于其他主族,同主族相邻周期原子序数之差为下一周期元素的种类数,同一主族不同周期的元素,原子序数相差可能为2、8、18、32等或它们的组合,如10、26、34等,不可能相差4,即乙的原子序数不可能为X+4,选B。
4.下列各表为周期表的一部分(表中数字为原子序数),其中正确的是( )
解析:D 根据前四周期元素周期表,只有D正确。
分点突破(二) 核素、同位素
1.核素
(1)概念:具有一定数目 质子 和一定数目 中子 的一种原子。
(2)氢元素的三种核素
原子符号 X) 原子名称 氢元素的原子核
质子数(Z) 中子数(N)
H 氕 1 0
H或D 氘 1 1
H或T 氚 1 2
质子
中子
1
0
1
1
1
2
2.同位素
(1)概念
质子数相同而 中子数 不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。
(2)性质
①同一元素的各同位素虽然质量数不同,但它们的化学性质基本相同。
②天然存在的同位素,相互间保持一定的比率。
中子数
(3)用途
①考古时利用 C 测定一些文物的年代。
H和H用于制造氢弹。
C
③利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
1.H、D、T、H+四种粒子是否为同一元素 为什么
提示:为同一元素;因为它们原子核内质子数(或核电荷数)相同。
2.氢有H、D和T三种原子,它们和35Cl、37Cl组成的氯化氢分子有 种。
提示:氢原子有三种同位素1H、2H、3H,即H、D、T,氯原子有两种同位素35Cl、37Cl,故氯化氢分子可能为H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl,则形成的氯化氢分子的种类有6种。
同位素的“六同三不同”
1.下列说法错误的是( )
A.HH、H+和H2是氢元素的四种不同粒子
BCa和 Ca、石墨和金刚石均为同素异形体
CH和 H是不同的核素
D.12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
解析:BCa和Ca是质子数相同、中子数不同的两种核素,二者互为同位素,不属于同素异形体。
2.在高层大气中,宇宙射线产生的中子轰击N可使其转变为C。下列说法正确的是( )
AN和C互为同位素
BC和C60互为同素异形体
CN核素的中子数为7
D.14CO2的相对分子质量为44
解析:C A项N和C质子数不同,不能互称为同位素,错误;B项C是碳的一种核素,而C60是单质,不互为同素异形体,错误;D项, 14CO2的相对分子质量为14+16×2=46,错误。
核裂变(或衰变)反应“两守恒”(归纳与论证)
用中子轰击X原子产生α粒子(即氦核He)的核裂变反应为XnY
He。已知元素Y在化合物中呈+1价。下列说法错误的是( )
A.X的质量数为10
B.Y元素是Li
C.X元素是B
D.6Y和7Y互为同素异形体
解析:D 根据核反应为XnYHe可知,X的质量数N为4+7-1=10,又因为Y在化合物中呈+1价,则推知Y位于ⅠA族,质量数=质子数+中子数,Y的质量数为7,所以得出Y为Li,其质子数p=3,所以X的质子数Z=3+2-0=5,核电荷数=原子序数=核内质子数=5,则推知X属于B元素。6Li和7Li两者的质子数均为3,中子数不同,所以两者互为同位素,D错误。
核裂变(或衰变)反应遵循两大守恒
(1)反应前的质量数之和等于反应后的质量数之和。
(2)反应前的质子数之和等于反应后的质子数之和。
(3)常见的核反应示例:
①碳-14的β衰变CNe
②钋-209的α衰变PoPbHe
③卢瑟福发现质子NHeOH
④查德威克发现中子BeHCn
⑤铀核裂变反应UnKrBa+n
⑥氘核与氚核聚变反应HHHen
1.1934年约里奥—居里夫妇在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河XHeYn。其中元素X、Y的最外层电子数之和为8。下列叙述错误的是( )
AX的质量数为26
B.X的单质、氧化物均能与氢氧化钠溶液反应
C.30Y与31Y互为同位素
D.Y的含氧酸的化学式可能为H3YO4
解析:A 原子轰击实验中,满足质子数和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,且元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外层电子为a+2,解得a=3,因此X为Al,Y为P。A项Al的质量数为27,错误;B项,铝和氧化铝均能与氢氧化钠溶液反应,正确;C项,30P与31P质子数相同,中子数不同,二者互为同位素,正确;D项,P的含氧酸为H3PO4,正确。
2.2006年,科学家以钙原子撞击锎(Cf)靶,产生了一种超重元素——Og,其反应可表示为CfCaOg+3X,下面说法不正确的是( )
A.Og是0族元素,其化学性质不活泼,不与任何物质发生反应
BCa与Ca互为同位素
COg的中子数为176
D.X的符号可表示为n
解析:A Og是0族元素,其化学性质不活泼,但在一定条件下也能与某些物质反应,A错误Ca与Ca属于质子数相同中子数不同的不同核素,二者互为同位素,B正确Og的中子数=294-118=176,C正确;X的质子数==0,质量数==1,则X的符号可表示为n,D正确。
元素周期表 核素
学习目标:
1.知道元素周期表的结构,认识原子结构与元素在元素周期表中位置的关系。
2.了解元素、核素、同位素的概念。
分点突破(一) 元素周期表
1.元素周期表的发展历程
2.元素周期表的编排原则
(1)原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数。
(2)原子序数= 核电荷数 = 质子数 =核外电子数。
(3)横行原则:把 电子层数目 相同的元素,按 原子序数 递增的顺序从左到右排列。
(4)纵列原则:把不同横行中 最外层电子数 相同的元素,按电子层数递增的顺序由上而下排列。
核电荷数
质子数
电子层数目
原子序数
最外层电子数
3.元素周期表的结构
(1)周期
(2)族
个数 元素周期表中有18个纵列,共有 16 个族
特点 主族元素的族序数= 最外层电子数
分类 主族 包括第 ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA 族
副族 包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族和第Ⅷ族(包括 8、9、10 三个纵列)
0族 占据元素周期表的第 18 纵列,最外层电子数为 8 (He为2)
16
最外层电子数
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
8、
9、10
18
8
(3)常见族的别称
族 别名
第ⅠA族(除氢外) 碱金属 元素
第ⅦA族 卤族 元素
0族 稀有气体元素
碱金属
卤族
1.观察元素周期表,填写下表,并思考周期序数与元素的原子核外电子层数之间的关系。
周期序数 起止元素 包括元素种数 核外电子层数
1
2
3
4
5
6
7 Fr~Og(118号)
由此可知:周期序数= 。
提示:
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2 Li~Ne 8 2
3 Na~Ar 8 3
4 K~Kr 18 4
5 Rb~Xe 18 5
6 Cs~Rn 32 6
7 32 7
电子层数
周期序数
起止元素
包括元素种数
核外电子层数
H~He
2
1
Li~Ne
8
2
Na~Ar
8
3
K~Kr
18
4
Rb~Xe
18
5
Cs~Rn
32
6
32
7
2.同周期的第ⅡA、ⅢA族元素间原子序数差值可能为多少 并说明原因。
提示:第二、三周期差1,第四、五周期差11,原因是中间隔10格过渡元素,第六、七周期差25,原因是中间隔10格过渡元素,且第ⅢB族一格为15种元素。
3.元素周期表中同主族某相邻两元素的原子序数差值为 。
提示:2或8或18或32
4.34号元素R在周期表中的位置是 。
提示:R原子(34号)核外含有4个电子层,最外层含有6个电子,则元素R在周期表中位于第四周期第ⅥA族。
元素周期表的结构
1.三个定量关系
(1)周期序数=电子层数
(2)主族序数=最外层电子数
(3)原子序数=核电荷数=质子数
=核外电子数
2.原子序数的定量关系
(1)同周期:ⅡA与ⅢA族原子序数差可能为1、11、25。
(2)同主族相邻周期原子序数差:ⅠA~ⅡA:上一周期元素种类数;ⅢA~0族:下一周期元素种类数。如Na与K相差8,Cl与Br相差18。
1.下列关于元素周期表的叙述正确的是( )
A.在元素周期表中共有18个纵行,18个族
B.同族元素的最外层电子数一定相同
C.同周期元素的电子层数相同
D.元素周期表有7个周期,8个主族
解析:C A项,元素周期表中共有18个纵行,有7个主族、8个副族、1个0族,共有16个族,错误;B项,对于0族元素、过渡元素而言,同族元素的最外层电子数不一定相同,如He、Ne,错误;D项,元素周期表有7个周期,有7个主族,错误。
2.主族元素在周期表的位置,取决于元素原子的( )
A.相对原子质量和核电荷数
B.电子层数和最外层电子数
C.电子层数和质量数
D.原子序数和最外层电子数
解析:B 原子结构中,电子层数=周期序数,最外层电子数=主族序数,则原子结构中的电子层数、最外层电子数决定主族元素在周期表中的位置。
3.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为( )
A.X+2 B.X+4
C.X+8 D.X+10
解析:B 由元素周期表结构可知,对于ⅠA、ⅡA元素而言,同主族相邻周期原子序数之差为上一周期元素的种类数;对于其他主族,同主族相邻周期原子序数之差为下一周期元素的种类数,同一主族不同周期的元素,原子序数相差可能为2、8、18、32等或它们的组合,如10、26、34等,不可能相差4,即乙的原子序数不可能为X+4,选B。
4.下列各表为周期表的一部分(表中数字为原子序数),其中正确的是( )
解析:D 根据前四周期元素周期表,只有D正确。
分点突破(二) 核素、同位素
1.核素
(1)概念:具有一定数目 质子 和一定数目 中子 的一种原子。
(2)氢元素的三种核素
原子符号 X) 原子名称 氢元素的原子核
质子数(Z) 中子数(N)
H 氕 1 0
H或D 氘 1 1
H或T 氚 1 2
质子
中子
1
0
1
1
1
2
2.同位素
(1)概念
质子数相同而 中子数 不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。
(2)性质
①同一元素的各同位素虽然质量数不同,但它们的化学性质基本相同。
②天然存在的同位素,相互间保持一定的比率。
中子数
(3)用途
①考古时利用 C 测定一些文物的年代。
H和H用于制造氢弹。
C
③利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
1.H、D、T、H+四种粒子是否为同一元素 为什么
提示:为同一元素;因为它们原子核内质子数(或核电荷数)相同。
2.氢有H、D和T三种原子,它们和35Cl、37Cl组成的氯化氢分子有 种。
提示:氢原子有三种同位素1H、2H、3H,即H、D、T,氯原子有两种同位素35Cl、37Cl,故氯化氢分子可能为H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl,则形成的氯化氢分子的种类有6种。
同位素的“六同三不同”
1.下列说法错误的是( )
A.HH、H+和H2是氢元素的四种不同粒子
BCa和 Ca、石墨和金刚石均为同素异形体
CH和 H是不同的核素
D.12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
解析:BCa和Ca是质子数相同、中子数不同的两种核素,二者互为同位素,不属于同素异形体。
2.在高层大气中,宇宙射线产生的中子轰击N可使其转变为C。下列说法正确的是( )
AN和C互为同位素
BC和C60互为同素异形体
CN核素的中子数为7
D.14CO2的相对分子质量为44
解析:C A项N和C质子数不同,不能互称为同位素,错误;B项C是碳的一种核素,而C60是单质,不互为同素异形体,错误;D项, 14CO2的相对分子质量为14+16×2=46,错误。
核裂变(或衰变)反应“两守恒”(归纳与论证)
用中子轰击X原子产生α粒子(即氦核He)的核裂变反应为XnY
He。已知元素Y在化合物中呈+1价。下列说法错误的是( )
A.X的质量数为10
B.Y元素是Li
C.X元素是B
D.6Y和7Y互为同素异形体
解析:D 根据核反应为XnYHe可知,X的质量数N为4+7-1=10,又因为Y在化合物中呈+1价,则推知Y位于ⅠA族,质量数=质子数+中子数,Y的质量数为7,所以得出Y为Li,其质子数p=3,所以X的质子数Z=3+2-0=5,核电荷数=原子序数=核内质子数=5,则推知X属于B元素。6Li和7Li两者的质子数均为3,中子数不同,所以两者互为同位素,D错误。
核裂变(或衰变)反应遵循两大守恒
(1)反应前的质量数之和等于反应后的质量数之和。
(2)反应前的质子数之和等于反应后的质子数之和。
(3)常见的核反应示例:
①碳-14的β衰变CNe
②钋-209的α衰变PoPbHe
③卢瑟福发现质子NHeOH
④查德威克发现中子BeHCn
⑤铀核裂变反应UnKrBa+n
⑥氘核与氚核聚变反应HHHen
1.1934年约里奥—居里夫妇在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河XHeYn。其中元素X、Y的最外层电子数之和为8。下列叙述错误的是( )
AX的质量数为26
B.X的单质、氧化物均能与氢氧化钠溶液反应
C.30Y与31Y互为同位素
D.Y的含氧酸的化学式可能为H3YO4
解析:A 原子轰击实验中,满足质子数和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,且元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外层电子为a+2,解得a=3,因此X为Al,Y为P。A项Al的质量数为27,错误;B项,铝和氧化铝均能与氢氧化钠溶液反应,正确;C项,30P与31P质子数相同,中子数不同,二者互为同位素,正确;D项,P的含氧酸为H3PO4,正确。
2.2006年,科学家以钙原子撞击锎(Cf)靶,产生了一种超重元素——Og,其反应可表示为CfCaOg+3X,下面说法不正确的是( )
A.Og是0族元素,其化学性质不活泼,不与任何物质发生反应
BCa与Ca互为同位素
COg的中子数为176
D.X的符号可表示为n
解析:A Og是0族元素,其化学性质不活泼,但在一定条件下也能与某些物质反应,A错误Ca与Ca属于质子数相同中子数不同的不同核素,二者互为同位素,B正确Og的中子数=294-118=176,C正确;X的质子数==0,质量数==1,则X的符号可表示为n,D正确。
