4.3.2共价键课件(共31张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.2共价键课件(共31张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 657.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 00:00:00 | ||
图片预览








文档简介
(共31张PPT)
共价键
学习目标:
1.通过HCl的形成过程,理解共价键的形成过程与形成条件,建立共价键、共价化合物的判断模型。能用电子式表示离子化合物的形成过程。
2.结合典型实例认识离子键和共价键的形成,建立化学键的概念。
3.知道分子存在一定的空间结构,认识化学键的断裂和形成是化学反应中物质变化的实质。
分点突破(一) 共价键
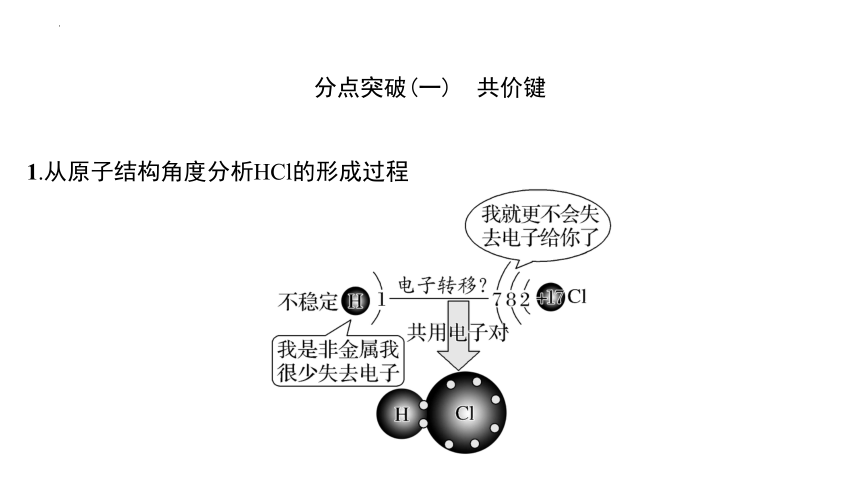
1.从原子结构角度分析HCl的形成过程
2.共价键
(1)概念:原子间通过 共用电子对 所形成的相互作用。
(2)成键三要素
共用电子对
①成键粒子: 原子 。
②成键本质: 共用电子对 。
③成键元素:一般是同种或不同种 非金属 元素。
原子
共用电子对
非金属
(3)分类
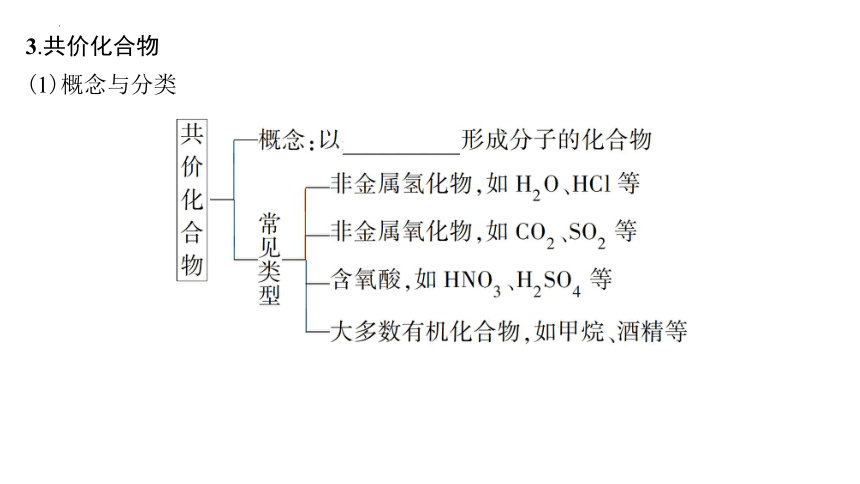
3.共价化合物
(1)概念与分类
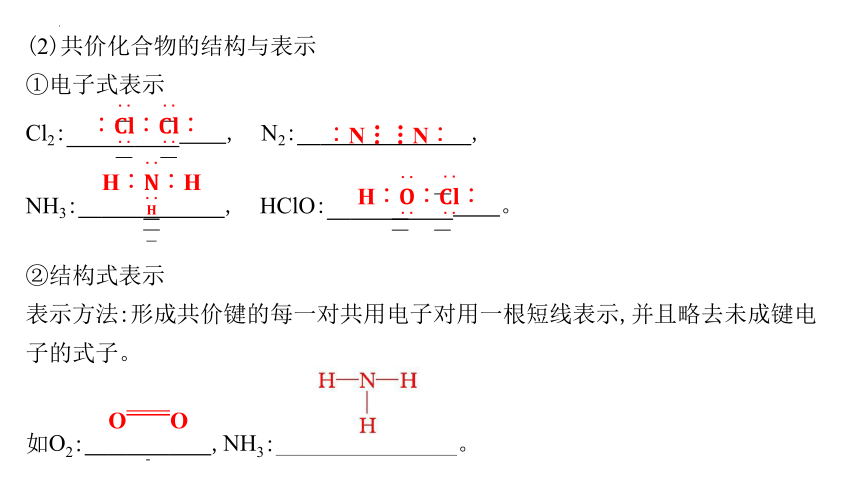
(2)共价化合物的结构与表示
①电子式表示
Cl2: ︰︰︰ , N2: ︰N N︰ ,
NH3: H︰︰H , HClO: H︰︰︰ 。
②结构式表示
表示方法:形成共价键的每一对共用电子对用一根短线表示,并且略去未成键电子的式子。
如O2: OO ,NH3: 。
︰︰︰
︰N N︰
H︰︰H
H︰︰︰
OO
4.常见的以共价键形成的分子及其结构
分子 电子式 结构式 分子结构模型
H2 HH H—H
HCl ︰ H—Cl
CO2 ︰︰C︰︰ OCO
H2O H·×·×H
CH4 H·×·×H
HH
H—H
︰
H—Cl
︰︰C︰︰
OCO
H·×·×H
H·×·×H
1.有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只含共价键的物质是 (填序号,下同)。
提示:(1)①④⑤
(2)由离子键和非极性键构成的物质是 。
提示:(2)②
(3)写出⑤的电子式 。
提示:(3)H︰︰︰H
2.含共价键的物质一定是共价化合物吗
提示:不一定。如非金属单质(O2、Cl2、N2等)中含共价键,但不属于化合物;某些离子化合物(如NaOH、Na2SO4、NH4Cl等)中既含离子键,又含共价键,属于离子化合物。
3.Na2S和Na2O2中阴、阳离子个数比是否相同
提示:相同。Na2S和Na2O2都属于离子化合物,含有的阴、阳离子个数比都是1∶2。
1.离子化合物与共价化合物的比较
离子化合物 共价化合物
概念 由离子键构成的化合物 以共用电子对形成分子的化合物
构成粒子 阴、阳离子 原子
粒子间的作用 离子键 共价键
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如葡萄糖)
熔化时破坏 的作用力 破坏离子键 一般不破坏共价键,极少数破坏共价键(如SiO2)
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物、大多数有机物
2.离子化合物和共价化合物的判断方法
(1)根据化学键的类型来判断:凡含有离子键的化合物一定是离子化合物;只含有共价键的化合物是共价化合物。
(2)根据化合物的类型来判断:大多数碱性氧化物、强碱和大多数盐等都属于离子化合物(特例:AlCl3为共价化合物);非金属氢化物、非金属氧化物、含氧酸和大多数有机化合物等都属于共价化合物。
(3)根据化合物的性质来判断:一般熔、沸点较低的化合物是共价化合物;熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如AlCl3。
1.下列分子的电子式书写正确的是( )
A.氨气 H︰︰H
B.四氯化碳 Cl︰︰Cl
C.氮气 ︰N N︰
D.二氧化碳 ︰︰C︰︰
解析:A N最外层有5个电子,与3个H形成3对共用电子,形成8电子稳定结构,A项正确;Cl最外层有7个电子,4个Cl与1个C形成4对共用电子,使各自最外层达到8电子稳定结构,Cl最外层电子未能全部标出,B项错误;在N2中,2个N之间形成3对共用电子,使各自最外层达到8电子稳定结构,C项错误;在CO2中,C必须与每个O之间形成2对共用电子,才能满足8电子稳定结构,D项错误。
2.下列物质属于共价化合物的是( )
A.O2 B.KCl
C.H2O D.Mg
解析:C A项,O2单质中只存在共价键,但属于单质,不是化合物,错误;B项,KCl中存在离子键,属于离子化合物,错误;C项,水分子中H原子与O原子之间只存在共价键,为共价化合物,正确;D项,Mg属于单质,不是化合物,错误。
3.下列各分子中,所有原子最外层都满足8电子稳定结构的是( )
A.HClO B.BF3
C.PCl3 D.SF6
解析:C HClO中H原子最外层满足2电子稳定结构,A不符合题意;BF3中B原子最外层满足6电子稳定结构,B不符合题意;PCl3中每个原子最外层都满足8电子稳定结构,C符合题意;SF6中S原子最外层满足12电子稳定结构,D不符合题意。
分点突破(二) 化学键与分子间作用力
1.化学键
(1)概念:相邻的 原子 之间强烈的相互作用。
(2)化学反应的本质:化学反应的过程,本质上就是旧化学键 断裂 和新化学键 形成 的过程。
2.分子间作用力
(1)分子间存在一种把 分子聚集 在一起的作用力,叫做分子间作用力,最初也将分子间作用力称为 范德华力 。
(2)由分子构成的物质,其熔、沸点等物理性质主要由分子间作用力大小决定。
原子
断裂
形成
分子聚集
范德华力
3.氢键
(1)氢键不是化学键,通常把氢键看作是一种特殊的分子间作用力。氢键比化学键 弱 ,比范德华力 强 。
(2)分子间形成的氢键会使物质的熔点和沸点 升高 ,水分子间的氢键可使其密度在固态时 低于 液态时的密度。
4.化学反应的过程
化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成。H2和Cl2反应生成HCl可用如下过程表示:
2H︰︰
弱
强
升高
低于
1.下列变化中:①蔗糖溶于水 ②硫酸氢钾熔化
③氨气液化 ④NaCl溶于水 ⑤Na2O2溶于水 ⑥HBr溶于水
(1)只有离子键被破坏的是 ,只有共价键被破坏的是 。
提示:(1)②④ ⑥
(2)既有离子键被破坏,又有共价键被破坏的是 。
提示:(2)⑤
2.在不断升温时,水将会发生如下变化
冰 液态水 水蒸气 H2+O2
每个过程中破坏的主要作用力是什么
提示:Ⅰ.氢键和范德华力 Ⅱ.氢键和范德华力 Ⅲ.共价键(H—O)
1.化学键与物质类型的关系
2.物质性质影响因素分析
凡涉及化学性质的问题,要从化学键方面找原因;凡涉及物理性质的问题,要从分子间作用力方面找原因。
1.下列有关化学键的说法正确的是( )
A.HCl溶于水、NaCl溶于水破坏的化学键类型相同
B.碘升华、NaCl颗粒被粉碎,均破坏化学键
C.氦气、液溴、硫黄中均存在共价键
D.钠与水反应、钠与氧气反应的过程中,均存在离子键的形成
解析:D HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键,破坏的化学键类型不同,A错误;碘分子之间只存在分子间作用力,碘升华破坏分子间作用力,没有破坏化学键,NaCl颗粒被粉碎,只是形状发生了变化,没有破坏化学键,B错误;稀有气体为单原子分子,不存在共价键,只存在分子间作用力,C错误;钠与水反应生成NaOH和H2,钠与氧气反应生成氧化钠或过氧化钠,均存在离子键的形成,D正确。
2.下列说法不正确的是( )
A.分子间作用力与化学键大小相当
B.分子间作用力是一种很弱的作用力
C.分子间作用力主要影响物质的物理性质
D.分子内部相邻原子之间的相互作用称为化学键,而分子间也存在相互作用,称为分子间作用力
解析:A 化学键是相邻原子之间强烈的相互作用,分子间作用力是一种分子之间弱的相互作用,分子间作用力主要影响物质的物理性质,A不正确,B、C、D正确。
3.(1)有下列物质:He、N2、CaO、H2SO4、Na2S、KOH、NaHCO3。
①其中只含共价键的是 ;
②只含离子键的是 ;
③既含有共价键又含有离子键的是 ;
④属于共价化合物的是 ;
⑤属于离子化合物的是 。
解析:(1)N2、H2SO4分子中只含共价键;CaO、Na2S中只含离子键;KOH、NaHCO3中既含有离子键又含有共价键,He分子中不含化学键。
答案:(1)①N2、H2SO4 ②CaO、Na2S ③KOH、NaHCO3 ④H2SO4 ⑤CaO、Na2S、KOH、NaHCO3
(2)下列变化中,不需要破坏化学键的是 。
A.硫酸与氢氧化钠反应
B.加热氯酸钾使其分解
C.冰融化
D.氯化钠溶于水
解析:(2)硫酸与氢氧化钠反应中有化学键的断裂和形成,化学键被破坏;NaCl溶于水,离子键被破坏;KClO3受热分解破坏离子键和共价键;冰融化后变为液态水,共价键未被破坏。
答案:(2)C
1.下列有关表述错误的是( )
A.IBr的电子式为︰︰︰
B.HClO的结构式为H—O—Cl
C.HIO各原子最外层都满足8电子结构
D.CaF2的形成过程可以表示为
解析:C IBr是共价化合物,电子式为︰︰︰,A正确;HClO是共价化合物,电子式为H︰︰︰,结构式为H—O—Cl,B正确;HIO的结构与HClO类似,结构式为H—O—I,电子式为H︰︰︰,分子中I、O原子的最外层都达到8电子稳定结构,H原子最外层只有2个电子,C错误;CaF2为离子化合物,由钙离子和氟离子构成,用电子式表示CaF2的形成过程为 ,D正确。
2.下列关于化学键的说法正确的是( )
A.单质分子中一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.化合物分子里的化学键一定是极性键
解析:B A项,构成单质分子的粒子不一定含有共价键,如稀有气体分子,错误;B项,由非金属元素组成的化合物不一定是共价化合物,也可以是离子化合物,如NH4Cl,正确;C项,非极性键除存在于双原子单质分子里外,也可能存在于多原子的共价化合物中,如H2O2,或离子化合物中,如Na2O2,错误;D项,化合物分子里的化学键可能含极性键和非极性键,如H2O2,错误。
3.共价键、离子键和范德华力是粒子之间的三种作用力。下列物质中,只含有以上一种作用力的是( )
①氦 ②Na2S ③HI ④CaO ⑤Na2O2 ⑥KOH
A.①②③ B.③⑤⑥
C.②③⑤ D.①②④
解析:D ①氦中不存在化学键,只存在范德华力;②Na2S中只含有离子键,属于离子化合物;③HI分子中含H—I共价键和范德华力;④CaO中只含有离子键,属于离子化合物;⑤Na2O2中含有离子键和非极性共价键;⑥KOH中含有离子键和极性共价键;则只含有一种作用力的是①②④,故选D。
4.下列说法正确的是( )
A.氢键是一种化学键
B.同种非金属元素间不可能形成离子键
C.非金属元素间不可能形成离子化合物
D.离子化合物中一定不存在共价键
解析:B 氢键是一种特殊的分子间作用力,比化学键要弱,不是化学键,A错误;同种非金属元素的非金属性相同,不可能形成离子键,B正确;非金属元素间可能形成离子化合物,如NH4Cl,C错误;离子化合物中肯定存在离子键,可能存在共价键,如NaOH,D错误。
5.(1)有下列物质:CH4、Na2O2、NH4Cl、MgCl2。
①只含共价键的是 ;
②只含离子键的是 ;
③既含有共价键又含有离子键的是 ;
④属于共价化合物的是 ;
⑤属于离子化合物的是 。
答案:(1)①CH4 ②MgCl2
③Na2O2、NH4Cl ④CH4
⑤Na2O2、NH4Cl、MgCl2
(2)将NaHSO4溶于水,电离方程式为
;
NaHSO4在熔融状态下存在的离子为 。
答案:(2)NaHSO4Na++H++S Na+、HS
(3)设计实验证明NaCl为离子化合物:
。
答案:(3)将连接石墨电极和灯泡(或电流表)的导线与直流电源相连,然后将石墨电极插入熔融的NaCl中,灯泡亮(或电流表指针偏转),证明NaCl为离子化合物
共价键
学习目标:
1.通过HCl的形成过程,理解共价键的形成过程与形成条件,建立共价键、共价化合物的判断模型。能用电子式表示离子化合物的形成过程。
2.结合典型实例认识离子键和共价键的形成,建立化学键的概念。
3.知道分子存在一定的空间结构,认识化学键的断裂和形成是化学反应中物质变化的实质。
分点突破(一) 共价键
1.从原子结构角度分析HCl的形成过程
2.共价键
(1)概念:原子间通过 共用电子对 所形成的相互作用。
(2)成键三要素
共用电子对
①成键粒子: 原子 。
②成键本质: 共用电子对 。
③成键元素:一般是同种或不同种 非金属 元素。
原子
共用电子对
非金属
(3)分类
3.共价化合物
(1)概念与分类
(2)共价化合物的结构与表示
①电子式表示
Cl2: ︰︰︰ , N2: ︰N N︰ ,
NH3: H︰︰H , HClO: H︰︰︰ 。
②结构式表示
表示方法:形成共价键的每一对共用电子对用一根短线表示,并且略去未成键电子的式子。
如O2: OO ,NH3: 。
︰︰︰
︰N N︰
H︰︰H
H︰︰︰
OO
4.常见的以共价键形成的分子及其结构
分子 电子式 结构式 分子结构模型
H2 HH H—H
HCl ︰ H—Cl
CO2 ︰︰C︰︰ OCO
H2O H·×·×H
CH4 H·×·×H
HH
H—H
︰
H—Cl
︰︰C︰︰
OCO
H·×·×H
H·×·×H
1.有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只含共价键的物质是 (填序号,下同)。
提示:(1)①④⑤
(2)由离子键和非极性键构成的物质是 。
提示:(2)②
(3)写出⑤的电子式 。
提示:(3)H︰︰︰H
2.含共价键的物质一定是共价化合物吗
提示:不一定。如非金属单质(O2、Cl2、N2等)中含共价键,但不属于化合物;某些离子化合物(如NaOH、Na2SO4、NH4Cl等)中既含离子键,又含共价键,属于离子化合物。
3.Na2S和Na2O2中阴、阳离子个数比是否相同
提示:相同。Na2S和Na2O2都属于离子化合物,含有的阴、阳离子个数比都是1∶2。
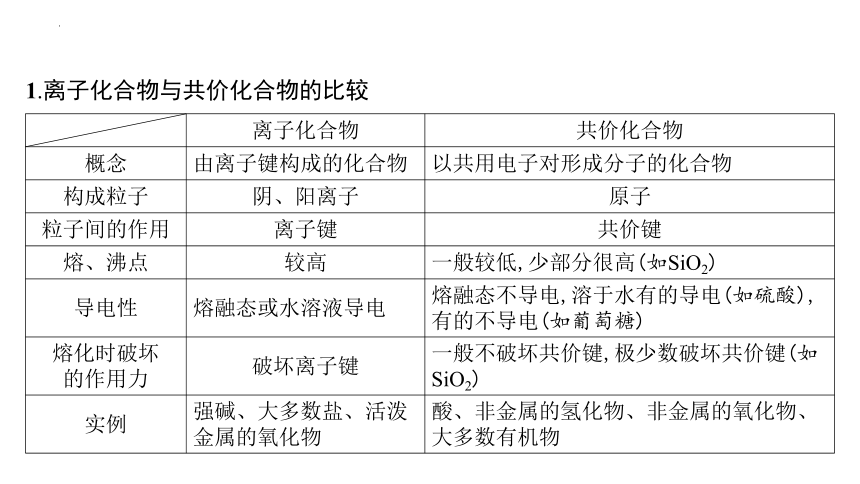
1.离子化合物与共价化合物的比较
离子化合物 共价化合物
概念 由离子键构成的化合物 以共用电子对形成分子的化合物
构成粒子 阴、阳离子 原子
粒子间的作用 离子键 共价键
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如葡萄糖)
熔化时破坏 的作用力 破坏离子键 一般不破坏共价键,极少数破坏共价键(如SiO2)
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物、大多数有机物
2.离子化合物和共价化合物的判断方法
(1)根据化学键的类型来判断:凡含有离子键的化合物一定是离子化合物;只含有共价键的化合物是共价化合物。
(2)根据化合物的类型来判断:大多数碱性氧化物、强碱和大多数盐等都属于离子化合物(特例:AlCl3为共价化合物);非金属氢化物、非金属氧化物、含氧酸和大多数有机化合物等都属于共价化合物。
(3)根据化合物的性质来判断:一般熔、沸点较低的化合物是共价化合物;熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如AlCl3。
1.下列分子的电子式书写正确的是( )
A.氨气 H︰︰H
B.四氯化碳 Cl︰︰Cl
C.氮气 ︰N N︰
D.二氧化碳 ︰︰C︰︰
解析:A N最外层有5个电子,与3个H形成3对共用电子,形成8电子稳定结构,A项正确;Cl最外层有7个电子,4个Cl与1个C形成4对共用电子,使各自最外层达到8电子稳定结构,Cl最外层电子未能全部标出,B项错误;在N2中,2个N之间形成3对共用电子,使各自最外层达到8电子稳定结构,C项错误;在CO2中,C必须与每个O之间形成2对共用电子,才能满足8电子稳定结构,D项错误。
2.下列物质属于共价化合物的是( )
A.O2 B.KCl
C.H2O D.Mg
解析:C A项,O2单质中只存在共价键,但属于单质,不是化合物,错误;B项,KCl中存在离子键,属于离子化合物,错误;C项,水分子中H原子与O原子之间只存在共价键,为共价化合物,正确;D项,Mg属于单质,不是化合物,错误。
3.下列各分子中,所有原子最外层都满足8电子稳定结构的是( )
A.HClO B.BF3
C.PCl3 D.SF6
解析:C HClO中H原子最外层满足2电子稳定结构,A不符合题意;BF3中B原子最外层满足6电子稳定结构,B不符合题意;PCl3中每个原子最外层都满足8电子稳定结构,C符合题意;SF6中S原子最外层满足12电子稳定结构,D不符合题意。
分点突破(二) 化学键与分子间作用力
1.化学键
(1)概念:相邻的 原子 之间强烈的相互作用。
(2)化学反应的本质:化学反应的过程,本质上就是旧化学键 断裂 和新化学键 形成 的过程。
2.分子间作用力
(1)分子间存在一种把 分子聚集 在一起的作用力,叫做分子间作用力,最初也将分子间作用力称为 范德华力 。
(2)由分子构成的物质,其熔、沸点等物理性质主要由分子间作用力大小决定。
原子
断裂
形成
分子聚集
范德华力
3.氢键
(1)氢键不是化学键,通常把氢键看作是一种特殊的分子间作用力。氢键比化学键 弱 ,比范德华力 强 。
(2)分子间形成的氢键会使物质的熔点和沸点 升高 ,水分子间的氢键可使其密度在固态时 低于 液态时的密度。
4.化学反应的过程
化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成。H2和Cl2反应生成HCl可用如下过程表示:
2H︰︰
弱
强
升高
低于
1.下列变化中:①蔗糖溶于水 ②硫酸氢钾熔化
③氨气液化 ④NaCl溶于水 ⑤Na2O2溶于水 ⑥HBr溶于水
(1)只有离子键被破坏的是 ,只有共价键被破坏的是 。
提示:(1)②④ ⑥
(2)既有离子键被破坏,又有共价键被破坏的是 。
提示:(2)⑤
2.在不断升温时,水将会发生如下变化
冰 液态水 水蒸气 H2+O2
每个过程中破坏的主要作用力是什么
提示:Ⅰ.氢键和范德华力 Ⅱ.氢键和范德华力 Ⅲ.共价键(H—O)
1.化学键与物质类型的关系
2.物质性质影响因素分析
凡涉及化学性质的问题,要从化学键方面找原因;凡涉及物理性质的问题,要从分子间作用力方面找原因。
1.下列有关化学键的说法正确的是( )
A.HCl溶于水、NaCl溶于水破坏的化学键类型相同
B.碘升华、NaCl颗粒被粉碎,均破坏化学键
C.氦气、液溴、硫黄中均存在共价键
D.钠与水反应、钠与氧气反应的过程中,均存在离子键的形成
解析:D HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键,破坏的化学键类型不同,A错误;碘分子之间只存在分子间作用力,碘升华破坏分子间作用力,没有破坏化学键,NaCl颗粒被粉碎,只是形状发生了变化,没有破坏化学键,B错误;稀有气体为单原子分子,不存在共价键,只存在分子间作用力,C错误;钠与水反应生成NaOH和H2,钠与氧气反应生成氧化钠或过氧化钠,均存在离子键的形成,D正确。
2.下列说法不正确的是( )
A.分子间作用力与化学键大小相当
B.分子间作用力是一种很弱的作用力
C.分子间作用力主要影响物质的物理性质
D.分子内部相邻原子之间的相互作用称为化学键,而分子间也存在相互作用,称为分子间作用力
解析:A 化学键是相邻原子之间强烈的相互作用,分子间作用力是一种分子之间弱的相互作用,分子间作用力主要影响物质的物理性质,A不正确,B、C、D正确。
3.(1)有下列物质:He、N2、CaO、H2SO4、Na2S、KOH、NaHCO3。
①其中只含共价键的是 ;
②只含离子键的是 ;
③既含有共价键又含有离子键的是 ;
④属于共价化合物的是 ;
⑤属于离子化合物的是 。
解析:(1)N2、H2SO4分子中只含共价键;CaO、Na2S中只含离子键;KOH、NaHCO3中既含有离子键又含有共价键,He分子中不含化学键。
答案:(1)①N2、H2SO4 ②CaO、Na2S ③KOH、NaHCO3 ④H2SO4 ⑤CaO、Na2S、KOH、NaHCO3
(2)下列变化中,不需要破坏化学键的是 。
A.硫酸与氢氧化钠反应
B.加热氯酸钾使其分解
C.冰融化
D.氯化钠溶于水
解析:(2)硫酸与氢氧化钠反应中有化学键的断裂和形成,化学键被破坏;NaCl溶于水,离子键被破坏;KClO3受热分解破坏离子键和共价键;冰融化后变为液态水,共价键未被破坏。
答案:(2)C
1.下列有关表述错误的是( )
A.IBr的电子式为︰︰︰
B.HClO的结构式为H—O—Cl
C.HIO各原子最外层都满足8电子结构
D.CaF2的形成过程可以表示为
解析:C IBr是共价化合物,电子式为︰︰︰,A正确;HClO是共价化合物,电子式为H︰︰︰,结构式为H—O—Cl,B正确;HIO的结构与HClO类似,结构式为H—O—I,电子式为H︰︰︰,分子中I、O原子的最外层都达到8电子稳定结构,H原子最外层只有2个电子,C错误;CaF2为离子化合物,由钙离子和氟离子构成,用电子式表示CaF2的形成过程为 ,D正确。
2.下列关于化学键的说法正确的是( )
A.单质分子中一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.化合物分子里的化学键一定是极性键
解析:B A项,构成单质分子的粒子不一定含有共价键,如稀有气体分子,错误;B项,由非金属元素组成的化合物不一定是共价化合物,也可以是离子化合物,如NH4Cl,正确;C项,非极性键除存在于双原子单质分子里外,也可能存在于多原子的共价化合物中,如H2O2,或离子化合物中,如Na2O2,错误;D项,化合物分子里的化学键可能含极性键和非极性键,如H2O2,错误。
3.共价键、离子键和范德华力是粒子之间的三种作用力。下列物质中,只含有以上一种作用力的是( )
①氦 ②Na2S ③HI ④CaO ⑤Na2O2 ⑥KOH
A.①②③ B.③⑤⑥
C.②③⑤ D.①②④
解析:D ①氦中不存在化学键,只存在范德华力;②Na2S中只含有离子键,属于离子化合物;③HI分子中含H—I共价键和范德华力;④CaO中只含有离子键,属于离子化合物;⑤Na2O2中含有离子键和非极性共价键;⑥KOH中含有离子键和极性共价键;则只含有一种作用力的是①②④,故选D。
4.下列说法正确的是( )
A.氢键是一种化学键
B.同种非金属元素间不可能形成离子键
C.非金属元素间不可能形成离子化合物
D.离子化合物中一定不存在共价键
解析:B 氢键是一种特殊的分子间作用力,比化学键要弱,不是化学键,A错误;同种非金属元素的非金属性相同,不可能形成离子键,B正确;非金属元素间可能形成离子化合物,如NH4Cl,C错误;离子化合物中肯定存在离子键,可能存在共价键,如NaOH,D错误。
5.(1)有下列物质:CH4、Na2O2、NH4Cl、MgCl2。
①只含共价键的是 ;
②只含离子键的是 ;
③既含有共价键又含有离子键的是 ;
④属于共价化合物的是 ;
⑤属于离子化合物的是 。
答案:(1)①CH4 ②MgCl2
③Na2O2、NH4Cl ④CH4
⑤Na2O2、NH4Cl、MgCl2
(2)将NaHSO4溶于水,电离方程式为
;
NaHSO4在熔融状态下存在的离子为 。
答案:(2)NaHSO4Na++H++S Na+、HS
(3)设计实验证明NaCl为离子化合物:
。
答案:(3)将连接石墨电极和灯泡(或电流表)的导线与直流电源相连,然后将石墨电极插入熔融的NaCl中,灯泡亮(或电流表指针偏转),证明NaCl为离子化合物
