4.2.1元素性质的周期性变化规律课件(共31张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2.1元素性质的周期性变化规律课件(共31张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 517.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 10:11:05 | ||
图片预览










文档简介
(共31张PPT)
元素性质的周期性变化规律
学习目标:
1.结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,建构元素周期律。
2.了解同周期和主族元素性质的递变规律。
分点突破(一) 原子结构的周期性变化
1.原子结构的变化规律
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2 1 1→ 2 2
3~10 2 1→ 8 8
11~18 3 1→ 8 8
结论:随着原子序数的递增,元素原子核外的电子排布呈现 周期性 的变化
2
2
8
8
8
周期性
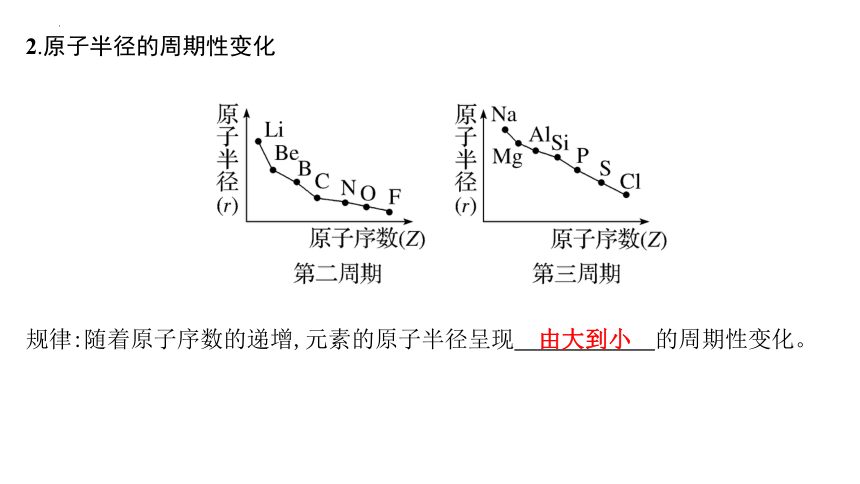
2.原子半径的周期性变化
规律:随着原子序数的递增,元素的原子半径呈现 由大到小 的周期性变化。
由大到小
3.元素主要化合价的变化规律
原子序数 主要化合价的变化
1~2 +1→0
3~10 +1→ +5 -4 →-1→0
11~18 +1→ +7 -4 →-1→0
结论:随着原子序数的递增,元素的主要化合价呈周期性变化
4.结论:随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现 周期性 的变化。
+5
-4
+7
-4
周期性
1.电子层数多的元素原子半径一定大于电子层数少的元素吗
提示:不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。
2.比较人体中含有的部分元素的原子或其离子半径大小(用“>”或“<”表示)。
(1)Cl Br,S Si Al。
提示:(1)< < <
(2)O2- F- Na+ Mg2+。
提示:(2)> > >
(3)Cl- Cl,Mg Mg2+。
提示:(3)> >
(4)K Mg,S F。
提示:(4)> >
粒子半径的大小比较
1.同周期——“序大径小”
(1)规律:同周期,从左往右,原子半径逐渐减小。
(2)如第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——“序大径大”
(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。
(2)如碱金属:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs),r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
3.同元素
(1)同种元素的原子和离子半径比较——“阴大阳小”。某原子与其离子半径比较,其阴离子半径大于该原子半径。阳离子半径小于该原子半径。如 r(Na+)<r(Na),r(Cl-)>r(Cl)。
(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。如r(Fe3+)<r(Fe2+)<r(Fe)。
4.同结构——“序大径小”
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
(2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
1.下列4种粒子中,半径按由大到小的顺序排列的是( )
① ② ③ ④
A.①>②>③>④ B.③>④>①>②
C.③>①>②>④ D.①>②>④>③
解析:C 由结构示意图可知,①为S,②为Cl,③为S2-,④为F,粒子半径:S2->S>Cl>F,即③>①>②>④,C项正确。
2.下列各组元素中,按从左到右的顺序,原子序数递增,元素的最高正化合价也递增的是( )
A.C、N、O、F B.Na、Be、B、C
C.P、S、Cl、Ar D.Na、Mg、Al、Si
解析:D A项和C项原子序数递增,而A项中F无正价,C项中Ar的化合价为0价;B项中的原子序数不完全呈递增趋势;D项中原子序数和最高正化合价均呈递增趋势。
3.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
解析:C 设该元素的最高正价为x,最低负价为y,
则 解得x=6,y=-2,因此该原子的最外层电子数为6。
分点突破(二) 第三周期元素性质的递变
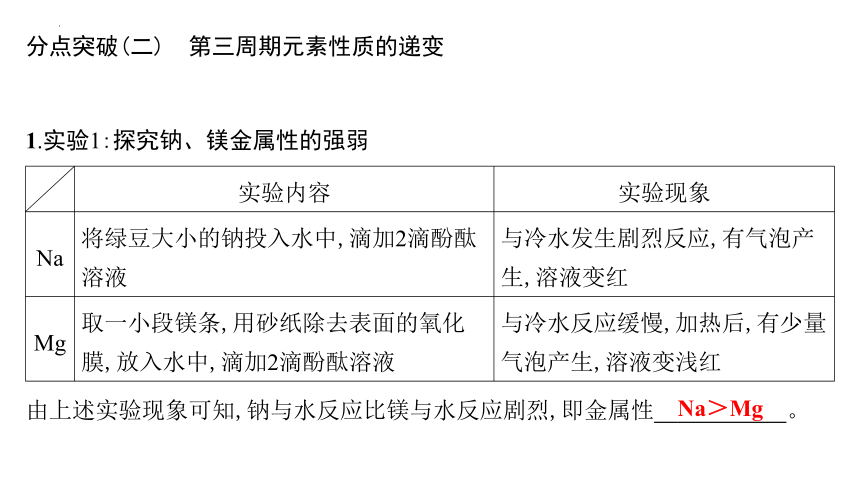
1.实验1:探究钠、镁金属性的强弱
实验内容 实验现象
Na 将绿豆大小的钠投入水中,滴加2滴酚酞溶液 与冷水发生剧烈反应,有气泡产生,溶液变红
Mg 取一小段镁条,用砂纸除去表面的氧化膜,放入水中,滴加2滴酚酞溶液 与冷水反应缓慢,加热后,有少量气泡产生,溶液变浅红
由上述实验现象可知,钠与水反应比镁与水反应剧烈,即金属性 Na>Mg 。
Na>Mg
2.实验2:探究NaOH、Mg(OH)2、Al(OH)3碱性强弱
实验操作 沉淀溶解情况
Al 沉淀逐渐溶解
沉淀逐渐溶解
实验操作 沉淀溶解情况
Mg 沉淀逐渐溶解
沉淀不溶解
(1)Al(OH)3具有两性,能溶于盐酸和NaOH溶液,试分别写出反应的离子方程式。
提示:Al(OH)3+3H+Al3++3H2O;Al(OH)3+OH- [Al(OH)4]- 。
(2)由上述实验现象得出三种物质的碱性强弱顺序是 。
提示:碱性:NaOH>Mg(OH)2>Al(OH)3
3.探究结论
随着原子序数的递增,同周期的Na、Mg、Al失去电子的能力逐渐 减弱 ,金属性逐渐 减弱 。
减弱
减弱
4.Si、P、S、Cl非金属性强弱的比较
Si P S Cl
判断依据 与氢气化合 高温 磷蒸气与氢气反应 加热 光照或点燃
由易到难的顺序是 Cl、S、P、Si
判断依据 最高价氧化物对应水化物的酸性强弱 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4强酸(酸性比H2SO4强)
酸性:HClO4 > H2SO4 > H3PO4 > H2SiO3
结论
Cl、S、P、Si
>
>
>
5.同周期元素性质递变规律
在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是 (填元素符号,下同)。
提示:(1)Cl
(2)金属性最强的元素是 。
提示:(2)Na
(3)最高价氧化物对应水化物中酸性最强的是 (填化学式,下同)。
提示:(3)HClO4
(4)最不稳定的气态氢化物是 。
提示:(4)SiH4
(5)最高价氧化物对应水化物中碱性最强的是 。
提示:(5)NaOH
(6)氧化物中具有两性的是 。
提示:(6)Al2O3
1. 同周期、同主族元素性质的递变规律
同周期(从左到右,稀有气体除外) 同主族(自上而下)
元素主要化合价 最高价:+1价→+7价(O、F除外);最低价:-4价→-1价;最低价=主族序数-8(H除外) 最高价相同(O、F除外);最低价相同;最高价=族序数(O、F除外)
原子半径 逐渐减小 逐渐增大
金属性 逐渐减弱 逐渐增强
同周期(从左到右,稀有气体除外) 同主族(自上而下)
非金属性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸、碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强
酸性逐渐减弱
形成气态氢化物的难易 由难到易 由易到难
简单气态氢化物的稳定性 逐渐增强 逐渐减弱
2.元素周期律
元素的性质随着原子序数的递增而呈现周期性的变化。其实质是元素原子的核外电子排布呈现周期性变化。
1.依据元素周期律进行推断,下列说法错误的是( )
A.原子半径:S>Cl
B.金属性:Na>Al
C.稳定性:HBr>HCl
D.酸性:H2CO3>H2SiO3
解析:C Br与Cl为同主族元素,且Br在Cl的下方,非金属性:Br<Cl,则稳定性:HBr<HCl,C错误。
2.下列各组化合物中的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
解析:C 元素非金属性越强,其气态氢化物的稳定性越强,非金属性:Cl>S>P,稳定性:HCl>H2S>PH3,C项错误。
3.下列“实验结论”与“实验操作及事实”不相符的一组是( )
实验操作及事实 实验结论
A 绿豆大小的Na和K分别放入水中,K与水反应更强烈 金属性:Na<K
B 分别测定相同浓度盐酸和氢硫酸(H2S溶液)的pH,盐酸的酸性强于氢硫酸 非金属性:Cl>S
C 向盛有Al(OH)3沉淀的两支试管中,分别滴加足量盐酸和NaOH溶液,振荡后,均得到无色溶液 Al(OH)3是两性氢氧化物
D 向KI溶液中滴加氯水,溶液变为棕黄色 氧化性:Cl2>I2
解析:B 盐酸和氢硫酸均为无氧酸,不能由盐酸和氢硫酸的酸性强弱比较Cl和S的非金属性强弱,B错误。
元素金属性、非金属性强弱判断(归纳与论证)
下列实验不能达到实验目的的是( )
序号 实验操作 实验目的
A Cl2、Br2分别与H2反应 比较氯、溴的非金属性强弱
B 向MgCl2、AlCl3溶液中分别通入NH3 比较镁、铝的金属性强弱
C 测定相同物质的量浓度的H2SiO3、H2SO4溶液的pH 比较硅、硫的非金属性强弱
D Fe、Cu分别与稀盐酸反应 比较铁、铜的金属性强弱
解析:B 向MgCl2、AlCl3溶液中分别通入NH3,都能生成白色沉淀,不能比较镁、铝的金属性强弱,B符合题意。
元素金属性、非金属性强弱的比较方法
金属性比较 本质 原子越易失去电子,金属性越强
判断 依据 ①在金属活动性顺序中位置越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强,离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++YX+Ym+,则Y金属性比X强
非金属性比较 本质 原子越易得到电子,非金属性越强
判断 依据 ①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强,阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④An-+BBm-+A,则B非金属性比A强
1.下列关于元素金属性和非金属性强弱比较的说法不正确的是( )
A.根据气态氢化物的热稳定性:HCl>H2S>PH3>SiH4,可得非金属性:Si>P>S>Cl
B.Si与H2化合所需的温度远高于S与H2化合所需的温度,说明S的非金属性强于Si
C.Na与冷水反应剧烈,而Mg与冷水反应缓慢,说明Na的金属性强于Mg
D.铁投入CuSO4溶液中能置换出铜,钠投入 CuSO4溶液中不能置换出铜,不能由此判断钠与铁的金属性强弱
解析:A 气态氢化物的热稳定性越强,元素非金属性越强,气态氢化物的热稳定性:HCl>H2S>PH3>SiH4,可得非金属性:Cl>S>P>Si,A错误。
2.有a、b、c、d四种金属,最高价氧化物对应的水化物的碱性:a>b。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的金属活动性由强到弱的顺序是( )
A.d、c、a、b B.d、a、b、c
C.d、b、a、c D.b、a、d、c
解析:B 最高价氧化物对应的水化物的碱性:a>b,说明a的金属性比b强;将a、d分别投入等浓度的盐酸中,d比a反应剧烈,说明d的金属性比a强;将Cu浸入b的盐溶液里,无明显变化,说明b的金属性比铜强;如果把Cu浸入c的盐溶液里,有c的单质析出,说明Cu的金属性比c强;因此金属活动性由强到弱的顺序是d、a、b、c,B正确。
3.下列能说明氯元素的非金属性比硫元素强的是( )
①HCl比H2S稳定
②S2-的还原性比Cl-的强
③Cl2能与H2S反应生成S
④HCl的溶解度比H2S的大
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
⑥HCl的酸性比H2S的强
A.①②③⑤ B.①②④⑤
C.②③⑤⑥ D.①②③④⑤⑥
解析:A ①HCl比H2S稳定,则非金属性:Cl>S;②阴离子的还原性越强,元素的非金属性越弱,S2-的还原性比Cl-的强,则非金属性:Cl>S;③Cl2能与H2S反应生成S,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:Cl2>S,则非金属性:Cl>S;④溶解度属于物理性质,与元素的非金属性无关,不能确定元素的非金属性强弱;⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,则Cl得电子的能力强,所以非金属性:Cl>S;⑥元素的非金属性越强,最高价氧化物对应水化物的酸性越强,HCl的酸性比H2S的酸性强,不能说明Cl的非金属性比S的强。
元素性质的周期性变化规律
学习目标:
1.结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,建构元素周期律。
2.了解同周期和主族元素性质的递变规律。
分点突破(一) 原子结构的周期性变化
1.原子结构的变化规律
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2 1 1→ 2 2
3~10 2 1→ 8 8
11~18 3 1→ 8 8
结论:随着原子序数的递增,元素原子核外的电子排布呈现 周期性 的变化
2
2
8
8
8
周期性
2.原子半径的周期性变化
规律:随着原子序数的递增,元素的原子半径呈现 由大到小 的周期性变化。
由大到小
3.元素主要化合价的变化规律
原子序数 主要化合价的变化
1~2 +1→0
3~10 +1→ +5 -4 →-1→0
11~18 +1→ +7 -4 →-1→0
结论:随着原子序数的递增,元素的主要化合价呈周期性变化
4.结论:随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现 周期性 的变化。
+5
-4
+7
-4
周期性
1.电子层数多的元素原子半径一定大于电子层数少的元素吗
提示:不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。
2.比较人体中含有的部分元素的原子或其离子半径大小(用“>”或“<”表示)。
(1)Cl Br,S Si Al。
提示:(1)< < <
(2)O2- F- Na+ Mg2+。
提示:(2)> > >
(3)Cl- Cl,Mg Mg2+。
提示:(3)> >
(4)K Mg,S F。
提示:(4)> >
粒子半径的大小比较
1.同周期——“序大径小”
(1)规律:同周期,从左往右,原子半径逐渐减小。
(2)如第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——“序大径大”
(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。
(2)如碱金属:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs),r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
3.同元素
(1)同种元素的原子和离子半径比较——“阴大阳小”。某原子与其离子半径比较,其阴离子半径大于该原子半径。阳离子半径小于该原子半径。如 r(Na+)<r(Na),r(Cl-)>r(Cl)。
(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。如r(Fe3+)<r(Fe2+)<r(Fe)。
4.同结构——“序大径小”
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
(2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
1.下列4种粒子中,半径按由大到小的顺序排列的是( )
① ② ③ ④
A.①>②>③>④ B.③>④>①>②
C.③>①>②>④ D.①>②>④>③
解析:C 由结构示意图可知,①为S,②为Cl,③为S2-,④为F,粒子半径:S2->S>Cl>F,即③>①>②>④,C项正确。
2.下列各组元素中,按从左到右的顺序,原子序数递增,元素的最高正化合价也递增的是( )
A.C、N、O、F B.Na、Be、B、C
C.P、S、Cl、Ar D.Na、Mg、Al、Si
解析:D A项和C项原子序数递增,而A项中F无正价,C项中Ar的化合价为0价;B项中的原子序数不完全呈递增趋势;D项中原子序数和最高正化合价均呈递增趋势。
3.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
解析:C 设该元素的最高正价为x,最低负价为y,
则 解得x=6,y=-2,因此该原子的最外层电子数为6。
分点突破(二) 第三周期元素性质的递变
1.实验1:探究钠、镁金属性的强弱
实验内容 实验现象
Na 将绿豆大小的钠投入水中,滴加2滴酚酞溶液 与冷水发生剧烈反应,有气泡产生,溶液变红
Mg 取一小段镁条,用砂纸除去表面的氧化膜,放入水中,滴加2滴酚酞溶液 与冷水反应缓慢,加热后,有少量气泡产生,溶液变浅红
由上述实验现象可知,钠与水反应比镁与水反应剧烈,即金属性 Na>Mg 。
Na>Mg
2.实验2:探究NaOH、Mg(OH)2、Al(OH)3碱性强弱
实验操作 沉淀溶解情况
Al 沉淀逐渐溶解
沉淀逐渐溶解
实验操作 沉淀溶解情况
Mg 沉淀逐渐溶解
沉淀不溶解
(1)Al(OH)3具有两性,能溶于盐酸和NaOH溶液,试分别写出反应的离子方程式。
提示:Al(OH)3+3H+Al3++3H2O;Al(OH)3+OH- [Al(OH)4]- 。
(2)由上述实验现象得出三种物质的碱性强弱顺序是 。
提示:碱性:NaOH>Mg(OH)2>Al(OH)3
3.探究结论
随着原子序数的递增,同周期的Na、Mg、Al失去电子的能力逐渐 减弱 ,金属性逐渐 减弱 。
减弱
减弱
4.Si、P、S、Cl非金属性强弱的比较
Si P S Cl
判断依据 与氢气化合 高温 磷蒸气与氢气反应 加热 光照或点燃
由易到难的顺序是 Cl、S、P、Si
判断依据 最高价氧化物对应水化物的酸性强弱 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4强酸(酸性比H2SO4强)
酸性:HClO4 > H2SO4 > H3PO4 > H2SiO3
结论
Cl、S、P、Si
>
>
>
5.同周期元素性质递变规律
在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是 (填元素符号,下同)。
提示:(1)Cl
(2)金属性最强的元素是 。
提示:(2)Na
(3)最高价氧化物对应水化物中酸性最强的是 (填化学式,下同)。
提示:(3)HClO4
(4)最不稳定的气态氢化物是 。
提示:(4)SiH4
(5)最高价氧化物对应水化物中碱性最强的是 。
提示:(5)NaOH
(6)氧化物中具有两性的是 。
提示:(6)Al2O3
1. 同周期、同主族元素性质的递变规律
同周期(从左到右,稀有气体除外) 同主族(自上而下)
元素主要化合价 最高价:+1价→+7价(O、F除外);最低价:-4价→-1价;最低价=主族序数-8(H除外) 最高价相同(O、F除外);最低价相同;最高价=族序数(O、F除外)
原子半径 逐渐减小 逐渐增大
金属性 逐渐减弱 逐渐增强
同周期(从左到右,稀有气体除外) 同主族(自上而下)
非金属性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸、碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强
酸性逐渐减弱
形成气态氢化物的难易 由难到易 由易到难
简单气态氢化物的稳定性 逐渐增强 逐渐减弱
2.元素周期律
元素的性质随着原子序数的递增而呈现周期性的变化。其实质是元素原子的核外电子排布呈现周期性变化。
1.依据元素周期律进行推断,下列说法错误的是( )
A.原子半径:S>Cl
B.金属性:Na>Al
C.稳定性:HBr>HCl
D.酸性:H2CO3>H2SiO3
解析:C Br与Cl为同主族元素,且Br在Cl的下方,非金属性:Br<Cl,则稳定性:HBr<HCl,C错误。
2.下列各组化合物中的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
解析:C 元素非金属性越强,其气态氢化物的稳定性越强,非金属性:Cl>S>P,稳定性:HCl>H2S>PH3,C项错误。
3.下列“实验结论”与“实验操作及事实”不相符的一组是( )
实验操作及事实 实验结论
A 绿豆大小的Na和K分别放入水中,K与水反应更强烈 金属性:Na<K
B 分别测定相同浓度盐酸和氢硫酸(H2S溶液)的pH,盐酸的酸性强于氢硫酸 非金属性:Cl>S
C 向盛有Al(OH)3沉淀的两支试管中,分别滴加足量盐酸和NaOH溶液,振荡后,均得到无色溶液 Al(OH)3是两性氢氧化物
D 向KI溶液中滴加氯水,溶液变为棕黄色 氧化性:Cl2>I2
解析:B 盐酸和氢硫酸均为无氧酸,不能由盐酸和氢硫酸的酸性强弱比较Cl和S的非金属性强弱,B错误。
元素金属性、非金属性强弱判断(归纳与论证)
下列实验不能达到实验目的的是( )
序号 实验操作 实验目的
A Cl2、Br2分别与H2反应 比较氯、溴的非金属性强弱
B 向MgCl2、AlCl3溶液中分别通入NH3 比较镁、铝的金属性强弱
C 测定相同物质的量浓度的H2SiO3、H2SO4溶液的pH 比较硅、硫的非金属性强弱
D Fe、Cu分别与稀盐酸反应 比较铁、铜的金属性强弱
解析:B 向MgCl2、AlCl3溶液中分别通入NH3,都能生成白色沉淀,不能比较镁、铝的金属性强弱,B符合题意。
元素金属性、非金属性强弱的比较方法
金属性比较 本质 原子越易失去电子,金属性越强
判断 依据 ①在金属活动性顺序中位置越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强,离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++YX+Ym+,则Y金属性比X强
非金属性比较 本质 原子越易得到电子,非金属性越强
判断 依据 ①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强,阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④An-+BBm-+A,则B非金属性比A强
1.下列关于元素金属性和非金属性强弱比较的说法不正确的是( )
A.根据气态氢化物的热稳定性:HCl>H2S>PH3>SiH4,可得非金属性:Si>P>S>Cl
B.Si与H2化合所需的温度远高于S与H2化合所需的温度,说明S的非金属性强于Si
C.Na与冷水反应剧烈,而Mg与冷水反应缓慢,说明Na的金属性强于Mg
D.铁投入CuSO4溶液中能置换出铜,钠投入 CuSO4溶液中不能置换出铜,不能由此判断钠与铁的金属性强弱
解析:A 气态氢化物的热稳定性越强,元素非金属性越强,气态氢化物的热稳定性:HCl>H2S>PH3>SiH4,可得非金属性:Cl>S>P>Si,A错误。
2.有a、b、c、d四种金属,最高价氧化物对应的水化物的碱性:a>b。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的金属活动性由强到弱的顺序是( )
A.d、c、a、b B.d、a、b、c
C.d、b、a、c D.b、a、d、c
解析:B 最高价氧化物对应的水化物的碱性:a>b,说明a的金属性比b强;将a、d分别投入等浓度的盐酸中,d比a反应剧烈,说明d的金属性比a强;将Cu浸入b的盐溶液里,无明显变化,说明b的金属性比铜强;如果把Cu浸入c的盐溶液里,有c的单质析出,说明Cu的金属性比c强;因此金属活动性由强到弱的顺序是d、a、b、c,B正确。
3.下列能说明氯元素的非金属性比硫元素强的是( )
①HCl比H2S稳定
②S2-的还原性比Cl-的强
③Cl2能与H2S反应生成S
④HCl的溶解度比H2S的大
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
⑥HCl的酸性比H2S的强
A.①②③⑤ B.①②④⑤
C.②③⑤⑥ D.①②③④⑤⑥
解析:A ①HCl比H2S稳定,则非金属性:Cl>S;②阴离子的还原性越强,元素的非金属性越弱,S2-的还原性比Cl-的强,则非金属性:Cl>S;③Cl2能与H2S反应生成S,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:Cl2>S,则非金属性:Cl>S;④溶解度属于物理性质,与元素的非金属性无关,不能确定元素的非金属性强弱;⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,则Cl得电子的能力强,所以非金属性:Cl>S;⑥元素的非金属性越强,最高价氧化物对应水化物的酸性越强,HCl的酸性比H2S的酸性强,不能说明Cl的非金属性比S的强。
