4.1.1原子结构课件(共25张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1原子结构课件(共25张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 363.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 10:12:17 | ||
图片预览







文档简介
(共25张PPT)
原子结构
学习目标:
1.认识原子结构,能画出1~20号元素的原子结构示意图。
2.了解原子核外电子的排布,并能运用核外电子排布规律解释或推测物质的组成、结构与性质。
分点突破(一) 原子结构
1.原子构成
(1)原子
原子
(2)关系:核电荷数= 质子数 =核外电子数(原子呈电中性)
质子数
2.质量数
(1)概念
原子的质量主要集中在 原子核 上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有 质子 和 中子 的相对质量取近似整数值相加,所得的数值叫做质量数。
(2)关系:质量数(A)= 质子数 (Z)+ 中子数 (N)。
原子核
质子
中子
质子数
中子数
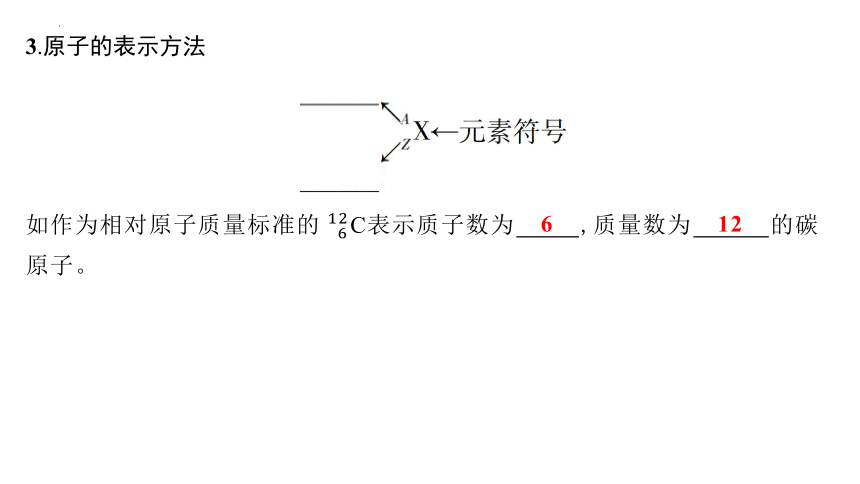
3.原子的表示方法
如作为相对原子质量标准的C表示质子数为 6 ,质量数为 12 的碳原子。
6
12
1.联合国宣布2019年为“国际化学元素周期表年”,我国的刘庄教授为汞元素的代言人Hg原子的质子数为 ,质量数为 ,中子数为 ,核外电子数为 。
提示:80 198 118 80
2.原子的质量主要由原子核决定。已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为 。
提示:A-X-n
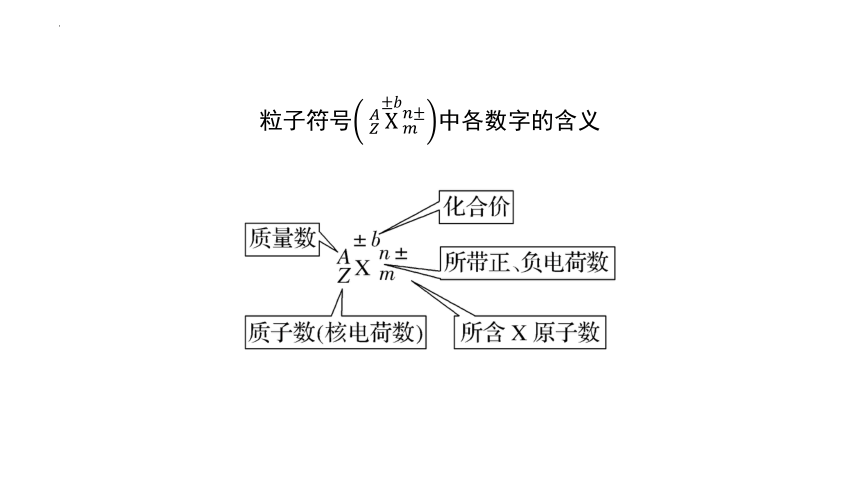
粒子符号中各数字的含义
1.嫦娥五号首次实现在月球上动态展示五星红旗,并带着“月壤”从地外天体起飞返回地球。旗开月表,五星闪耀。
“月壤”中含有He(质量数为3),该原子的中子数是( )
A.1 B.2
C.3 D.5
解析:AHe中质量数为3,质子数为2,则He的中子数是1。
2.U常用于核裂变反应。下列关于U的叙述正确的是( )
A.质子数为235
B.核外电子数为143
C.核电荷数为235
D.中子数为143
解析:D U质子数为92,核外电子数=质子数=核电荷数,中子数为235-92=143,选D。
3.某+2价阳离子含24个电子,它的质量数为56,则该离子核内中子数是( )
A.24 B.30
C.32 D.34
解析:B 该元素原子核外电子数为24+2=26,即质子数为26,故该离子核内中子数为56-26=30。
分点突破(二) 原子核外电子的排布规律
1.电子层
(1)概念
在含有多个电子的原子里,电子分别在 能量 不同的区域内运动。我们把不同的区域简化为不连续的壳层,称作电子层。
(2)不同电子层的表示方式及能量关系
电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远
能量高低 由 低 到 高
能量
低
高
2.电子层排布
(1)能量最低原理
原子中的电子是处在原子核的引力场中,电子一般总是先从能量 较低 的内层排起,当一层充满后再填充能量 较高 的下一层。
(2)电子层最多容纳的电子数
a.原子核外第n层最多能容纳的电子数为 2n2 。
b.无论原子有几个电子层,其最外层中的电子数最多只有 8 个(K层只有 2 个)。
c.次外层最多能容纳的电子数不超过 18 个。
(3)原子最外电子层有 8 个电子(最外层为K层时,最多只有 2 个电子)的结构是相对稳定的结构。
较低
较高
2n2
8
2
18
8
2
3.粒子结构表示方法
(1)原子(或离子)结构的表示方法,如图所示:
(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者不相等,如
Na+ ;Cl- 。
阳离子:核外电子数小于核内质子数。
阴离子:核外电子数大于核内质子数。
在练习本上依次画出1~18号元素的原子结构示意图,分析总结它们的核外电子排布特点(填元素符号):
(1)最外层电子数为1的原子有 ;最外层电子数为2的原子有 。
答案:(1)H、Li、Na He、Be、Mg
(2)最外层电子数与次外层电子数相等的原子有 。
答案:(2)Be、Ar
(3)最外层电子数是次外层电子数2倍的原子有 ,3倍的原子有 。
答案:(3)C O
(4)次外层电子数是最外层电子数2倍的原子有 。
答案:(4)Li、Si
(5)电子层数与最外层电子数相等的原子有 。
答案:(5)H、Be、Al
(6)最外层电子数是电子层数2倍的原子有 。
答案:(6)He、C、S
1.核外电子排布的规律是互相联系的,不能孤立地理解。如钙原子由于受最外层电子数不超过8个的限制,其原子结构示意图为 而不应该是 。
2.通常把最外层有8个电子(最外层为K层时,只有2个电子)的结构,称为相对稳定结构。稀有气体的原子就是上述结构,一般不与其他物质发生化学反应。当元素的原子最外层电子数小于8(K层小于2)时是不稳定结构。在化学反应中,不稳定结构总是通过各种方式(如得失电子、共用电子等)趋向达到相对稳定结构。
1.下列有关原子核外电子排布的说法错误的是( )
A.电子总是优先排布在能量最低的电子层里
B.每个电子层最多能容纳的电子数为2n2
C.最外层电子数不超过8个(K层为最外层时不超过2个)
D.S2-的M层有6个电子
解析:D S2-的M层有8个电子,D错误。
2.某元素原子的最外层电子数是次外层的m倍(m为大于1的整数),则该原子的核外电子总数为( )
A.2m B.2m+10
C.2m+2 D.m+2
解析:C 按照原子核外电子排布的一般规律,最外层电子数不超过8。最外层电子数是次外层的m倍(m为大于1的整数),所以次外层电子数小于8,即次外层只能为K层,电子数为2,最外层电子数是2m,则该原子的核外电子总数为2m+2,C正确。
3.两种元素原子X和Y,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰好是X原子L层电子数的两倍,则X、Y分别是( )
A.硅原子和钠原子 B.硼原子和氮原子
C.氮原子和碳原子 D.碳原子和铝原子
解析:D 由于Y原子的M层电子比X原子的M层电子多3个电子,说明Y的M层电子数至少有3个,那么Y的L层必定有8个电子;Y原子的L层电子数恰好是X原子L层电子数的两倍,则X的L层只有4个电子,M层无电子。由此推出Y的核外电子总数为13,X的核外电子总数为6;所以X、Y的核电荷数分别是6和13,即为碳原子和铝原子。
1.Sr(Sr,中文名“锶”)是一种放射性同位素核电池的能量来源。下列关于Sr的说法中,不正确的是( )
A.质子数为38 B.核外电子数为90
C.中子数为52 D.质量数为90
解析:B 由原子组成表示可知Sr的质子数为38,质量数为90,核外电子数等于质子数也为38,中子数=质量数-质子数=90-38=52,A、C、D正确,B错误。
2.某粒子的结构示意图为 ,下列关于该粒子的说法正确的是( )
A.该粒子为阳离子 B.最外层电子数为2
C.核外电子数为8 D.核外有3个电子层
解析:D 该粒子为Cl-,核外电子数为18,最外层电子数为8。
3.下列说法中一定错误的是( )
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某原子的核电荷数与最外层电子数相等
解析:B K、L、M电子层上最多容纳的电子数分别为2、8、18。K层上可排1个电子,也可排2个电子,A项不符合题意;当M层上排有电子时,L层上一定排满了8个电子,而M层上最多只能排18个电子,B项符合题意;K层上最多只能排2个电子,2×4=8,即存在M层和L层都为8个电子的离子 ,K+、Ca2+等均有可能,C项不符合题意;H、He的核电荷数分别与它们的最外层电子数相等,D项不符合题意。
4.在1~18号元素中,最外层电子数是其电子层数3倍的元素共有( )
A.1种 B.2种
C.3种 D.4种
解析:A 前18号元素中,电子层数只能为1、2、3,最外层电子数不能超过8个(K层作最外层不能超过2个),符合题意的元素只有氧元素,选A。
5.根据下列叙述,画出对应粒子的结构示意图。
(1)最外层电子数为电子层数4倍的元素原子: 。
解析:(1)根据核外电子排布规律可知,原子的最外层电子数不超过8,元素原子的最外层电子数为电子层数的4倍,则只能是Ne。
答案:(1)
(2)与Ar原子电子层结构相同的-1价阴离子: 。
解析:(2)与Ar原子的电子层结构相同的-1价阴离子为Cl-。
答案:(2)
答案:(3)
(3)质量数为23、中子数为12的原子: 。
解析:(3)质量数为23、中子数为12的原子,质子数为23-12=11,即为Na原子。
原子结构
学习目标:
1.认识原子结构,能画出1~20号元素的原子结构示意图。
2.了解原子核外电子的排布,并能运用核外电子排布规律解释或推测物质的组成、结构与性质。
分点突破(一) 原子结构
1.原子构成
(1)原子
原子
(2)关系:核电荷数= 质子数 =核外电子数(原子呈电中性)
质子数
2.质量数
(1)概念
原子的质量主要集中在 原子核 上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有 质子 和 中子 的相对质量取近似整数值相加,所得的数值叫做质量数。
(2)关系:质量数(A)= 质子数 (Z)+ 中子数 (N)。
原子核
质子
中子
质子数
中子数
3.原子的表示方法
如作为相对原子质量标准的C表示质子数为 6 ,质量数为 12 的碳原子。
6
12
1.联合国宣布2019年为“国际化学元素周期表年”,我国的刘庄教授为汞元素的代言人Hg原子的质子数为 ,质量数为 ,中子数为 ,核外电子数为 。
提示:80 198 118 80
2.原子的质量主要由原子核决定。已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为 。
提示:A-X-n
粒子符号中各数字的含义
1.嫦娥五号首次实现在月球上动态展示五星红旗,并带着“月壤”从地外天体起飞返回地球。旗开月表,五星闪耀。
“月壤”中含有He(质量数为3),该原子的中子数是( )
A.1 B.2
C.3 D.5
解析:AHe中质量数为3,质子数为2,则He的中子数是1。
2.U常用于核裂变反应。下列关于U的叙述正确的是( )
A.质子数为235
B.核外电子数为143
C.核电荷数为235
D.中子数为143
解析:D U质子数为92,核外电子数=质子数=核电荷数,中子数为235-92=143,选D。
3.某+2价阳离子含24个电子,它的质量数为56,则该离子核内中子数是( )
A.24 B.30
C.32 D.34
解析:B 该元素原子核外电子数为24+2=26,即质子数为26,故该离子核内中子数为56-26=30。
分点突破(二) 原子核外电子的排布规律
1.电子层
(1)概念
在含有多个电子的原子里,电子分别在 能量 不同的区域内运动。我们把不同的区域简化为不连续的壳层,称作电子层。
(2)不同电子层的表示方式及能量关系
电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远
能量高低 由 低 到 高
能量
低
高
2.电子层排布
(1)能量最低原理
原子中的电子是处在原子核的引力场中,电子一般总是先从能量 较低 的内层排起,当一层充满后再填充能量 较高 的下一层。
(2)电子层最多容纳的电子数
a.原子核外第n层最多能容纳的电子数为 2n2 。
b.无论原子有几个电子层,其最外层中的电子数最多只有 8 个(K层只有 2 个)。
c.次外层最多能容纳的电子数不超过 18 个。
(3)原子最外电子层有 8 个电子(最外层为K层时,最多只有 2 个电子)的结构是相对稳定的结构。
较低
较高
2n2
8
2
18
8
2
3.粒子结构表示方法
(1)原子(或离子)结构的表示方法,如图所示:
(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者不相等,如
Na+ ;Cl- 。
阳离子:核外电子数小于核内质子数。
阴离子:核外电子数大于核内质子数。
在练习本上依次画出1~18号元素的原子结构示意图,分析总结它们的核外电子排布特点(填元素符号):
(1)最外层电子数为1的原子有 ;最外层电子数为2的原子有 。
答案:(1)H、Li、Na He、Be、Mg
(2)最外层电子数与次外层电子数相等的原子有 。
答案:(2)Be、Ar
(3)最外层电子数是次外层电子数2倍的原子有 ,3倍的原子有 。
答案:(3)C O
(4)次外层电子数是最外层电子数2倍的原子有 。
答案:(4)Li、Si
(5)电子层数与最外层电子数相等的原子有 。
答案:(5)H、Be、Al
(6)最外层电子数是电子层数2倍的原子有 。
答案:(6)He、C、S
1.核外电子排布的规律是互相联系的,不能孤立地理解。如钙原子由于受最外层电子数不超过8个的限制,其原子结构示意图为 而不应该是 。
2.通常把最外层有8个电子(最外层为K层时,只有2个电子)的结构,称为相对稳定结构。稀有气体的原子就是上述结构,一般不与其他物质发生化学反应。当元素的原子最外层电子数小于8(K层小于2)时是不稳定结构。在化学反应中,不稳定结构总是通过各种方式(如得失电子、共用电子等)趋向达到相对稳定结构。
1.下列有关原子核外电子排布的说法错误的是( )
A.电子总是优先排布在能量最低的电子层里
B.每个电子层最多能容纳的电子数为2n2
C.最外层电子数不超过8个(K层为最外层时不超过2个)
D.S2-的M层有6个电子
解析:D S2-的M层有8个电子,D错误。
2.某元素原子的最外层电子数是次外层的m倍(m为大于1的整数),则该原子的核外电子总数为( )
A.2m B.2m+10
C.2m+2 D.m+2
解析:C 按照原子核外电子排布的一般规律,最外层电子数不超过8。最外层电子数是次外层的m倍(m为大于1的整数),所以次外层电子数小于8,即次外层只能为K层,电子数为2,最外层电子数是2m,则该原子的核外电子总数为2m+2,C正确。
3.两种元素原子X和Y,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰好是X原子L层电子数的两倍,则X、Y分别是( )
A.硅原子和钠原子 B.硼原子和氮原子
C.氮原子和碳原子 D.碳原子和铝原子
解析:D 由于Y原子的M层电子比X原子的M层电子多3个电子,说明Y的M层电子数至少有3个,那么Y的L层必定有8个电子;Y原子的L层电子数恰好是X原子L层电子数的两倍,则X的L层只有4个电子,M层无电子。由此推出Y的核外电子总数为13,X的核外电子总数为6;所以X、Y的核电荷数分别是6和13,即为碳原子和铝原子。
1.Sr(Sr,中文名“锶”)是一种放射性同位素核电池的能量来源。下列关于Sr的说法中,不正确的是( )
A.质子数为38 B.核外电子数为90
C.中子数为52 D.质量数为90
解析:B 由原子组成表示可知Sr的质子数为38,质量数为90,核外电子数等于质子数也为38,中子数=质量数-质子数=90-38=52,A、C、D正确,B错误。
2.某粒子的结构示意图为 ,下列关于该粒子的说法正确的是( )
A.该粒子为阳离子 B.最外层电子数为2
C.核外电子数为8 D.核外有3个电子层
解析:D 该粒子为Cl-,核外电子数为18,最外层电子数为8。
3.下列说法中一定错误的是( )
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某原子的核电荷数与最外层电子数相等
解析:B K、L、M电子层上最多容纳的电子数分别为2、8、18。K层上可排1个电子,也可排2个电子,A项不符合题意;当M层上排有电子时,L层上一定排满了8个电子,而M层上最多只能排18个电子,B项符合题意;K层上最多只能排2个电子,2×4=8,即存在M层和L层都为8个电子的离子 ,K+、Ca2+等均有可能,C项不符合题意;H、He的核电荷数分别与它们的最外层电子数相等,D项不符合题意。
4.在1~18号元素中,最外层电子数是其电子层数3倍的元素共有( )
A.1种 B.2种
C.3种 D.4种
解析:A 前18号元素中,电子层数只能为1、2、3,最外层电子数不能超过8个(K层作最外层不能超过2个),符合题意的元素只有氧元素,选A。
5.根据下列叙述,画出对应粒子的结构示意图。
(1)最外层电子数为电子层数4倍的元素原子: 。
解析:(1)根据核外电子排布规律可知,原子的最外层电子数不超过8,元素原子的最外层电子数为电子层数的4倍,则只能是Ne。
答案:(1)
(2)与Ar原子电子层结构相同的-1价阴离子: 。
解析:(2)与Ar原子的电子层结构相同的-1价阴离子为Cl-。
答案:(2)
答案:(3)
(3)质量数为23、中子数为12的原子: 。
解析:(3)质量数为23、中子数为12的原子,质子数为23-12=11,即为Na原子。
