1.3.1 烷烃及其性质、烯烃和炔烃及其性质(共26张PPT)-2023-2024学年高二化学鲁科版选择性必修第三册课件
文档属性
| 名称 | 1.3.1 烷烃及其性质、烯烃和炔烃及其性质(共26张PPT)-2023-2024学年高二化学鲁科版选择性必修第三册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 469.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 12:09:30 | ||
图片预览







文档简介
(共26张PPT)
第1章 有机化合物的结构与性质 烃
1.3.1 烷烃及其性质、
烯烃和炔烃及其性质
烃是一类重要的化工原料,生活中许多物品如塑料水杯、汽车轮胎等都是以各种各样的烃为主要原料制得的。那么,烃为什么会有如此重要的作用呢 这些重要的作用与它们的哪些性质有关呢
1.烷烃的类别和存在:
类别:是一种饱和烷烃,属于脂肪烃。
存在:苹果表面——二十七烷
圆白菜叶子——二十九烷
石蜡和凡士林——20个以上碳原子的烷烃
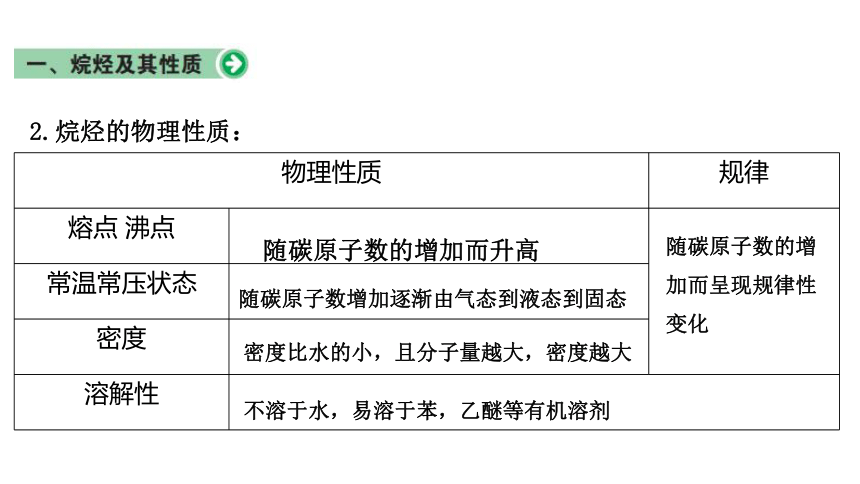
2.烷烃的物理性质:
物理性质 规律
熔点 沸点
常温常压状态
密度
溶解性
随碳原子数的增加而升高
随碳原子数增加逐渐由气态到液态到固态
密度比水的小,且分子量越大,密度越大
不溶于水,易溶于苯,乙醚等有机溶剂
随碳原子数的增加而呈现规律性变化
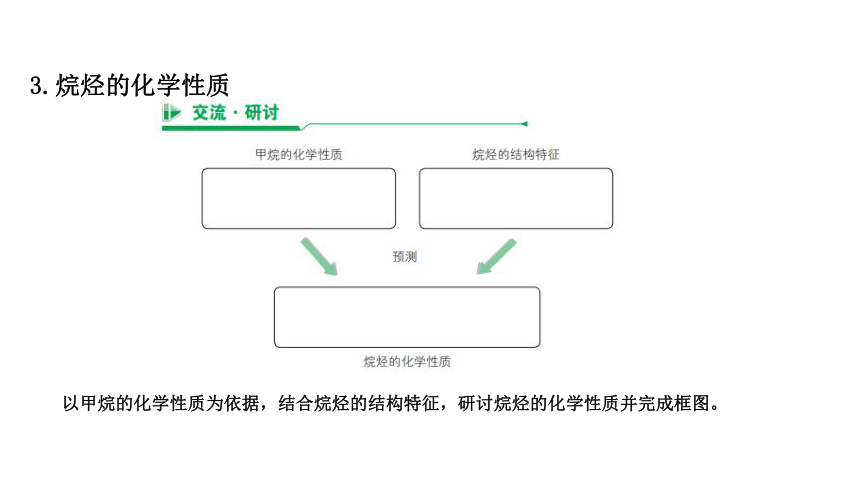
3.烷烃的化学性质
以甲烷的化学性质为依据,结合烷烃的结构特征,研讨烷烃的化学性质并完成框图。
⑴烷烃的稳定性
常温下,烷烃很不活泼,与强酸、强碱、强氧化剂和还原剂等都不发生反应,只有在特定条件(如光照或高温)下才发生某些化学反应,这与构成烷烃分子的碳氢键和碳碳单键的键能较高有关。
⑵取代反应
CH3CH3+Cl2→CH3CH2Cl+HCl
hv
烷烃在光照条件下可与卤素单质发生取代反应。
CnH2n+2 + O2 nCO2 + (n+1)H2O
点燃
⑶氧化反应
烷烃的燃烧通式:
【名师提醒】
1.相同状况下,等质量的烷烃,含氢元素的质量分数越大,燃烧时消耗氧气的物质的量越多;
2.在光照条件下,烷烃只能与卤素单质发生取代反应,不能与卤素单质的水溶液反应;
3.烷烃与卤素单质的取代反应是逐步进行的,不会停留在第一步。故一卤代烷不能用烷烃与卤素单质反应来制取。
【练习】1、在光照下,将等物质的量的CH3CH3和Cl2充分反应,得到产物的物质的量最多的是( )
A、CH3CH2Cl B、CH2ClCH2Cl
C、HCl D、CCl3CCl3
2、取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是( )
A、C2H2和C2H6 B、CH4和C3H8
C、C3H6和C3H8 D、C2H4和C4H8
C
D
自然界存在许多烯烃,如番茄中的番茄红素,鲨鱼油中的角鲨烷都是烯烃。乙炔是常见的炔烃。
1.烯烃和炔烃的组成通式:
类别 单烯烃 单炔烃
组成通式
CnH2n(n≥2)
CnH2n-2(n≥2)
2.烯烃、炔烃的命名:基本与烷烃的相似。
不同的是:
⑴选主链:要选含官能团在内的最长碳链为主链。
⑵定位时:要先从离官能团最近一端开始编号。
⑶命名时:必须要同时指出官能团位置。
【练习】1、命名下列烯烃或炔烃
⑶CH3—CH—CH2—C=CH2
CH3
CH3
CH2CH3
CH3
CH3
⑴CH3—CH=C—CH2—CH3 ⑵CH2=CH—CH—CH—CH3
3—甲基—2—戊烯
2,4—二甲基—1—戊烯
2—甲基— 3—乙基— 1—己烯
⑷CH3—CH2—CH—CH—CH2—CH3
C
CH
CH3
2.下列有机物的名称肯定错误的是( )
A.2-甲基-1-丁烯 B.2,2-二甲基丙烷
C.5,5-二甲基-3-己烯 D.4-甲基-2-戊炔
C
4—甲基—3—乙基—1—己炔
物理性质 规律
熔点 沸点
常温常压状态
密度
溶解性
随碳原子数的增加而升高
随碳原子数增加逐渐由气态到液态到固态
密度比水的小,且分子量越大,密度越大
不溶于水,易溶于有机溶剂
随碳原子数的增加而呈现规律性变化
3.烯烃、炔烃的物理性质:
【发散思维】
1、乙烯的化学性质表现在哪几个方面?
2 、根据你的判断,烯烃可能具有哪些化学性质?
3、乙烯和乙炔在结构上有何相同点?对它们的性质有何影响?
4、乙炔可能具有什么样的化学性质?炔烃呢?
4.烯烃、炔烃的化学性质:
乙炔与溴的四氯化碳溶液、酸性KMnO,溶液的反应
【实验1】将净化后的乙炔通入盛有溴的四氯化碳溶液的试管中,观察试管中溶液颜色的变化。
【实验2】将净化后的乙炔通入盛有酸性KMnO。溶液的试管中,观察试管中溶液颜色的变化。
实验序号 实验现象 实验结论
烯烃、炔烃分子都含有不饱和键,具有相似的化学性质。
⑴加成反应
①与 X2(条件:水溶液或CCl4溶液)
现象:
溴水退色,溶液分层,两层均无色
溴的CCl4溶液退色。
1,2—二溴丙烷
1,2—二溴乙烯
1,1,2,2—四溴乙烷
【应用】烯烃与烷烃或炔烃与烷烃的鉴别。
②与 H2(条件:催化剂)
有关方程式:
应用: 。例如,工业上利用_____________________ 制备氯乙烯
氯乙烯
工业上获得卤代烃
乙炔和HCl的加成反应
③与氢卤酸:例与HCl(条件:催化剂、加热)
△
△
△
④与水:(条件催化剂、加热、加压)
催化剂
加热、加压
H OH
C C
C C
+ H—OH
【练习】请书写丙炔、2-丁烯分别与溴单质、氢气、HBr加成反应的化学方程式。
⑤加成聚合反应(简称 加聚反应 )条件: 一定条件
【注意】:聚乙炔在掺杂状态下具有较高的电导率。
【举一反三】
①乙烯和丙烯1:1加聚的方程式怎么写?
②制备聚1,3-丁二烯的方程式怎么写?
nCH3CH=CH2 [ CH-CH2] n
一定条件
nHC CH [CH=CH] n
一定条件
CH3
nCO2 + (n-1)H2O
⑵氧化反应
①可燃性
KMnO4/H+
KMnO4/H+
CH2 = CH2 CO2↑ CH ≡ CH CO2↑
CnH2n + O2
点燃
nCO2 + nH2O
CnH2n-2 + O2
点燃
②与酸性KMnO4的反应。现象 。
3n
2
(3n-1)
2
【发散思维】
1.怎样鉴别乙烷中混有乙烯?
2.怎样除去乙烷中的乙烯?
酸性高锰酸钾溶液或溴水或溴的四氯化碳溶液均可。
溴水或溴的四氯化碳溶液
【名师提醒】注意区分“鉴别”和“除杂”,第2小题常见的错误答案有酸性高锰酸钾(生成二氧化碳,引入新杂质),通氢气(过量氢气成为新杂质)。
烃的性质
烷烃的化学性质
烯烃和炔烃的化学性质
与卤素单质的取代反应
氧化反应:燃烧
和卤素单质,卤化氢,氢气,水等的加成反应
氧化反应:燃烧,高锰酸钾褪色
【课堂小结】
【学以致用】
1.2—甲基丁烷和氯气发生取代反应,得到的一氯代物共有( )
A.3种 B.4种 C.5种 D.6种
2.关于烷烃性质的叙述,错误的是( )
都能使酸性高锰酸钾溶液褪色
B.都能燃烧
C.通常情况下跟酸、碱和氧化剂都不反应
D.都能发生取代反应
B
A
【学以致用】
3.制取氯乙烷最合理的方法是( )
A.乙烷与Cl2取代 B.乙烯与Cl2加成
C.乙烯与HCl加成 D.把乙烯通入盐酸中
4. 质量相同的烷烃和烯烃完全燃烧所需O2的质量( )
A.前者大于后者 B.前者小于后者
C.前者等于后者 D.不能肯定
C
A
第1章 有机化合物的结构与性质 烃
1.3.1 烷烃及其性质、
烯烃和炔烃及其性质
烃是一类重要的化工原料,生活中许多物品如塑料水杯、汽车轮胎等都是以各种各样的烃为主要原料制得的。那么,烃为什么会有如此重要的作用呢 这些重要的作用与它们的哪些性质有关呢
1.烷烃的类别和存在:
类别:是一种饱和烷烃,属于脂肪烃。
存在:苹果表面——二十七烷
圆白菜叶子——二十九烷
石蜡和凡士林——20个以上碳原子的烷烃
2.烷烃的物理性质:
物理性质 规律
熔点 沸点
常温常压状态
密度
溶解性
随碳原子数的增加而升高
随碳原子数增加逐渐由气态到液态到固态
密度比水的小,且分子量越大,密度越大
不溶于水,易溶于苯,乙醚等有机溶剂
随碳原子数的增加而呈现规律性变化
3.烷烃的化学性质
以甲烷的化学性质为依据,结合烷烃的结构特征,研讨烷烃的化学性质并完成框图。
⑴烷烃的稳定性
常温下,烷烃很不活泼,与强酸、强碱、强氧化剂和还原剂等都不发生反应,只有在特定条件(如光照或高温)下才发生某些化学反应,这与构成烷烃分子的碳氢键和碳碳单键的键能较高有关。
⑵取代反应
CH3CH3+Cl2→CH3CH2Cl+HCl
hv
烷烃在光照条件下可与卤素单质发生取代反应。
CnH2n+2 + O2 nCO2 + (n+1)H2O
点燃
⑶氧化反应
烷烃的燃烧通式:
【名师提醒】
1.相同状况下,等质量的烷烃,含氢元素的质量分数越大,燃烧时消耗氧气的物质的量越多;
2.在光照条件下,烷烃只能与卤素单质发生取代反应,不能与卤素单质的水溶液反应;
3.烷烃与卤素单质的取代反应是逐步进行的,不会停留在第一步。故一卤代烷不能用烷烃与卤素单质反应来制取。
【练习】1、在光照下,将等物质的量的CH3CH3和Cl2充分反应,得到产物的物质的量最多的是( )
A、CH3CH2Cl B、CH2ClCH2Cl
C、HCl D、CCl3CCl3
2、取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是( )
A、C2H2和C2H6 B、CH4和C3H8
C、C3H6和C3H8 D、C2H4和C4H8
C
D
自然界存在许多烯烃,如番茄中的番茄红素,鲨鱼油中的角鲨烷都是烯烃。乙炔是常见的炔烃。
1.烯烃和炔烃的组成通式:
类别 单烯烃 单炔烃
组成通式
CnH2n(n≥2)
CnH2n-2(n≥2)
2.烯烃、炔烃的命名:基本与烷烃的相似。
不同的是:
⑴选主链:要选含官能团在内的最长碳链为主链。
⑵定位时:要先从离官能团最近一端开始编号。
⑶命名时:必须要同时指出官能团位置。
【练习】1、命名下列烯烃或炔烃
⑶CH3—CH—CH2—C=CH2
CH3
CH3
CH2CH3
CH3
CH3
⑴CH3—CH=C—CH2—CH3 ⑵CH2=CH—CH—CH—CH3
3—甲基—2—戊烯
2,4—二甲基—1—戊烯
2—甲基— 3—乙基— 1—己烯
⑷CH3—CH2—CH—CH—CH2—CH3
C
CH
CH3
2.下列有机物的名称肯定错误的是( )
A.2-甲基-1-丁烯 B.2,2-二甲基丙烷
C.5,5-二甲基-3-己烯 D.4-甲基-2-戊炔
C
4—甲基—3—乙基—1—己炔
物理性质 规律
熔点 沸点
常温常压状态
密度
溶解性
随碳原子数的增加而升高
随碳原子数增加逐渐由气态到液态到固态
密度比水的小,且分子量越大,密度越大
不溶于水,易溶于有机溶剂
随碳原子数的增加而呈现规律性变化
3.烯烃、炔烃的物理性质:
【发散思维】
1、乙烯的化学性质表现在哪几个方面?
2 、根据你的判断,烯烃可能具有哪些化学性质?
3、乙烯和乙炔在结构上有何相同点?对它们的性质有何影响?
4、乙炔可能具有什么样的化学性质?炔烃呢?
4.烯烃、炔烃的化学性质:
乙炔与溴的四氯化碳溶液、酸性KMnO,溶液的反应
【实验1】将净化后的乙炔通入盛有溴的四氯化碳溶液的试管中,观察试管中溶液颜色的变化。
【实验2】将净化后的乙炔通入盛有酸性KMnO。溶液的试管中,观察试管中溶液颜色的变化。
实验序号 实验现象 实验结论
烯烃、炔烃分子都含有不饱和键,具有相似的化学性质。
⑴加成反应
①与 X2(条件:水溶液或CCl4溶液)
现象:
溴水退色,溶液分层,两层均无色
溴的CCl4溶液退色。
1,2—二溴丙烷
1,2—二溴乙烯
1,1,2,2—四溴乙烷
【应用】烯烃与烷烃或炔烃与烷烃的鉴别。
②与 H2(条件:催化剂)
有关方程式:
应用: 。例如,工业上利用_____________________ 制备氯乙烯
氯乙烯
工业上获得卤代烃
乙炔和HCl的加成反应
③与氢卤酸:例与HCl(条件:催化剂、加热)
△
△
△
④与水:(条件催化剂、加热、加压)
催化剂
加热、加压
H OH
C C
C C
+ H—OH
【练习】请书写丙炔、2-丁烯分别与溴单质、氢气、HBr加成反应的化学方程式。
⑤加成聚合反应(简称 加聚反应 )条件: 一定条件
【注意】:聚乙炔在掺杂状态下具有较高的电导率。
【举一反三】
①乙烯和丙烯1:1加聚的方程式怎么写?
②制备聚1,3-丁二烯的方程式怎么写?
nCH3CH=CH2 [ CH-CH2] n
一定条件
nHC CH [CH=CH] n
一定条件
CH3
nCO2 + (n-1)H2O
⑵氧化反应
①可燃性
KMnO4/H+
KMnO4/H+
CH2 = CH2 CO2↑ CH ≡ CH CO2↑
CnH2n + O2
点燃
nCO2 + nH2O
CnH2n-2 + O2
点燃
②与酸性KMnO4的反应。现象 。
3n
2
(3n-1)
2
【发散思维】
1.怎样鉴别乙烷中混有乙烯?
2.怎样除去乙烷中的乙烯?
酸性高锰酸钾溶液或溴水或溴的四氯化碳溶液均可。
溴水或溴的四氯化碳溶液
【名师提醒】注意区分“鉴别”和“除杂”,第2小题常见的错误答案有酸性高锰酸钾(生成二氧化碳,引入新杂质),通氢气(过量氢气成为新杂质)。
烃的性质
烷烃的化学性质
烯烃和炔烃的化学性质
与卤素单质的取代反应
氧化反应:燃烧
和卤素单质,卤化氢,氢气,水等的加成反应
氧化反应:燃烧,高锰酸钾褪色
【课堂小结】
【学以致用】
1.2—甲基丁烷和氯气发生取代反应,得到的一氯代物共有( )
A.3种 B.4种 C.5种 D.6种
2.关于烷烃性质的叙述,错误的是( )
都能使酸性高锰酸钾溶液褪色
B.都能燃烧
C.通常情况下跟酸、碱和氧化剂都不反应
D.都能发生取代反应
B
A
【学以致用】
3.制取氯乙烷最合理的方法是( )
A.乙烷与Cl2取代 B.乙烯与Cl2加成
C.乙烯与HCl加成 D.把乙烯通入盐酸中
4. 质量相同的烷烃和烯烃完全燃烧所需O2的质量( )
A.前者大于后者 B.前者小于后者
C.前者等于后者 D.不能肯定
C
A
