2.2.1 醇概述 醇的化学性质(共22张PPT)-2023-2024学年高二化学鲁科版选择性必修第三册课件
文档属性
| 名称 | 2.2.1 醇概述 醇的化学性质(共22张PPT)-2023-2024学年高二化学鲁科版选择性必修第三册课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 12:13:02 | ||
图片预览





文档简介
(共22张PPT)
第二节 醇和酚
第1课时 醇概述 醇的化学性质
知识回顾
1.加成反应
2.取代反应
3.消去反应
4.氧化反应
还原反应
增加氧原子或减少氢原子的反应
增加氢原子或减少氧原子的反应
在一定条件下,有机化合物脱去小分子物质生成分子中有不饱和键的有机化合物的反应
有机化合物分子中的某个(或某些)原子或原子团被其他原子或原子团代替的反应。
有机化合物分子中不饱和键两端的两个原子与其他原子或原子团结合,生成新的有机化合物的反应。
联想质疑
醇和酚都是重要的有机化合物。例如,常用作燃料和饮料的酒精(乙醇)、汽车发动机防冻液中的乙二醇、化妆品中的丙三醇含有醇羟基,茶叶中的茶多酚、用于制药皂的苯酚、漆器上涂的漆酚含有酚羟基。
一位著名的有机化学家曾说过,假如让一个有机化学家带上10 种有机化合物到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的有机化合物。那么,在有机化合物的合成中醇为什么会有如此重要的作用?
酚也是一种分子中含有羟基的有机化合物,它和醇的性质有何异同?
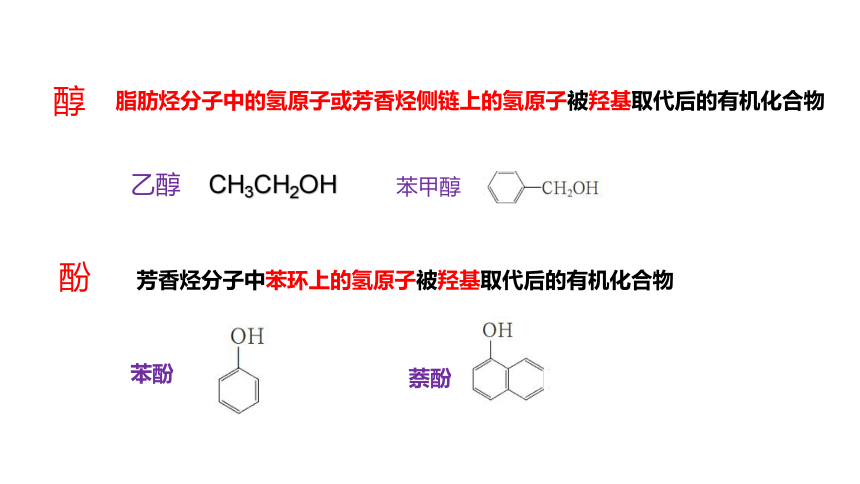
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
醇
芳香烃分子中苯环上的氢原子被羟基取代后的有机化合物
酚
乙醇 CH3CH2OH
苯甲醇
苯酚
萘酚
一、醇概述
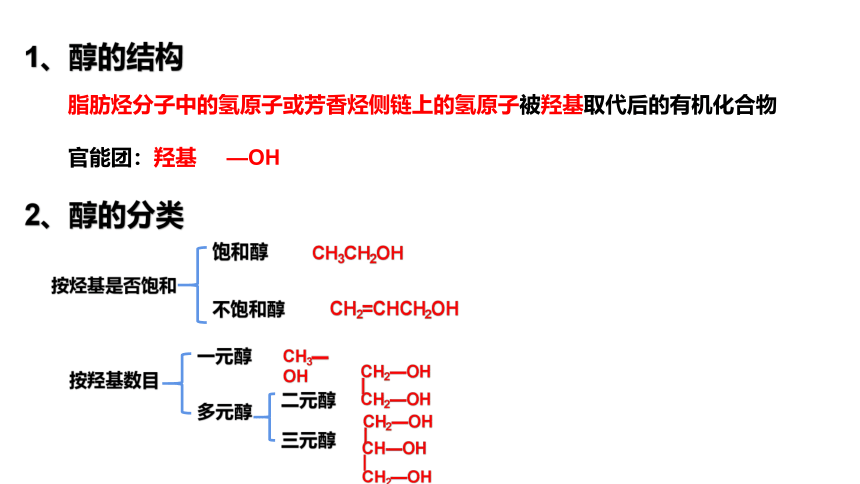
1、醇的结构
2、醇的分类
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
官能团:羟基 —OH
按烃基是否饱和
饱和醇
不饱和醇
CH3CH2OH
CH2=CHCH2OH
按羟基数目
一元醇
二元醇
多元醇
三元醇
CH3—OH
CH2—OH
CH2—OH
|
CH—OH
CH2—OH
|
CH2—OH
|
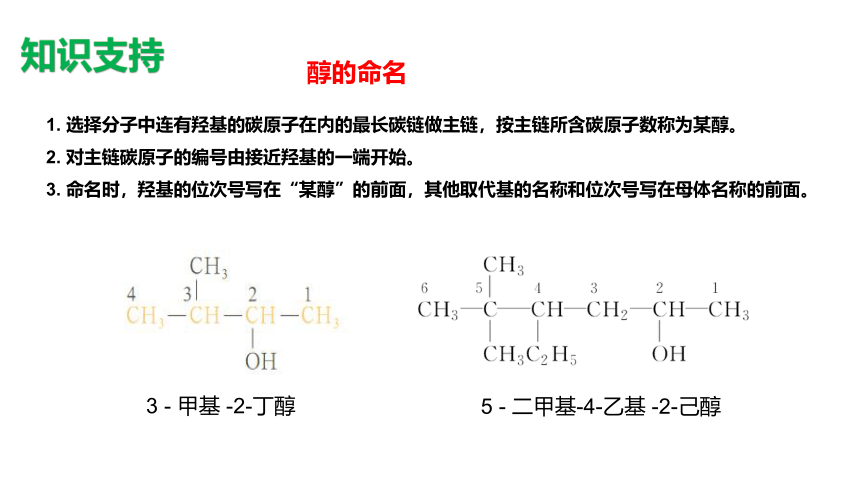
1. 选择分子中连有羟基的碳原子在内的最长碳链做主链,按主链所含碳原子数称为某醇。
2. 对主链碳原子的编号由接近羟基的一端开始。
3. 命名时,羟基的位次号写在“某醇”的前面,其他取代基的名称和位次号写在母体名称的前面。
知识支持
醇的命名
3 - 甲基 -2-丁醇
5 - 二甲基-4-乙基 -2-己醇
名称 俗名 色、味、态 毒性 水溶性 用途
甲醇 木醇 无色、具有挥发性的液体 有毒 互溶 用作燃料、化工原料
乙二醇 甘醇 无色、无臭、具有甜味的黏稠液体 无毒 互溶 作防冻液、合成涤纶
丙三醇 甘油 无色、无臭、具有甜味的黏稠液体 无毒 互溶 制造日用化妆品、硝化甘油
化妆品中的甘油
硝化甘油炸药(TNT)
3、常见的醇
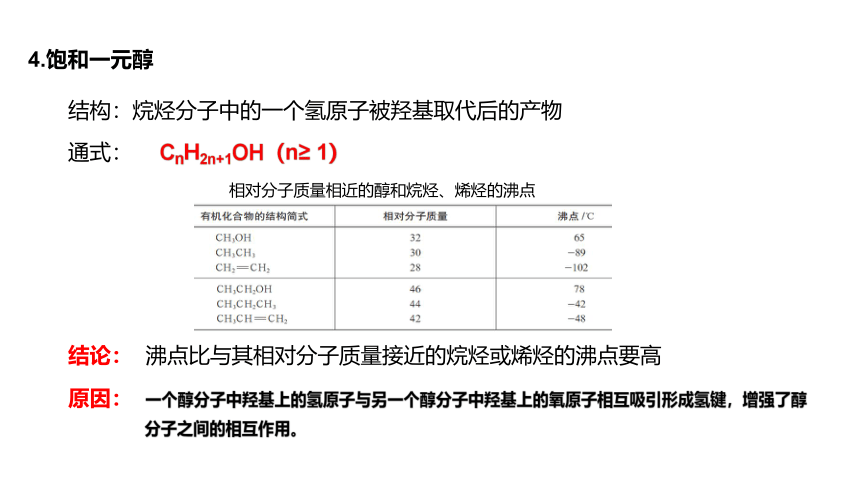
4.饱和一元醇
结构:烷烃分子中的一个氢原子被羟基取代后的产物
通式:
CnH2n+1OH(n≥ 1)
相对分子质量相近的醇和烷烃、烯烃的沸点
结论:
沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高
原因:
一个醇分子中羟基上的氢原子与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子之间的相互作用。
5.醇的物理性质
(1)沸点
①相对分子质量接近的饱和一元醇和烷烃或烯烃相比,饱和一元醇的沸点远远高于烷烃或烯烃。②饱和一元醇,随分子中碳原子数的增加沸点逐渐升高。
③碳原子数相同时,羟基个数越多,沸点越高。
(2)溶解性
①碳原子数为1~3的饱和一元醇和多元醇能与水以任意比例互溶。碳原子数为4~11的饱和一元醇为油状液体,仅可部分溶于水。碳原子数目更多的高级醇为固体,难溶于水。
②含羟基较多的醇极易溶于水。
氢键是一种特殊的分子间作用力。它是指一个分子中与电负性大、半径小的元素原子 X 以共价键相连的氢原子,和另一个分子中电负性大、半径小的元素原子 Y 之间所形成的一种较强的相互作用,常用 X H...Y 表示。氢键的键能为 10 ~40 kJ·mol-1,比化学键弱很多,但比普通的分子间作用力(范德华力)强。
X、Y 是电负性大、半径小的原子,常见的有氟、氧、氮原子。例如,醇分子之间可以形成
氢键,醇的水溶液中水分子和醇分子之间也可以形成氢键。
知识支持
氧元素的电负性比氢元素和碳元素的电负性都大,醇分子中羟基上的氧原子对共用电子的吸引能力强,共用电子偏向氧原子,使碳氧键和氢氧键都显出极性,成为反应的活性部位。
醇分子中羟基上氧原子的强吸电子作用,使 α-H 和 β-H 都较为活泼
交流研讨
1-丙醇为例,结合上述资料,分析醇的分子结构,预测反应的断键部位及相应的反应类型等,并将讨论结果填入下表。
分析结构 预测性质
断键部位 反应类型 反应试剂和条件 反应产物
官能团: 是否含不饱和键: 键的极性: 基团之间的相互影响:
-OH 羟基
否
羟基使α-H 和 β-H 都较为活泼
C-C 非极性键
C-H O-H 极性键
α-H
β-H
O-H
取代反应
消去反应
C-O
浓硫酸,加热
浓硫酸,加热
酯类
氧化反应
O-H
丙醛
丙烯
C-O
取代反应
催化剂,加热
浓氢卤酸
卤代烃
醇分子发生反应的部位及反应类型
醇发生的反应主要涉及分子中的碳氧键和氢氧键:断裂碳氧键脱掉羟基,能发生取代反应或消去反应;断裂氢氧键脱掉氢原子,能发生取代反应或氧化反应。
二、醇的化学性质
1. 羟基的反应
①取代反应
a.分子中的碳氧键发生断裂,羟基被卤素原子取代。
CH3CH2OH+HBr→CH3CH2Br+H2O
CH3CH2CH2OH+HBr→CH3CH2CH2Br+H2O
b. 分子中的碳氧键、氧氢键发生断裂,发生分子间的取代反应。
CH3CH2—OH+H—OCH2CH3 CH3CH2OCH2CH3+H2O
△
△
浓H2SO4
140℃
乙醚
②消去反应
CH3CH2CH2OH CH2=CHCH3↑+H2O。
△
分子由两个烃基通过氧原子连接而成的有机化合物称为醚
浓H2SO4
△
思考:
是否所有的醇都可以发生消去反应,醇消去反应的有什么规律?
醇消去反应的规律
①含有β H的醇可发生消去反应。
②若含有多个β H,则可能得到不同的产物。如
2.羟基中氢的反应
①与活泼金属的反应
2C2H5OH+2Na→2C2H5ONa+H2↑。
②与羧酸的反应——酯化反应
CH3COOH+CH3CH2OH CH3COOC2H5+H2O。
浓H2SO4
△
思考:
1.为什么金属钠与乙醇反应不如钠与水反应剧烈?
2.CH3CH218OH与CH3COOH发生酯化反应生成的小分子中含有18O吗?
由于醇分子中的烷基具有推电子作用,使醇分子中的氢氧键不如水分子中的氢氧键容易断裂,即醇分子中羟基上的氢原子不如水分子中的氢原子活泼,所以乙醇与钠的反应不如钠与水反应剧烈。
没有。因为发生酯化反应时断裂的是CH3CH218OH中的氢氧键。
同位素示踪法是以放射性同位素为示踪剂,对研究对象进行标记的微量分析方法。可以用同位素作为一种标记,制成含有同位素标记的化合物。利用放射性同位素不断地放出特征射线的性质,就可以通过核探测器随时追踪它在产物中的位置和数量。
同位素示踪法
资料在线
酯化反应反应原理
3. 醇的氧化
①醇的燃烧反应
②醇的催化氧化反应
CnH2n+1OH+ O2
点燃
nCO2+(n+1) H2O
3n
2
饱和一元醇燃烧通式
思考:
是否所有的醇都可以发生催化氧化,醇催化氧化的规律是什么?
醇催化氧化的规律
醇的催化氧化的反应情况与α H的个数有关。
课堂小结
醇
定义
分类
物理性质
化学性质
3.醇的氧化反应
1.羟基的反应
2.羟基氢的反应
燃烧
催化氧化
与活泼金属反应
与羧酸反应
取代反应
消去反应
熔沸点
溶解性
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
一元醇
多元醇
第二节 醇和酚
第1课时 醇概述 醇的化学性质
知识回顾
1.加成反应
2.取代反应
3.消去反应
4.氧化反应
还原反应
增加氧原子或减少氢原子的反应
增加氢原子或减少氧原子的反应
在一定条件下,有机化合物脱去小分子物质生成分子中有不饱和键的有机化合物的反应
有机化合物分子中的某个(或某些)原子或原子团被其他原子或原子团代替的反应。
有机化合物分子中不饱和键两端的两个原子与其他原子或原子团结合,生成新的有机化合物的反应。
联想质疑
醇和酚都是重要的有机化合物。例如,常用作燃料和饮料的酒精(乙醇)、汽车发动机防冻液中的乙二醇、化妆品中的丙三醇含有醇羟基,茶叶中的茶多酚、用于制药皂的苯酚、漆器上涂的漆酚含有酚羟基。
一位著名的有机化学家曾说过,假如让一个有机化学家带上10 种有机化合物到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的有机化合物。那么,在有机化合物的合成中醇为什么会有如此重要的作用?
酚也是一种分子中含有羟基的有机化合物,它和醇的性质有何异同?
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
醇
芳香烃分子中苯环上的氢原子被羟基取代后的有机化合物
酚
乙醇 CH3CH2OH
苯甲醇
苯酚
萘酚
一、醇概述
1、醇的结构
2、醇的分类
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
官能团:羟基 —OH
按烃基是否饱和
饱和醇
不饱和醇
CH3CH2OH
CH2=CHCH2OH
按羟基数目
一元醇
二元醇
多元醇
三元醇
CH3—OH
CH2—OH
CH2—OH
|
CH—OH
CH2—OH
|
CH2—OH
|
1. 选择分子中连有羟基的碳原子在内的最长碳链做主链,按主链所含碳原子数称为某醇。
2. 对主链碳原子的编号由接近羟基的一端开始。
3. 命名时,羟基的位次号写在“某醇”的前面,其他取代基的名称和位次号写在母体名称的前面。
知识支持
醇的命名
3 - 甲基 -2-丁醇
5 - 二甲基-4-乙基 -2-己醇
名称 俗名 色、味、态 毒性 水溶性 用途
甲醇 木醇 无色、具有挥发性的液体 有毒 互溶 用作燃料、化工原料
乙二醇 甘醇 无色、无臭、具有甜味的黏稠液体 无毒 互溶 作防冻液、合成涤纶
丙三醇 甘油 无色、无臭、具有甜味的黏稠液体 无毒 互溶 制造日用化妆品、硝化甘油
化妆品中的甘油
硝化甘油炸药(TNT)
3、常见的醇
4.饱和一元醇
结构:烷烃分子中的一个氢原子被羟基取代后的产物
通式:
CnH2n+1OH(n≥ 1)
相对分子质量相近的醇和烷烃、烯烃的沸点
结论:
沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高
原因:
一个醇分子中羟基上的氢原子与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子之间的相互作用。
5.醇的物理性质
(1)沸点
①相对分子质量接近的饱和一元醇和烷烃或烯烃相比,饱和一元醇的沸点远远高于烷烃或烯烃。②饱和一元醇,随分子中碳原子数的增加沸点逐渐升高。
③碳原子数相同时,羟基个数越多,沸点越高。
(2)溶解性
①碳原子数为1~3的饱和一元醇和多元醇能与水以任意比例互溶。碳原子数为4~11的饱和一元醇为油状液体,仅可部分溶于水。碳原子数目更多的高级醇为固体,难溶于水。
②含羟基较多的醇极易溶于水。
氢键是一种特殊的分子间作用力。它是指一个分子中与电负性大、半径小的元素原子 X 以共价键相连的氢原子,和另一个分子中电负性大、半径小的元素原子 Y 之间所形成的一种较强的相互作用,常用 X H...Y 表示。氢键的键能为 10 ~40 kJ·mol-1,比化学键弱很多,但比普通的分子间作用力(范德华力)强。
X、Y 是电负性大、半径小的原子,常见的有氟、氧、氮原子。例如,醇分子之间可以形成
氢键,醇的水溶液中水分子和醇分子之间也可以形成氢键。
知识支持
氧元素的电负性比氢元素和碳元素的电负性都大,醇分子中羟基上的氧原子对共用电子的吸引能力强,共用电子偏向氧原子,使碳氧键和氢氧键都显出极性,成为反应的活性部位。
醇分子中羟基上氧原子的强吸电子作用,使 α-H 和 β-H 都较为活泼
交流研讨
1-丙醇为例,结合上述资料,分析醇的分子结构,预测反应的断键部位及相应的反应类型等,并将讨论结果填入下表。
分析结构 预测性质
断键部位 反应类型 反应试剂和条件 反应产物
官能团: 是否含不饱和键: 键的极性: 基团之间的相互影响:
-OH 羟基
否
羟基使α-H 和 β-H 都较为活泼
C-C 非极性键
C-H O-H 极性键
α-H
β-H
O-H
取代反应
消去反应
C-O
浓硫酸,加热
浓硫酸,加热
酯类
氧化反应
O-H
丙醛
丙烯
C-O
取代反应
催化剂,加热
浓氢卤酸
卤代烃
醇分子发生反应的部位及反应类型
醇发生的反应主要涉及分子中的碳氧键和氢氧键:断裂碳氧键脱掉羟基,能发生取代反应或消去反应;断裂氢氧键脱掉氢原子,能发生取代反应或氧化反应。
二、醇的化学性质
1. 羟基的反应
①取代反应
a.分子中的碳氧键发生断裂,羟基被卤素原子取代。
CH3CH2OH+HBr→CH3CH2Br+H2O
CH3CH2CH2OH+HBr→CH3CH2CH2Br+H2O
b. 分子中的碳氧键、氧氢键发生断裂,发生分子间的取代反应。
CH3CH2—OH+H—OCH2CH3 CH3CH2OCH2CH3+H2O
△
△
浓H2SO4
140℃
乙醚
②消去反应
CH3CH2CH2OH CH2=CHCH3↑+H2O。
△
分子由两个烃基通过氧原子连接而成的有机化合物称为醚
浓H2SO4
△
思考:
是否所有的醇都可以发生消去反应,醇消去反应的有什么规律?
醇消去反应的规律
①含有β H的醇可发生消去反应。
②若含有多个β H,则可能得到不同的产物。如
2.羟基中氢的反应
①与活泼金属的反应
2C2H5OH+2Na→2C2H5ONa+H2↑。
②与羧酸的反应——酯化反应
CH3COOH+CH3CH2OH CH3COOC2H5+H2O。
浓H2SO4
△
思考:
1.为什么金属钠与乙醇反应不如钠与水反应剧烈?
2.CH3CH218OH与CH3COOH发生酯化反应生成的小分子中含有18O吗?
由于醇分子中的烷基具有推电子作用,使醇分子中的氢氧键不如水分子中的氢氧键容易断裂,即醇分子中羟基上的氢原子不如水分子中的氢原子活泼,所以乙醇与钠的反应不如钠与水反应剧烈。
没有。因为发生酯化反应时断裂的是CH3CH218OH中的氢氧键。
同位素示踪法是以放射性同位素为示踪剂,对研究对象进行标记的微量分析方法。可以用同位素作为一种标记,制成含有同位素标记的化合物。利用放射性同位素不断地放出特征射线的性质,就可以通过核探测器随时追踪它在产物中的位置和数量。
同位素示踪法
资料在线
酯化反应反应原理
3. 醇的氧化
①醇的燃烧反应
②醇的催化氧化反应
CnH2n+1OH+ O2
点燃
nCO2+(n+1) H2O
3n
2
饱和一元醇燃烧通式
思考:
是否所有的醇都可以发生催化氧化,醇催化氧化的规律是什么?
醇催化氧化的规律
醇的催化氧化的反应情况与α H的个数有关。
课堂小结
醇
定义
分类
物理性质
化学性质
3.醇的氧化反应
1.羟基的反应
2.羟基氢的反应
燃烧
催化氧化
与活泼金属反应
与羧酸反应
取代反应
消去反应
熔沸点
溶解性
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
一元醇
多元醇
