1.1.2 热化学方程式 课件 (共20页)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.2 热化学方程式 课件 (共20页)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 22:25:43 | ||
图片预览







文档简介
第一章 化学反应的热效应
第一节 反应热
第二课时 热化学方程式
化学选修一
【观察思考】下列两个方程的有什么区别?
(2)H2 (g) + Cl2 (g) ==== 2HCl (g) ?H= -184.6kJ/mol
(1)H2 + Cl2 == 2HCl
既有物质变化又有能量变化
不同:(1)指明了温度和压强
(2)注明了反应物和生成物的状态
(3)注明反应热(△H)
200℃
101kPa
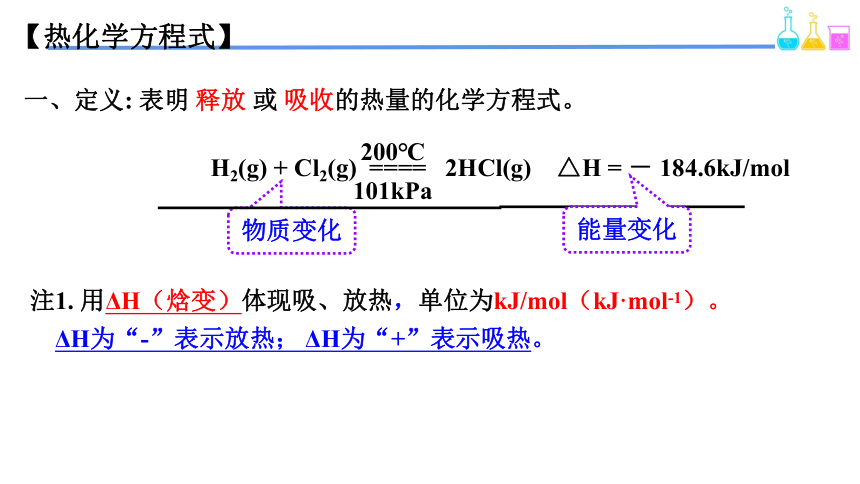
【热化学方程式】
一、定义: 表明 释放 或 吸收的热量的化学方程式。
H2(g) + Cl2(g) ==== 2HCl(g) △H = - 184.6kJ/mol
200℃
101kPa
物质变化
能量变化
注1. 用ΔH(焓变)体现吸、放热,单位为kJ/mol(kJ·mol-1)。
ΔH为“-”表示放热; ΔH为“+”表示吸热。
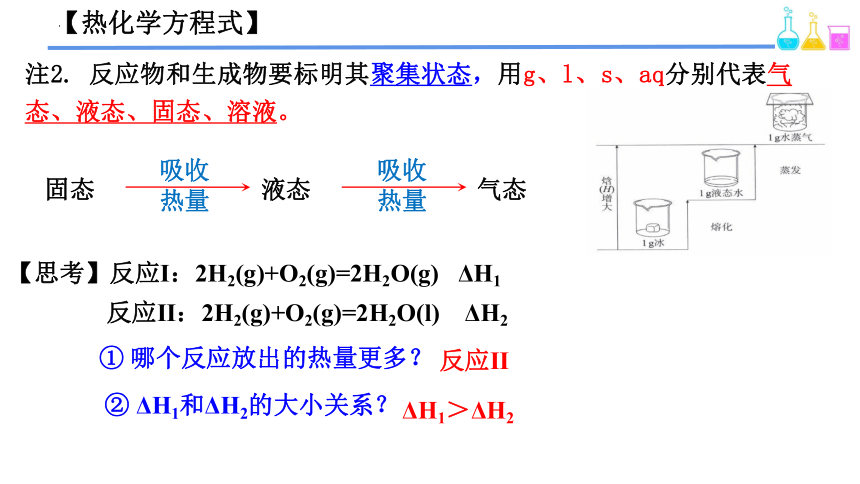
【热化学方程式】
注2. 反应物和生成物要标明其聚集状态,用g、l、s、aq分别代表气态、液态、固态、溶液。
固态
液态
气态
吸收
热量
吸收
热量
【思考】反应Ⅰ:2H2(g)+O2(g)=2H2O(g) ΔH1
反应Ⅱ:2H2(g)+O2(g)=2H2O(l) ΔH2
① 哪个反应放出的热量更多?
反应Ⅱ
② ΔH1和ΔH2的大小关系?
ΔH1>ΔH2
注3. 反应温度、压强不同其ΔH也不同,需注明反应的温度和压强。若不注明温度和压强,一般指25℃,101kPa。
注4. 热化学方程式中各物质前的化学计量数不表示微粒数,只表示物质的量,因此可以是整数或简单分数,不能是小数。
2H2(g)+O2(g)=2H2O(l) ΔH=
-571.6 kJ/mol
H2(g)+????????O2(g)=H2O(l)
?
ΔH= -285.8 kJ/mol
注5. 对于相同物质的反应,当化学计量数不同时,其ΔH也不同,故系数必须与反应热相对应。
【热化学方程式】
【热化学方程式】 教材P10
①已知:N2(g)+3H2(g)
2NH3(g) ΔH= -92.4 kJ/mol
【拓展思考】如何理解可逆反应的ΔH?
完全反应的数据
②在恒压密闭容器中通入1 mol N2与3 mol H2发生,反应达到平衡时,该反应的 ΔH1 -92.4 kJ/mol。(填“大于”’小于”或“等于”)
【热化学方程式】
N2(g)+3H2(g)
2NH3(g)
ΔH2= ?
+ 92.4 kJ/mol
含义:在常温常压下, 1 mol N2气体与3 mol H2气体完全反应生成2molNH3气体该反应 的ΔH = -92.4 kJ/mol
大于
【自我诊断】
(1)热化学方程式中各物质的化学计量数表示分子个数( )
×
(2)化学反应的反应热仅指反应放出的热量( )
×
(3)热化学方程式未注明温度和压强时,ΔH 表示标准状况下的数据( )
?
×
(4)化学反应过程中所吸收或放出的热量与反应物的物质的量成正比
( )
√
(5)同一化学反应,化学计量数相同而聚集状态不同,ΔH 也不同( )
?
√
【问题探究】
1.热化学方程式中,ΔH 单位中的“ mol?1 ”的含义是什么?
?
提示:对一个化学反应,ΔH 的单位中“ mol?1 ”不是指每摩尔具体物质,
而是指“每摩尔反应”,因此ΔH 必须与化学方程式一一对应。
?
2.在25?℃ 和 101?kPa 下, H2g 与 O2g 完全反应生成 H2O 的热化学方程
式如下:
①2H2g+O2g????????????2H2OgΔH=?483.6?kJ?mol?1 ;
②2H2g+O2g????????????2H2OlΔH=?571.6?kJ?mol?1 。
对比①②两个热化学方程式,为什么产物都是2?mol?H2O ,而放出的热量
却不同?
?
提示:两个热化学方程式中H2O 的聚集状态不同,其内能不同,尽管产物
都是2?mol?H2O ,但放出的热量不同,所以热化学方程式中必须注明物质
的聚集状态。
?
学以致用 提升关键能力
1.(2023·石家庄一中高一月考)工业生产水煤气的反应为
Cs+H2Og????????????COg+H2gΔH=+131.4?kJ/mol 。下列说法正确的
是( )
?
A.反应物总能量大于生成物总能量
B.COg+H2g????????????Cs+H2OgΔH=?131.4?kJ/mol
C.水煤气反应中生成1?mol?H2g 放出 131.4?kJ 热量
D.水煤气反应中生成1体积COg 吸收 131.4?kJ 热量
?
√
【热化学反应方程式】
【练习3】已知:
(1)H2(g)+1/2O2 (g) = H2O (g) ΔH1 = a kJ/mol
(2)2H2(g)+O2 (g) =2H2O (g) ΔH2 = b kJ/mol
(3) H2(g)+1/2O2 (g) = H2O (l) ΔH3 = c kJ/mol
(4) 2H2(g)+O2 (g) =2H2O (l) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是( )
A、ad>0 C、2a=b< 0 D、2c=d>0
C
【热化学方程式的书写】
一、热化学方程式的书写步骤
一写方程式
二标状态
三标条件
四标 ΔH
五标数值
写出配平的化学方程式
用 s,l,g,aq 标明物质的聚集状态
标明反应温度和压强(101kPa,25℃可不标注)
在方程式后面标明该反应的焓变 ΔH
根据化学计量数计算ΔH值并注明单位
3.(2023·宁乡第七高级中学高二月考)写出下列反应的热化学方程式。
(1)1?mol?H2g 与适量 O2g 反应生成 H2Ol 放出 285.8?kJ 的热量:
_______________________________________________。
?
H2g+12O2g????????????H2Ol ΔH=?285.8?kJ?mol?1
?
(2)32?g?Cus 与适量 O2g 反应生成 CuOs 放出 78.5?kJ 的热量:_____
__________________________________________。
?
Cus+12O2g????????????CuOs ΔH=??157?kJ?mol?1
?
(3)1.7?g?NH3g 发生催化氧化反应生成气态产物放出 22.67?kJ 的热量:
________________________________________________________。
?
NH3g+54O2g????????????NOg+32H2Og ΔH=?226.7?kJ?mol?1
?
(4)25?℃ 、 101?kPa 下,强酸、强碱的稀溶液发生中和反应生成
1?mol?H2Ol 时,放出 57.3?kJ 的热量:______________________________
___________________。
?
H+aq+OH?aq????????????H2Ol ΔH=?57.3?kJ?mol?1
?
(5)已知:N2g+3H2g?2NH3gΔH=?92?kJ?mol?1 。请写出
1?mol?NH3 分解对应的热化学方程式:_______________________________
_____________。
若1?mol?N2g 和 3?mol?H2g 在一定条件下发生反应,放出的热量______
92?kJ (填“大于”“小于”或“等于”),理由是__________________________
_______。
?
NH3g?12N2g+32H2g ΔH=+46?kJ?mol?1
?
小于
该反应是可逆反应,不能进行完全
【热化学反应方程式】
二、“五查”法判断热化学方程式书写正误
①看方程式是否配平;
②看各物质的聚集状态是否正确;
③看ΔH 变化的“+”、“-”是否正确;
④看反应热的单位是否为 kJ·mol-1;
⑤看反应热的数值与化学计量数是否相对应
【热化学反应方程式】
判断热化学方程式是否正确。
(5)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/mol
(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ
(3)已知强酸与强碱稀溶液发生中和反应生成1mol H2O放热57.3 kJ,则
2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/mol
×
物质状态、反应条件
×
△H 单位:kJ/mol
√
×
化学计量数与△H 不成正比
(4)25℃、101kpPa下,将2 mol SO2(g)与1 mol O2(g)置于密闭容器中充分
反应生成SO3(g)放热 a kJ,则2SO2(g) + O2(g) 2SO3(g) △H =-a kJ/mol
(1)4NH3 + 5O2 ==== 4NO + 6H2O △H = – 906.8 kJ/mol
催化剂
△
×
可逆反应实际转化率<100%,热化学方程式指该反应完全进行的能量变化
2.(2023·江门高二检测)热化学方程式表示化学反应中的物质变化和焓变。
下列热化学方程式书写正确的是( )
A.2SO2+O2?△催化剂2SO3ΔH=?196.6?kJ?mol?1
B.H2g+Cl2g????????????2HCllΔH=?184.6?kJ?mol?1
C.2H2g+O2g????????????2H2OlΔH=?571.6?kJ
D.Cs+O2g????????????CO2gΔH=+393.5?kJ?mol?1
?
√
【热化学反应方程式】
【练习1】沼气是一种能源,它的主要成分是CH4。0.5mol CH4 完全燃烧生成CO2和液态H2O时,放出 445kJ 热量,则下列热化学方程式书写正确的是( )
C
【热化学反应方程式】
【课堂小结】
第一节 反应热
第二课时 热化学方程式
化学选修一
【观察思考】下列两个方程的有什么区别?
(2)H2 (g) + Cl2 (g) ==== 2HCl (g) ?H= -184.6kJ/mol
(1)H2 + Cl2 == 2HCl
既有物质变化又有能量变化
不同:(1)指明了温度和压强
(2)注明了反应物和生成物的状态
(3)注明反应热(△H)
200℃
101kPa
【热化学方程式】
一、定义: 表明 释放 或 吸收的热量的化学方程式。
H2(g) + Cl2(g) ==== 2HCl(g) △H = - 184.6kJ/mol
200℃
101kPa
物质变化
能量变化
注1. 用ΔH(焓变)体现吸、放热,单位为kJ/mol(kJ·mol-1)。
ΔH为“-”表示放热; ΔH为“+”表示吸热。
【热化学方程式】
注2. 反应物和生成物要标明其聚集状态,用g、l、s、aq分别代表气态、液态、固态、溶液。
固态
液态
气态
吸收
热量
吸收
热量
【思考】反应Ⅰ:2H2(g)+O2(g)=2H2O(g) ΔH1
反应Ⅱ:2H2(g)+O2(g)=2H2O(l) ΔH2
① 哪个反应放出的热量更多?
反应Ⅱ
② ΔH1和ΔH2的大小关系?
ΔH1>ΔH2
注3. 反应温度、压强不同其ΔH也不同,需注明反应的温度和压强。若不注明温度和压强,一般指25℃,101kPa。
注4. 热化学方程式中各物质前的化学计量数不表示微粒数,只表示物质的量,因此可以是整数或简单分数,不能是小数。
2H2(g)+O2(g)=2H2O(l) ΔH=
-571.6 kJ/mol
H2(g)+????????O2(g)=H2O(l)
?
ΔH= -285.8 kJ/mol
注5. 对于相同物质的反应,当化学计量数不同时,其ΔH也不同,故系数必须与反应热相对应。
【热化学方程式】
【热化学方程式】 教材P10
①已知:N2(g)+3H2(g)
2NH3(g) ΔH= -92.4 kJ/mol
【拓展思考】如何理解可逆反应的ΔH?
完全反应的数据
②在恒压密闭容器中通入1 mol N2与3 mol H2发生,反应达到平衡时,该反应的 ΔH1 -92.4 kJ/mol。(填“大于”’小于”或“等于”)
【热化学方程式】
N2(g)+3H2(g)
2NH3(g)
ΔH2= ?
+ 92.4 kJ/mol
含义:在常温常压下, 1 mol N2气体与3 mol H2气体完全反应生成2molNH3气体该反应 的ΔH = -92.4 kJ/mol
大于
【自我诊断】
(1)热化学方程式中各物质的化学计量数表示分子个数( )
×
(2)化学反应的反应热仅指反应放出的热量( )
×
(3)热化学方程式未注明温度和压强时,
?
×
(4)化学反应过程中所吸收或放出的热量与反应物的物质的量成正比
( )
√
(5)同一化学反应,化学计量数相同而聚集状态不同,
?
√
【问题探究】
1.热化学方程式中,
?
提示:对一个化学反应,
而是指“每摩尔反应”,因此
?
2.在
式如下:
对比①②两个热化学方程式,为什么产物都是
却不同?
?
提示:两个热化学方程式中
都是
的聚集状态。
?
学以致用 提升关键能力
1.(2023·石家庄一中高一月考)工业生产水煤气的反应为
是( )
?
A.反应物总能量大于生成物总能量
B.
C.水煤气反应中生成
D.水煤气反应中生成1体积
?
√
【热化学反应方程式】
【练习3】已知:
(1)H2(g)+1/2O2 (g) = H2O (g) ΔH1 = a kJ/mol
(2)2H2(g)+O2 (g) =2H2O (g) ΔH2 = b kJ/mol
(3) H2(g)+1/2O2 (g) = H2O (l) ΔH3 = c kJ/mol
(4) 2H2(g)+O2 (g) =2H2O (l) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是( )
A、a
C
【热化学方程式的书写】
一、热化学方程式的书写步骤
一写方程式
二标状态
三标条件
四标 ΔH
五标数值
写出配平的化学方程式
用 s,l,g,aq 标明物质的聚集状态
标明反应温度和压强(101kPa,25℃可不标注)
在方程式后面标明该反应的焓变 ΔH
根据化学计量数计算ΔH值并注明单位
3.(2023·宁乡第七高级中学高二月考)写出下列反应的热化学方程式。
(1)
_______________________________________________。
?
?
(2)
__________________________________________。
?
?
(3)
________________________________________________________。
?
?
(4)
___________________。
?
?
(5)已知:
_____________。
若
_______。
?
?
小于
该反应是可逆反应,不能进行完全
【热化学反应方程式】
二、“五查”法判断热化学方程式书写正误
①看方程式是否配平;
②看各物质的聚集状态是否正确;
③看ΔH 变化的“+”、“-”是否正确;
④看反应热的单位是否为 kJ·mol-1;
⑤看反应热的数值与化学计量数是否相对应
【热化学反应方程式】
判断热化学方程式是否正确。
(5)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/mol
(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ
(3)已知强酸与强碱稀溶液发生中和反应生成1mol H2O放热57.3 kJ,则
2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/mol
×
物质状态、反应条件
×
△H 单位:kJ/mol
√
×
化学计量数与△H 不成正比
(4)25℃、101kpPa下,将2 mol SO2(g)与1 mol O2(g)置于密闭容器中充分
反应生成SO3(g)放热 a kJ,则2SO2(g) + O2(g) 2SO3(g) △H =-a kJ/mol
(1)4NH3 + 5O2 ==== 4NO + 6H2O △H = – 906.8 kJ/mol
催化剂
△
×
可逆反应实际转化率<100%,热化学方程式指该反应完全进行的能量变化
2.(2023·江门高二检测)热化学方程式表示化学反应中的物质变化和焓变。
下列热化学方程式书写正确的是( )
A.
B.
C.
D.
?
√
【热化学反应方程式】
【练习1】沼气是一种能源,它的主要成分是CH4。0.5mol CH4 完全燃烧生成CO2和液态H2O时,放出 445kJ 热量,则下列热化学方程式书写正确的是( )
C
【热化学反应方程式】
【课堂小结】
