1.3.2氧化剂 还原剂(1) 课件(共45页) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化剂 还原剂(1) 课件(共45页) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 831.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 11:15:04 | ||
图片预览











文档简介
(共45张PPT)
第二课时
氧化剂和还原剂
核心素养
发展目标
1.能从化学反应中元素化合价的变化认识氧化剂、还原剂、氧化产物、还原产物等概念,熟知常见的氧化剂和还原剂,理清相关概念间的关系,促进“变化观念”化学学科核心素养的发展。
2.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性,建立判断物质氧化性、还原性强弱的“思维模型”。
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
一、氧化剂和还原剂的相关概念
氧化剂 还原剂
概念 在氧化还原反应中,所含某种(或某些)元素化合价 的反应物 在氧化还原反应中,所含某种(或某些)元素化合价
的反应物
发生的反应 反应 反应
具有的性质 性 性
对应的产物 产物 产物
降低
升高
还原
氧化
氧化
还原
还原
氧化
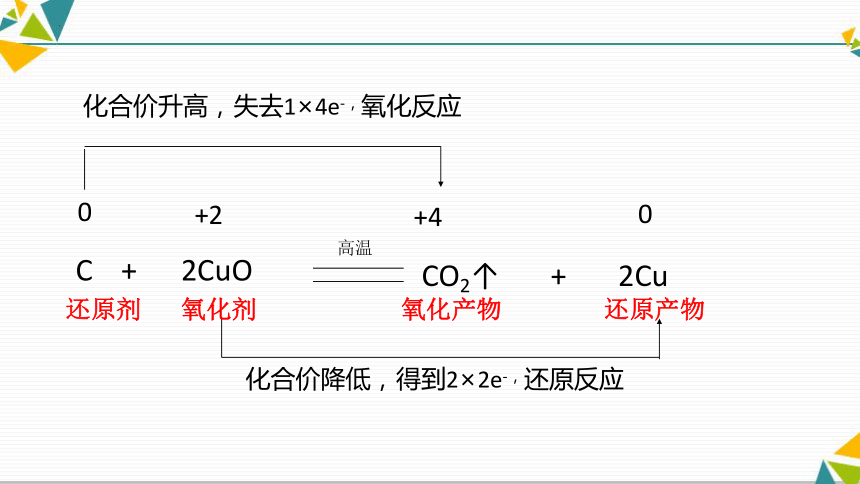
化合价降低,得到2×2e-,还原反应
化合价升高,失去1×4e-,氧化反应
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
还原剂 氧化剂
氧化产物 还原产物
2CuO + C == 2Cu + CO2
高温
+2
0
0
+4
从反应物上分:
从生成物上分:
从反应上看:
( 还原剂本身被氧化,氧化剂本身被还原 )
C发生氧化反应;
CuO发生还原反应
Cu是还原产物;
CO2是氧化产物
C是还原剂
CuO是氧化剂
Cu + Cl2== CuCl2Zn + H2SO4== ZnSO4+ H2↑CaCO3+ 2HCl == CaCl2+H2O+CO2↑Cl2+ H2O== HCl + HClO做一做:1.下列反应中,哪些是氧化剂?哪些是还原剂?氧化剂还原剂氧化剂还原剂既是氧化剂又是还原剂非氧化还原反应二、氧化剂和还原剂
√
×
正误判断
×
×
×
(1)非金属单质在反应中只能做氧化剂,不能做还原剂( )
(2)反应中,某元素化合价升高,失去电子,表现出还原性( )
(3)在反应中,阳离子只能得到电子被还原,阴离子只能失去电子被氧化
)
(4)氧化剂得到电子被氧化,生成产物为还原产物( )
(5)在同一反应中,氧化剂和还原剂不可能是同一种物质( )
(6)氧化还原反应的生成物一定是一种为氧化产物,另一种为还原产物
( )
×
①活泼的非金属单质,如 、 等。
②含较高价态元素的化合物,如 、 、KClO3、FeCl3等。
③过氧化物,如Na2O2、H2O2等。
O2
Cl2
KMnO4
HNO3
常见的氧化剂
①活泼的金属单质,如 、 等。
②含较低价态元素的氧化物,如 、 等。
③含较低价态元素的盐,如 、KI、Na2SO3等。
④非金属单质及其氢化物,如 、 等。
Mg
Al
CO
SO2
FeCl2
S
H2S
常见的还原剂
1.分析下列反应并按要求填空。
(1)2Fe+3Cl2 2FeCl3
氧化剂是________,还原剂是________;发生氧化反应的是________,发生还原反应的是________。
(2)H2O2+2HCl+2FeCl2===2FeCl3+2H2O
氧化剂是______,还原剂是______;氧化产物是______,还原产物是______。
Cl2
Fe
H2O2
Fe
Cl2
FeCl2
FeCl3
H2O
(3)5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
氧化剂是_________,还原剂是______;氧化产物是______,还原产物是_________。
KMnO4
H2O2
O2
MnSO4
氧化剂+还原剂 ==== 还原产物+氧化产物
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
氧化性
还原性
总结:
升失氧
降得还
化合价升高,失去电子,被氧化,发生氧化反应,生成氧化产物,做还原剂
化合价降低,得到电子,被还原,发生还原反应,生成还原产物,做氧化剂
“剂性一致,其他相反”
还原剂→具有还原性→被氧化→发生氧化反应
氧化剂→具有氧化性→被还原→发生还原反应
二.氧化性和还原性
氧化性:氧化剂得电子的能力(或称氧化能力)
还原性:还原剂失电子的能力(或称还原能力)
氧化剂具有氧化性
还原剂具有还原性
3、从氧化性、还原性的角度认识和研究物质的性质
(1)所含元素处于较高价态时,元素有降低价态的趋势,该物质可能具有氧化性。
(2)所含元素处于较低价态时,元素有升高价态的趋势,该物质可能具有还原性。
氧化性和还原性
价态规律——元素处于最高价,只有氧化性;
元素处于最低价,只有还原性;
元素处于中间价态,既有氧化性又有还原性。
高价氧化,低价还,中间价态两样全。
注意:
元素处于最高价态时氧化性不一定最强。
元素处于最低价态时还原性也不一定最强。
氧化性和还原性
4.(1)在S2-、Fe2+、Mg2+、S、I-、H+中,只具有氧化性的是________,只具有还原性的是__________,既具有氧化性又具有还原性的是__________。
1
2
3
4
元素处于最高价态时,只有氧化性,如Mg2+、H+;元素处于最低价态时,只有还原性,如S2-、I-;元素处于中间价态时,既有氧化性又有还原性,如Fe2+、S。
Mg2+、H+
S2-、I-
Fe2+、S
归纳总结
理解氧化还原反应的相关概念及相互关系,要抓住两条线:
记忆口诀:升失氧,还原剂;降得还,氧化剂。
返回
3.氧化性、还原性强弱的判断方法
(1)根据氧化还原反应方程式比较
氧化性:氧化剂 氧化产物;
还原性:还原剂 还原产物。
>
>
【例】2KI+Cl2=2KCl+I2
氧化性: ;
还原性: ;
(2)根据金属活动性顺序表
金属单质,还原性逐渐减弱
金属阳离子,氧化性逐渐增强
氧化还原反应越容易进行(表现为反应所需条件越低),则氧化剂的氧化性和还原剂的还原性就越强。如:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
4HCl+O2 2H2O+2Cl2↑
氧化性:KMnO4>MnO2>O2
(3)根据反应条件的难易
(4)根据浓度大小判断
如氧化性:浓H2SO4强于稀H2SO4,浓HNO3强于稀HNO3。
(5)根据物质被氧化或被还原的程度判断
例如:2Fe+3Cl2 2FeCl3 Fe+S FeS
Cl2能将Fe氧化到+3价,而S只能将Fe氧化到+2价,因此,氧化性:Cl2 S。
>
正误判断
(1)物质所含元素化合价越高,则该物质氧化性就越强( )
(2)难失电子的物质,其得电子能力一定越强( )
(3)1 mol Mg比1 mol Na失电子多,所以还原性:Mg>Na( )
(4)H2O中H元素为最高的+1价,因此H2O只有氧化性( )
(5)氧化性和还原性是指物质在反应中得失电子的性质,与得失电子多少无直接关系( )
×
×
×
×
√
应用体验
√
2.已知下列反应:Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O(Ⅰ),5Cl2+I2+6H2O===10HCl+2HIO3(Ⅱ),下列说法正确的是
A.氧化性:Co2O3>Cl2>HIO3
B.反应Ⅰ中HCl是氧化剂
C.还原性:CoCl2>HCl>I2
D.反应Ⅱ中Cl2发生氧化反应
√
1.根据反应式:
(1)2Fe3++2I-=2Fe2++I2,
(2)Br2+2Fe2+=2Br-+2Fe3+,
可判断离子的还原性从强到弱的顺序是
( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
【课堂练习】
B
2.已知X2,Y2,Z2,W2四种物质的氧化性强弱为: W2> Z2>X2>Y2,
下列氧化还原反应能发生的是 ( ) A. 2W- + Z2 = 2Z- + W2
B. 2X- + Z2 = 2Z- + X2
C. 2Y- + W2 = 2W- + Y2
BC
D. 2Z- + X2 = 2X- + Z2
3.根据反应
2H2S+O2==2S↓+2H2O,
4NaI+O2+2H2O==2I2+4NaOH,
Na2S+I2==2NaI+S↓,
判断氧化性强弱顺序是( )
A.O2>S>I2 B.S>I2>O2
C.I2>S>O2 D.O2>I2>S
D
4、下列物质不能作为还原剂的是( )
A H2S B Fe2+ C Fe3+ D SO2
5、亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂,当它作氧化剂时,可能生成的产物是( )
A NH3 B HNO3 C N2O5 D N2O3
C
A
习题
题组一 氧化剂和还原剂
1.下列各组物质属于常见氧化剂的一组是
A.Cl2、O2、FeCl3、KMnO4
B.O2、KMnO4、C、H2
C.Na、K、FeCl2、H2、CO
D.CuO、CO、Fe2O3、H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
常用作氧化剂的物质有O2、Cl2、HNO3、KMnO4、FeCl3等,常用作还原剂的物质有C、H2、CO、KI、Zn、Al、Fe等。
2.沾水的铁制器皿高温灼烧会发黑,其可能原因是3Fe+4H2O(g)
Fe3O4+4H2,在此反应中,属于氧化剂的是
A.Fe B.Fe3O4
C.H2O D.H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
反应中Fe元素化合价升高被氧化,为还原剂;H2O中H元素化合价降低被还原,为氧化剂。
3.某国外化学教材中有一张关于氧化还原反应的插图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由图可知, 在该反应中是
A.氧化剂 B.还原剂
C.氧化产物 D.还原产物
√
根据题给插图可知,该物质在氧化还原反应中失去电子生成A,做还原剂,B正确。
4.下列关于氧化剂与还原剂的判断正确的是
A.反应CH4+2O2 CO2+2H2O中,O2是氧化剂,CH4是还原剂
B.反应Cl2+2NaOH===NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是
还原剂
C.反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,HCl是氧化剂,
MnO2是还原剂
D.反应H2O2+2ClO2+2NaOH===2NaClO2+2H2O+O2中,H2O2是绿色
氧化剂
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
5.下列反应中必须加入还原剂才能进行的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
题组三 氧化还原反应的简单计算
9.(2021·安徽定远育才学校月考)在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂与还原剂的物质的量之比为
A.1∶8 B.8∶1
C.1∶5 D.5∶1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
10.对于反应CaH2+2H2O===Ca(OH)2+2H2↑,下列判断不正确的是
A.H2O为氧化剂
B.氧化产物和还原产物的分子数之比为1∶1
C.CaH2为还原剂,失电子被氧化
D.每生成1 mol H2,转移的电子数为2NA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.“神舟七号”载人飞船火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为R+2N2O4===3N2+4H2O+2CO2,下列叙述错误的是
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭升空
C.在反应中N2O4做还原剂
D.R的分子式为C2H8N2
√
12.高铁酸钾(K2FeO4)是一种新型、高效的水处理剂,制取高铁酸钾的一种方法为2Fe(OH)3+3Cl2+10KOH===2K2FeO4+6KCl+8H2O。下列关于该反应的说法错误的是
A.K2FeO4中铁元素化合价为+6价
B.生成1 mol K2FeO4时转移6 mol电子
C.Cl2是氧化剂
D.Fe(OH)3发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
13.(2021·山东新高考质量联盟联考)在焊接铜器时常用NH4Cl溶液除去铜器表面的氧化铜,其反应为CuO+NH4Cl→Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是
A.该反应中NH4Cl被还原
B.该反应中氧化剂和还原剂的物质的量之比为2∶3
C.该反应中产生0.1 mol N2时,转移0.6 mol电子
D.该反应中被还原的CuO占参与反应的CuO的
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
14.实验室可用KMnO4和浓盐酸反应制取氯气。其化学反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
(1)请将上述化学方程式改写为离子方程式:_______________________
__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10Cl-
===2Mn2++5Cl2↑+8H2O
(2)浓盐酸在反应中显示出来的性质是______(填序号)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
②
15.(1)下列变化一定加入还原剂才能实现的是______(填序号)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①③
(2)我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C===K2S+N2↑+3CO2↑,反应中被还原的物质是___________(填化学式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
S、KNO3
反应S+2KNO3+3C===K2S+N2↑+3CO2↑中,KNO3中N元素化合价由+5价降低为0价,S元素化合价由0价降低为-2价,所以KNO3、S是氧化剂,被还原。
(3)NaH可在野外作生氢剂,反应原理为NaH+H2O===NaOH+H2↑,该反应中氧化产物和还原产物的质量比为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1∶1
NaH+H2O===NaOH+H2↑,NaH中H元素化合价由-1价升高为0价,H2O中H元素化合价由+1价降低为0价,H2既是氧化产物又是还原产物,根据得失电子守恒,氧化产物和还原产物的质量之比为1∶1。
(4)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,用单线桥
标出电子转移的方向和数目:___________________________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
===2KCl+2MnCl2+
5Cl2↑+8H2O
第二课时
氧化剂和还原剂
核心素养
发展目标
1.能从化学反应中元素化合价的变化认识氧化剂、还原剂、氧化产物、还原产物等概念,熟知常见的氧化剂和还原剂,理清相关概念间的关系,促进“变化观念”化学学科核心素养的发展。
2.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性,建立判断物质氧化性、还原性强弱的“思维模型”。
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
一、氧化剂和还原剂的相关概念
氧化剂 还原剂
概念 在氧化还原反应中,所含某种(或某些)元素化合价 的反应物 在氧化还原反应中,所含某种(或某些)元素化合价
的反应物
发生的反应 反应 反应
具有的性质 性 性
对应的产物 产物 产物
降低
升高
还原
氧化
氧化
还原
还原
氧化
化合价降低,得到2×2e-,还原反应
化合价升高,失去1×4e-,氧化反应
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
还原剂 氧化剂
氧化产物 还原产物
2CuO + C == 2Cu + CO2
高温
+2
0
0
+4
从反应物上分:
从生成物上分:
从反应上看:
( 还原剂本身被氧化,氧化剂本身被还原 )
C发生氧化反应;
CuO发生还原反应
Cu是还原产物;
CO2是氧化产物
C是还原剂
CuO是氧化剂
Cu + Cl2== CuCl2Zn + H2SO4== ZnSO4+ H2↑CaCO3+ 2HCl == CaCl2+H2O+CO2↑Cl2+ H2O== HCl + HClO做一做:1.下列反应中,哪些是氧化剂?哪些是还原剂?氧化剂还原剂氧化剂还原剂既是氧化剂又是还原剂非氧化还原反应二、氧化剂和还原剂
√
×
正误判断
×
×
×
(1)非金属单质在反应中只能做氧化剂,不能做还原剂( )
(2)反应中,某元素化合价升高,失去电子,表现出还原性( )
(3)在反应中,阳离子只能得到电子被还原,阴离子只能失去电子被氧化
)
(4)氧化剂得到电子被氧化,生成产物为还原产物( )
(5)在同一反应中,氧化剂和还原剂不可能是同一种物质( )
(6)氧化还原反应的生成物一定是一种为氧化产物,另一种为还原产物
( )
×
①活泼的非金属单质,如 、 等。
②含较高价态元素的化合物,如 、 、KClO3、FeCl3等。
③过氧化物,如Na2O2、H2O2等。
O2
Cl2
KMnO4
HNO3
常见的氧化剂
①活泼的金属单质,如 、 等。
②含较低价态元素的氧化物,如 、 等。
③含较低价态元素的盐,如 、KI、Na2SO3等。
④非金属单质及其氢化物,如 、 等。
Mg
Al
CO
SO2
FeCl2
S
H2S
常见的还原剂
1.分析下列反应并按要求填空。
(1)2Fe+3Cl2 2FeCl3
氧化剂是________,还原剂是________;发生氧化反应的是________,发生还原反应的是________。
(2)H2O2+2HCl+2FeCl2===2FeCl3+2H2O
氧化剂是______,还原剂是______;氧化产物是______,还原产物是______。
Cl2
Fe
H2O2
Fe
Cl2
FeCl2
FeCl3
H2O
(3)5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
氧化剂是_________,还原剂是______;氧化产物是______,还原产物是_________。
KMnO4
H2O2
O2
MnSO4
氧化剂+还原剂 ==== 还原产物+氧化产物
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
氧化性
还原性
总结:
升失氧
降得还
化合价升高,失去电子,被氧化,发生氧化反应,生成氧化产物,做还原剂
化合价降低,得到电子,被还原,发生还原反应,生成还原产物,做氧化剂
“剂性一致,其他相反”
还原剂→具有还原性→被氧化→发生氧化反应
氧化剂→具有氧化性→被还原→发生还原反应
二.氧化性和还原性
氧化性:氧化剂得电子的能力(或称氧化能力)
还原性:还原剂失电子的能力(或称还原能力)
氧化剂具有氧化性
还原剂具有还原性
3、从氧化性、还原性的角度认识和研究物质的性质
(1)所含元素处于较高价态时,元素有降低价态的趋势,该物质可能具有氧化性。
(2)所含元素处于较低价态时,元素有升高价态的趋势,该物质可能具有还原性。
氧化性和还原性
价态规律——元素处于最高价,只有氧化性;
元素处于最低价,只有还原性;
元素处于中间价态,既有氧化性又有还原性。
高价氧化,低价还,中间价态两样全。
注意:
元素处于最高价态时氧化性不一定最强。
元素处于最低价态时还原性也不一定最强。
氧化性和还原性
4.(1)在S2-、Fe2+、Mg2+、S、I-、H+中,只具有氧化性的是________,只具有还原性的是__________,既具有氧化性又具有还原性的是__________。
1
2
3
4
元素处于最高价态时,只有氧化性,如Mg2+、H+;元素处于最低价态时,只有还原性,如S2-、I-;元素处于中间价态时,既有氧化性又有还原性,如Fe2+、S。
Mg2+、H+
S2-、I-
Fe2+、S
归纳总结
理解氧化还原反应的相关概念及相互关系,要抓住两条线:
记忆口诀:升失氧,还原剂;降得还,氧化剂。
返回
3.氧化性、还原性强弱的判断方法
(1)根据氧化还原反应方程式比较
氧化性:氧化剂 氧化产物;
还原性:还原剂 还原产物。
>
>
【例】2KI+Cl2=2KCl+I2
氧化性: ;
还原性: ;
(2)根据金属活动性顺序表
金属单质,还原性逐渐减弱
金属阳离子,氧化性逐渐增强
氧化还原反应越容易进行(表现为反应所需条件越低),则氧化剂的氧化性和还原剂的还原性就越强。如:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
4HCl+O2 2H2O+2Cl2↑
氧化性:KMnO4>MnO2>O2
(3)根据反应条件的难易
(4)根据浓度大小判断
如氧化性:浓H2SO4强于稀H2SO4,浓HNO3强于稀HNO3。
(5)根据物质被氧化或被还原的程度判断
例如:2Fe+3Cl2 2FeCl3 Fe+S FeS
Cl2能将Fe氧化到+3价,而S只能将Fe氧化到+2价,因此,氧化性:Cl2 S。
>
正误判断
(1)物质所含元素化合价越高,则该物质氧化性就越强( )
(2)难失电子的物质,其得电子能力一定越强( )
(3)1 mol Mg比1 mol Na失电子多,所以还原性:Mg>Na( )
(4)H2O中H元素为最高的+1价,因此H2O只有氧化性( )
(5)氧化性和还原性是指物质在反应中得失电子的性质,与得失电子多少无直接关系( )
×
×
×
×
√
应用体验
√
2.已知下列反应:Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O(Ⅰ),5Cl2+I2+6H2O===10HCl+2HIO3(Ⅱ),下列说法正确的是
A.氧化性:Co2O3>Cl2>HIO3
B.反应Ⅰ中HCl是氧化剂
C.还原性:CoCl2>HCl>I2
D.反应Ⅱ中Cl2发生氧化反应
√
1.根据反应式:
(1)2Fe3++2I-=2Fe2++I2,
(2)Br2+2Fe2+=2Br-+2Fe3+,
可判断离子的还原性从强到弱的顺序是
( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
【课堂练习】
B
2.已知X2,Y2,Z2,W2四种物质的氧化性强弱为: W2> Z2>X2>Y2,
下列氧化还原反应能发生的是 ( ) A. 2W- + Z2 = 2Z- + W2
B. 2X- + Z2 = 2Z- + X2
C. 2Y- + W2 = 2W- + Y2
BC
D. 2Z- + X2 = 2X- + Z2
3.根据反应
2H2S+O2==2S↓+2H2O,
4NaI+O2+2H2O==2I2+4NaOH,
Na2S+I2==2NaI+S↓,
判断氧化性强弱顺序是( )
A.O2>S>I2 B.S>I2>O2
C.I2>S>O2 D.O2>I2>S
D
4、下列物质不能作为还原剂的是( )
A H2S B Fe2+ C Fe3+ D SO2
5、亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂,当它作氧化剂时,可能生成的产物是( )
A NH3 B HNO3 C N2O5 D N2O3
C
A
习题
题组一 氧化剂和还原剂
1.下列各组物质属于常见氧化剂的一组是
A.Cl2、O2、FeCl3、KMnO4
B.O2、KMnO4、C、H2
C.Na、K、FeCl2、H2、CO
D.CuO、CO、Fe2O3、H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
常用作氧化剂的物质有O2、Cl2、HNO3、KMnO4、FeCl3等,常用作还原剂的物质有C、H2、CO、KI、Zn、Al、Fe等。
2.沾水的铁制器皿高温灼烧会发黑,其可能原因是3Fe+4H2O(g)
Fe3O4+4H2,在此反应中,属于氧化剂的是
A.Fe B.Fe3O4
C.H2O D.H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
反应中Fe元素化合价升高被氧化,为还原剂;H2O中H元素化合价降低被还原,为氧化剂。
3.某国外化学教材中有一张关于氧化还原反应的插图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由图可知, 在该反应中是
A.氧化剂 B.还原剂
C.氧化产物 D.还原产物
√
根据题给插图可知,该物质在氧化还原反应中失去电子生成A,做还原剂,B正确。
4.下列关于氧化剂与还原剂的判断正确的是
A.反应CH4+2O2 CO2+2H2O中,O2是氧化剂,CH4是还原剂
B.反应Cl2+2NaOH===NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是
还原剂
C.反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,HCl是氧化剂,
MnO2是还原剂
D.反应H2O2+2ClO2+2NaOH===2NaClO2+2H2O+O2中,H2O2是绿色
氧化剂
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
5.下列反应中必须加入还原剂才能进行的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
题组三 氧化还原反应的简单计算
9.(2021·安徽定远育才学校月考)在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂与还原剂的物质的量之比为
A.1∶8 B.8∶1
C.1∶5 D.5∶1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
10.对于反应CaH2+2H2O===Ca(OH)2+2H2↑,下列判断不正确的是
A.H2O为氧化剂
B.氧化产物和还原产物的分子数之比为1∶1
C.CaH2为还原剂,失电子被氧化
D.每生成1 mol H2,转移的电子数为2NA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.“神舟七号”载人飞船火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为R+2N2O4===3N2+4H2O+2CO2,下列叙述错误的是
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭升空
C.在反应中N2O4做还原剂
D.R的分子式为C2H8N2
√
12.高铁酸钾(K2FeO4)是一种新型、高效的水处理剂,制取高铁酸钾的一种方法为2Fe(OH)3+3Cl2+10KOH===2K2FeO4+6KCl+8H2O。下列关于该反应的说法错误的是
A.K2FeO4中铁元素化合价为+6价
B.生成1 mol K2FeO4时转移6 mol电子
C.Cl2是氧化剂
D.Fe(OH)3发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
13.(2021·山东新高考质量联盟联考)在焊接铜器时常用NH4Cl溶液除去铜器表面的氧化铜,其反应为CuO+NH4Cl→Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是
A.该反应中NH4Cl被还原
B.该反应中氧化剂和还原剂的物质的量之比为2∶3
C.该反应中产生0.1 mol N2时,转移0.6 mol电子
D.该反应中被还原的CuO占参与反应的CuO的
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
14.实验室可用KMnO4和浓盐酸反应制取氯气。其化学反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
(1)请将上述化学方程式改写为离子方程式:_______________________
__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10Cl-
===2Mn2++5Cl2↑+8H2O
(2)浓盐酸在反应中显示出来的性质是______(填序号)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
②
15.(1)下列变化一定加入还原剂才能实现的是______(填序号)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①③
(2)我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C===K2S+N2↑+3CO2↑,反应中被还原的物质是___________(填化学式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
S、KNO3
反应S+2KNO3+3C===K2S+N2↑+3CO2↑中,KNO3中N元素化合价由+5价降低为0价,S元素化合价由0价降低为-2价,所以KNO3、S是氧化剂,被还原。
(3)NaH可在野外作生氢剂,反应原理为NaH+H2O===NaOH+H2↑,该反应中氧化产物和还原产物的质量比为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1∶1
NaH+H2O===NaOH+H2↑,NaH中H元素化合价由-1价升高为0价,H2O中H元素化合价由+1价降低为0价,H2既是氧化产物又是还原产物,根据得失电子守恒,氧化产物和还原产物的质量之比为1∶1。
(4)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,用单线桥
标出电子转移的方向和数目:___________________________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
===2KCl+2MnCl2+
5Cl2↑+8H2O
