江苏省省熟中2023-2024学年高二上学期10月阶段性水平调研化学试题(含答案)
文档属性
| 名称 | 江苏省省熟中2023-2024学年高二上学期10月阶段性水平调研化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-20 22:46:25 | ||
图片预览


文档简介
江苏省省熟中2023-2024学年高二上学期10月阶段性水平调研
化学试题
(共100分,考试时间75分钟)
请将选择题答案填涂在答题卡上,非选择题答案填写在答题纸
单选题:本题包括14小题,每小题3分。
1.“3060”双碳目标的重点是推动以二氧化碳为主的温室气体减排,下列说法错误的是( )
A.研发新型催化剂将分解成和,同时放出热量
B.燃煤中适当添加石灰石,减少污染气体排放
C.一定条件下,将转化为,实现的资源化利用
D.逐步用太阳能、潮汐能、风能、氢能等清洁能源替代火力发电
2.在生产、生活中,金属腐蚀会带来严重的损失。下列事实与金属电化学腐蚀无关的是( )
A.铁制器件附有铜质配件,在接触处易生铁锈
B.金属钠置于空气中表面变暗
C.黄铜(铜锌合金)制作的铜锣不易产生铜绿
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
3.已知:
下列有关说法正确的是( )
A.的燃烧热为
B.
C.等质量的和完全燃烧,放出的热量多
D.
4.可逆反应在不同条件下的反应速率如下,其中反应速率最快的是( )
A. B.
C. D.
5.足量的粉与的稀硫酸充分反应。为了减慢此反应的速率而不改变的产量,可以采用如下方法中的( )
①加溶液 ②改用的稀盐酸
③减压 ④改用的硝酸
⑤冰水浴 ⑥加溶液
A.①②③④ B.①⑤ C.①⑤⑥ D.②⑤⑥
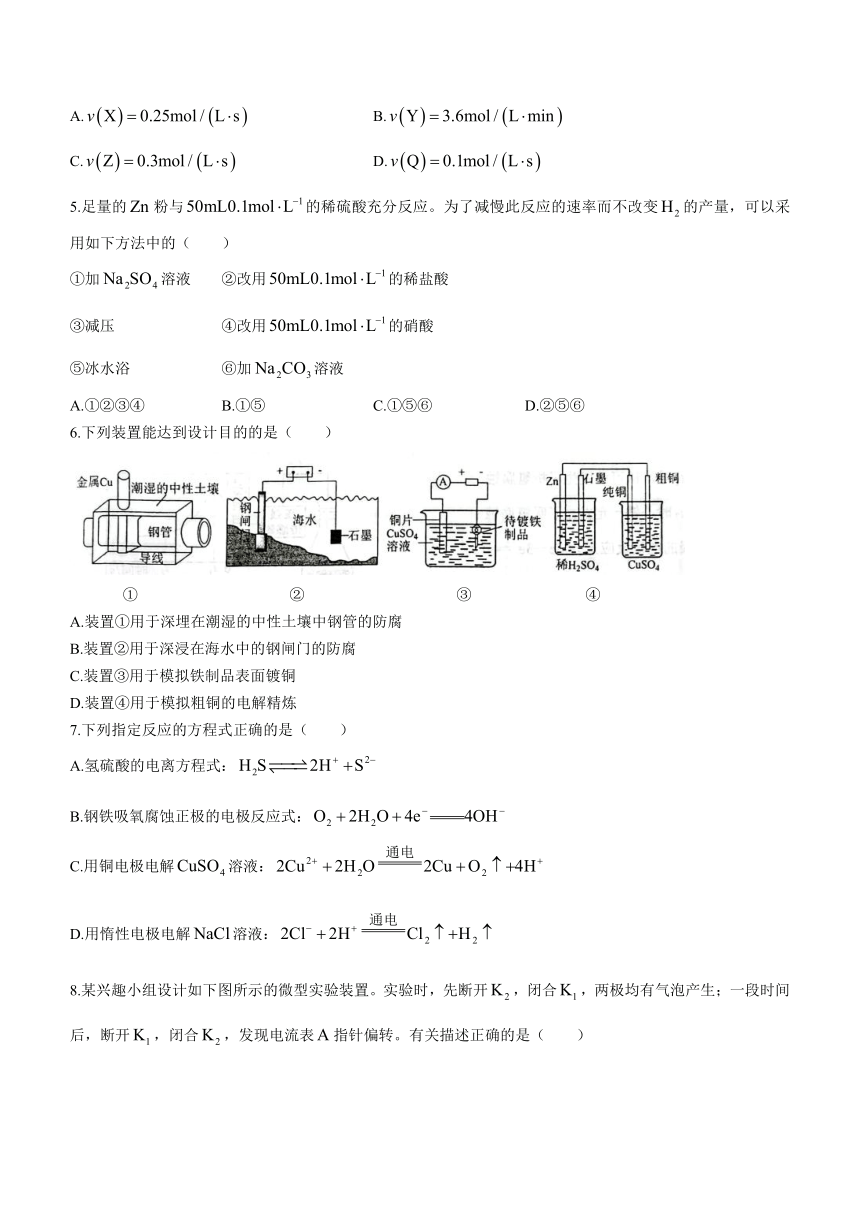
6.下列装置能达到设计目的的是( )
① ② ③ ④
A.装置①用于深埋在潮湿的中性土壤中钢管的防腐
B.装置②用于深浸在海水中的钢闸门的防腐
C.装置③用于模拟铁制品表面镀铜
D.装置④用于模拟粗铜的电解精炼
7.下列指定反应的方程式正确的是( )
A.氢硫酸的电离方程式:
B.钢铁吸氧腐蚀正极的电极反应式:
C.用铜电极电解溶液:
D.用惰性电极电解溶液:
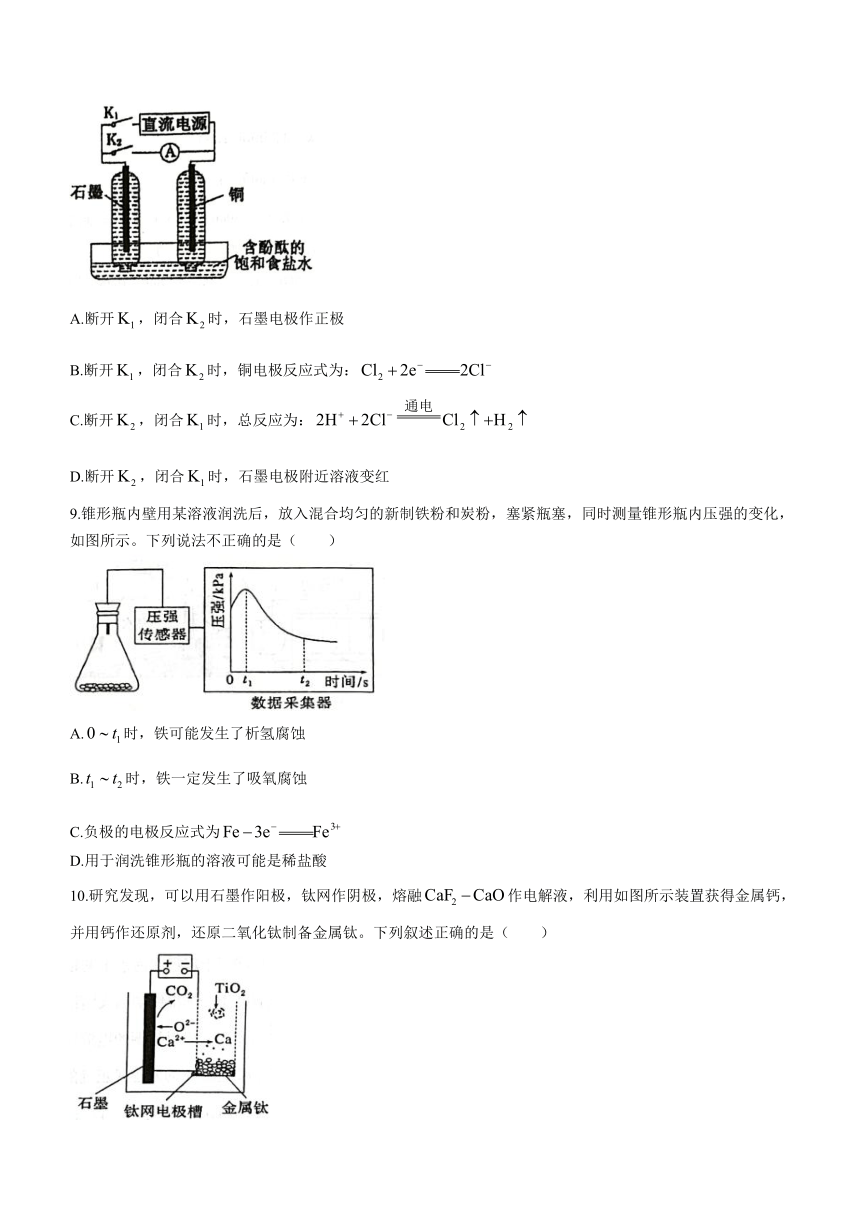
8.某兴趣小组设计如下图所示的微型实验装置。实验时,先断开,闭合,两极均有气泡产生;一段时间后,断开,闭合,发现电流表指针偏转。有关描述正确的是( )
A.断开,闭合时,石墨电极作正极
B.断开,闭合时,铜电极反应式为:
C.断开,闭合时,总反应为:
D.断开,闭合时,石墨电极附近溶液变红
9.锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和炭粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法不正确的是( )
A.时,铁可能发生了析氢腐蚀
B.时,铁一定发生了吸氧腐蚀
C.负极的电极反应式为
D.用于润洗锥形瓶的溶液可能是稀盐酸
10.研究发现,可以用石墨作阳极,钛网作阴极,熔融作电解液,利用如图所示装置获得金属钙,并用钙作还原剂,还原二氧化钛制备金属钛。下列叙述正确的是( )
A.该电池工作过程中,向阴极移动
B.将熔融换成溶液也可以达到相同目的
C.在阴极表面放电
D.制备金属钛前后的量不变
11.利用电化学装置实现和转化的原理如下图所示,下列说法正确的是( )
A.电极B上发生还原反应
B.从电极移向电极
C.阴极反应:
D.相同条件下,若生成的乙烯和乙烷的体积比为,则消耗的和体积比为
12.利用下图装置进行铁上电镀铜的实验探究。下列说法不正确的是( )
装置示意图 序号 电解质溶液 实验现象
① +少量 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
② +过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:、
C.随阴极析出,推测②阴极以铜离子得电子为主
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
13.用溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
A.为直流电源的负极,为直流电源的正极
B.阳极区增大
C.图中的
D.该过程中的产品主要为和
14.可活化制得,其反应历程如图所示:
下列关于活化历程的说法正确的是( )
A.总反应的
B.不是该反应的催化剂
C.“中间体1→中间体2”的活化能大于“中间体2→中间体3”
D.总反应的速率由“中间体1→中间体2”决定
15.氢能是具有广泛应用前景的新能源。
(1)下图1所示是时氢气在氯气中点燃生成氯化氢气体的能量变化示意图:
写出此反应的热化学方程式__________________。
(2)电解法制取,同时可获得氢气:,工作原理如图所示。已知:若溶液浓度过高,铁电极区会产生红褐色物质:只在强碱性条件下稳定,易被还原。
①电解时,电极发生的电极反应式为__________________。
②电解过程中,须将阴极产生的气体及时排出,主要原因是________________________。
③随初始的变化如图,则分别分析、点均低于最高值的可能的原因:点______;点______。
16.甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
(1)工业上可利用和生产甲醇,方程式如下:
又查资料得知:①
,则表示甲醇标准燃烧热的热化学方程式为__________________。
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为溶液(假设反应前后溶液体积不变),当向甲池通入物质和时,极附近呈红色。
①物质的化学式为______,电极的电极反应式为____________。
②乙装置中D电极方程式为__________________。
③丙装置中总反应的离子方程式为__________________。
④当乙装置中电极收集到(标况下)气体时,丙中溶液的______。
17.某同学用图中装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的______(填“正”或“负”)极相连,氢气从______(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则为______(填“阴离子”或“阳离子”,下同)交换膜,为______交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为__________________。
(4)若使用铅酸蓄电池作电源完成上述电解,当制得标准状况下的氢气时,理论上铅酸蓄电池消耗硫酸______,负极板质量增加______g。
18.含元素的部分物质对环境有影响。含、的废气会引起空气污染,含、、的废水会引起水体富营养化,都需要经过处理后才能排放。消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)利用电化学装置可消除氮氧化物污染,变废为宝。
①化学家正在研究尿素动力燃料电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
甲的电极反应式为__________________;理论上每净化尿素,消耗的体积约为______(标准状况下)。
②图为电解制备的装置。该装置中阴极的电极反应式为__________________;“反应室”中发生反应的离子方程式为__________________。
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如下图所示,写出电解时铁电极的电极反应式__________________。随后,铁电极附近有无色气体产生,可能原因是________________________。
(3)工业上以钛基氧化物涂层材料为阳极,碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使转变为,后续再将反应除去。②其他条件不变,只向混合溶液中投入一定量,后续去除的效果明显提高,溶液中氮元素含量显著降低。可能原因是________________________。
江苏省省熟中2023-2024学年高二上学期10月阶段性水平调研
参考答案
单选题:本题包括14小题,每小题3分
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A B C A B C B A C D D C B B
15(14分)
(1)H2(g)+Cl2(g)=2HCl(g) H=-183kJ·mol-1(3分)
(2)①Fe-6e-+8OH-=FeO42-+4H2O(2分)
②防止生成的Na2FeO4被H2还原,降低Na2FeO4的产率(3分)
③M点:c(OH-)低,Na2FeO4的稳定性差(3分);
N点:c(OH-)过高,铁电极区会产生Fe(OH)3,使c(Na2FeO4)降低(3分)
16(14分)
(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) H=(2Q1+3Q2+2Q3)kJ·mol-1(3分)
(2)①O2(2分)CH3OH-6e-+8OH-=CO32-+6H2O(3分)
②2H2O+2e-=H2↑+2OH-(2分)
③
④0.1mol·L-1(2分)
17(14分)
(1)正(2分) C(2分)
(2)阴离子(1分) 阳离子(1分) 增加水的导电性(2分)
(3)H2+2OH--2e-=2H2O(2分)
(4)1(2分) 48(2分)
18(16分)
(1)①CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+(2分) 33.6(2分)
②NO+5e-+6H+=NH4++H2O(2分)NH3+H+=NH4+(2分)
(2)Fe-2e-=Fe2+(2分)生成的亚铁离子将溶液中的NO2-还原成N2(3分)
(3)Cl-在阳极上失去电子生成Cl2,氯气具有强氧化性,可将NH4+氧化成N2,使溶液中氮元素的含量明显降低(3分)
化学试题
(共100分,考试时间75分钟)
请将选择题答案填涂在答题卡上,非选择题答案填写在答题纸
单选题:本题包括14小题,每小题3分。
1.“3060”双碳目标的重点是推动以二氧化碳为主的温室气体减排,下列说法错误的是( )
A.研发新型催化剂将分解成和,同时放出热量
B.燃煤中适当添加石灰石,减少污染气体排放
C.一定条件下,将转化为,实现的资源化利用
D.逐步用太阳能、潮汐能、风能、氢能等清洁能源替代火力发电
2.在生产、生活中,金属腐蚀会带来严重的损失。下列事实与金属电化学腐蚀无关的是( )
A.铁制器件附有铜质配件,在接触处易生铁锈
B.金属钠置于空气中表面变暗
C.黄铜(铜锌合金)制作的铜锣不易产生铜绿
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
3.已知:
下列有关说法正确的是( )
A.的燃烧热为
B.
C.等质量的和完全燃烧,放出的热量多
D.
4.可逆反应在不同条件下的反应速率如下,其中反应速率最快的是( )
A. B.
C. D.
5.足量的粉与的稀硫酸充分反应。为了减慢此反应的速率而不改变的产量,可以采用如下方法中的( )
①加溶液 ②改用的稀盐酸
③减压 ④改用的硝酸
⑤冰水浴 ⑥加溶液
A.①②③④ B.①⑤ C.①⑤⑥ D.②⑤⑥
6.下列装置能达到设计目的的是( )
① ② ③ ④
A.装置①用于深埋在潮湿的中性土壤中钢管的防腐
B.装置②用于深浸在海水中的钢闸门的防腐
C.装置③用于模拟铁制品表面镀铜
D.装置④用于模拟粗铜的电解精炼
7.下列指定反应的方程式正确的是( )
A.氢硫酸的电离方程式:
B.钢铁吸氧腐蚀正极的电极反应式:
C.用铜电极电解溶液:
D.用惰性电极电解溶液:
8.某兴趣小组设计如下图所示的微型实验装置。实验时,先断开,闭合,两极均有气泡产生;一段时间后,断开,闭合,发现电流表指针偏转。有关描述正确的是( )
A.断开,闭合时,石墨电极作正极
B.断开,闭合时,铜电极反应式为:
C.断开,闭合时,总反应为:
D.断开,闭合时,石墨电极附近溶液变红
9.锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和炭粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法不正确的是( )
A.时,铁可能发生了析氢腐蚀
B.时,铁一定发生了吸氧腐蚀
C.负极的电极反应式为
D.用于润洗锥形瓶的溶液可能是稀盐酸
10.研究发现,可以用石墨作阳极,钛网作阴极,熔融作电解液,利用如图所示装置获得金属钙,并用钙作还原剂,还原二氧化钛制备金属钛。下列叙述正确的是( )
A.该电池工作过程中,向阴极移动
B.将熔融换成溶液也可以达到相同目的
C.在阴极表面放电
D.制备金属钛前后的量不变
11.利用电化学装置实现和转化的原理如下图所示,下列说法正确的是( )
A.电极B上发生还原反应
B.从电极移向电极
C.阴极反应:
D.相同条件下,若生成的乙烯和乙烷的体积比为,则消耗的和体积比为
12.利用下图装置进行铁上电镀铜的实验探究。下列说法不正确的是( )
装置示意图 序号 电解质溶液 实验现象
① +少量 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
② +过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:、
C.随阴极析出,推测②阴极以铜离子得电子为主
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
13.用溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
A.为直流电源的负极,为直流电源的正极
B.阳极区增大
C.图中的
D.该过程中的产品主要为和
14.可活化制得,其反应历程如图所示:
下列关于活化历程的说法正确的是( )
A.总反应的
B.不是该反应的催化剂
C.“中间体1→中间体2”的活化能大于“中间体2→中间体3”
D.总反应的速率由“中间体1→中间体2”决定
15.氢能是具有广泛应用前景的新能源。
(1)下图1所示是时氢气在氯气中点燃生成氯化氢气体的能量变化示意图:
写出此反应的热化学方程式__________________。
(2)电解法制取,同时可获得氢气:,工作原理如图所示。已知:若溶液浓度过高,铁电极区会产生红褐色物质:只在强碱性条件下稳定,易被还原。
①电解时,电极发生的电极反应式为__________________。
②电解过程中,须将阴极产生的气体及时排出,主要原因是________________________。
③随初始的变化如图,则分别分析、点均低于最高值的可能的原因:点______;点______。
16.甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
(1)工业上可利用和生产甲醇,方程式如下:
又查资料得知:①
,则表示甲醇标准燃烧热的热化学方程式为__________________。
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为溶液(假设反应前后溶液体积不变),当向甲池通入物质和时,极附近呈红色。
①物质的化学式为______,电极的电极反应式为____________。
②乙装置中D电极方程式为__________________。
③丙装置中总反应的离子方程式为__________________。
④当乙装置中电极收集到(标况下)气体时,丙中溶液的______。
17.某同学用图中装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的______(填“正”或“负”)极相连,氢气从______(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则为______(填“阴离子”或“阳离子”,下同)交换膜,为______交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为__________________。
(4)若使用铅酸蓄电池作电源完成上述电解,当制得标准状况下的氢气时,理论上铅酸蓄电池消耗硫酸______,负极板质量增加______g。
18.含元素的部分物质对环境有影响。含、的废气会引起空气污染,含、、的废水会引起水体富营养化,都需要经过处理后才能排放。消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)利用电化学装置可消除氮氧化物污染,变废为宝。
①化学家正在研究尿素动力燃料电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
甲的电极反应式为__________________;理论上每净化尿素,消耗的体积约为______(标准状况下)。
②图为电解制备的装置。该装置中阴极的电极反应式为__________________;“反应室”中发生反应的离子方程式为__________________。
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如下图所示,写出电解时铁电极的电极反应式__________________。随后,铁电极附近有无色气体产生,可能原因是________________________。
(3)工业上以钛基氧化物涂层材料为阳极,碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使转变为,后续再将反应除去。②其他条件不变,只向混合溶液中投入一定量,后续去除的效果明显提高,溶液中氮元素含量显著降低。可能原因是________________________。
江苏省省熟中2023-2024学年高二上学期10月阶段性水平调研
参考答案
单选题:本题包括14小题,每小题3分
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A B C A B C B A C D D C B B
15(14分)
(1)H2(g)+Cl2(g)=2HCl(g) H=-183kJ·mol-1(3分)
(2)①Fe-6e-+8OH-=FeO42-+4H2O(2分)
②防止生成的Na2FeO4被H2还原,降低Na2FeO4的产率(3分)
③M点:c(OH-)低,Na2FeO4的稳定性差(3分);
N点:c(OH-)过高,铁电极区会产生Fe(OH)3,使c(Na2FeO4)降低(3分)
16(14分)
(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) H=(2Q1+3Q2+2Q3)kJ·mol-1(3分)
(2)①O2(2分)CH3OH-6e-+8OH-=CO32-+6H2O(3分)
②2H2O+2e-=H2↑+2OH-(2分)
③
④0.1mol·L-1(2分)
17(14分)
(1)正(2分) C(2分)
(2)阴离子(1分) 阳离子(1分) 增加水的导电性(2分)
(3)H2+2OH--2e-=2H2O(2分)
(4)1(2分) 48(2分)
18(16分)
(1)①CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+(2分) 33.6(2分)
②NO+5e-+6H+=NH4++H2O(2分)NH3+H+=NH4+(2分)
(2)Fe-2e-=Fe2+(2分)生成的亚铁离子将溶液中的NO2-还原成N2(3分)
(3)Cl-在阳极上失去电子生成Cl2,氯气具有强氧化性,可将NH4+氧化成N2,使溶液中氮元素的含量明显降低(3分)
同课章节目录
