第三单元 课题3 元素 同步练习(含解析) 2022-2023学年上学期河南省九年级化学期末试题选编
文档属性
| 名称 | 第三单元 课题3 元素 同步练习(含解析) 2022-2023学年上学期河南省九年级化学期末试题选编 |

|
|
| 格式 | docx | ||
| 文件大小 | 221.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 20:09:20 | ||
图片预览




文档简介
第三单元 课题3 元素 同步练习
一、单选题
1.(2022秋·河南新乡·九年级统考期末)“化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xī)”,如今把这种“矽”元素命名为
A.氧 B.硅 C.铝 D.铁
2.(2022秋·河南南阳·九年级期末)地壳中含量最多的金属元素符号是
A.Si B.Fe C.Al D.Ca
3.(2022秋·河南郑州·九年级统考期末)根据右图,下列关于钠元素的说法错误的是
A.钠的原子序数与核电荷数相等
B.质子数等于11的微粒一定属于钠元素
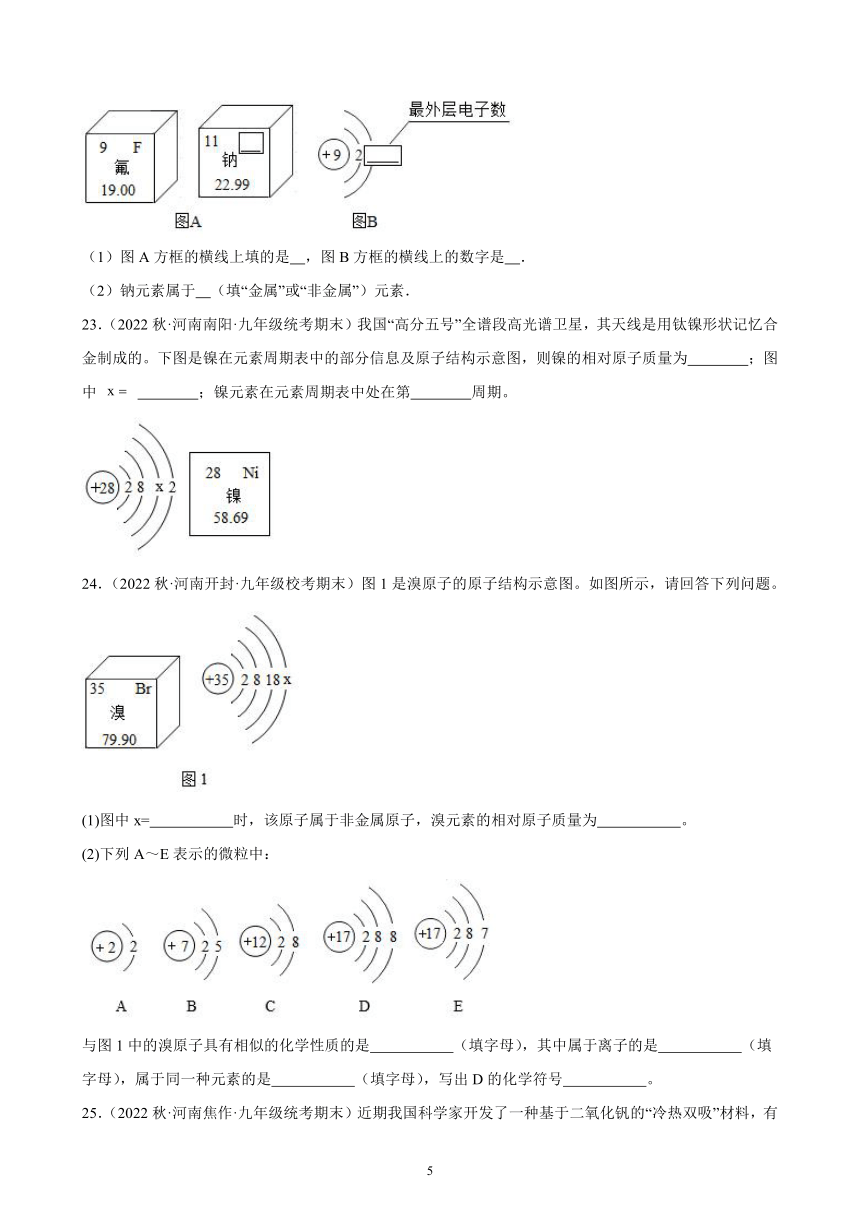
C.钠元素与其他元素最本质的区别是质子数不同
D.与钠元素的化学性质关系最密切的是钠原子的最外层电子数
4.(2022秋·河南周口·九年级统考期末)硅是信息技术的关键材料。下图为硅的原子结构示意图。下列说法正确的是
A.硅属于稀有气体元素 B.图中n的值为8
C.硅的相对原子质量为14 D.硅元素位于第三周期
5.(2022秋·河南郑州·九年级期末)一种元素与另一种元素的本质区别是
A.中子数不同 B.质子数不同 C.电子数不同 D.最外层电子数不同
6.(2022秋·河南开封·九年级校考期末)自然界中的物质都是由元素组成的,为了表达方便,国际上统一采用了元素符号来表示物质的组成。下列元素名称与其符号都正确的一组是
A.铝Cl 氢H B.氟F 贡Hg C.锌Zn 铍Be D.猛Mn 碘I
7.(2022秋·河南洛阳·九年级统考期末)既可以表示一种物质,又可以表示一种元素,还能表示一个原子的符号是
A.Cu B.O C.Ca+ D.Cl-
8.(2022秋·河南许昌·九年级期末)市场上销售的加碘食盐、含氟牙膏、高钙牛奶等,这里的碘、氟、钙是指
A.单质 B.分子 C.元素 D.原子
9.(2022秋·河南信阳·九年级统考期末)下列关于铕的说法中正确的是
A.原子序数为63 B.属于非金属元素
C.原子核外电子数为89 D.相对原子质量为152.0g
10.(2022秋·河南焦作·九年级校考期末)中国是世界稀土资源最丰富的国家。稀土是极其重要的战略资源,铈(Ce)是一种常见的稀土元素。下图是元素周期表中铈元素的相关信息,下列说法不正确的是
A.铈属于非金属元素 B.铈的原子序数为58
C.铈原子的核电荷数为58 D.铈的相对原子质量是140.1
11.(2022秋·河南许昌·九年级期末)下图是X原子的结构示意图和X元素在元素周期表中的信息。下列关于X的说法正确的是
A.X原子失电子后形成的离子是X3-
B.X元素的相对原子质量是26.98g
C.X原子的原子核内中子数为13
D.X元素位于元素周期表中的第三周期
二、课内填空
12.(2022秋·河南南阳·九年级统考期末)空气中体积分数约为78%的气体是 ,地壳中含量最高的非金属元素和金属元素组成的化合物是 。
三、填空题
13.(2022秋·河南周口·九年级统考期末)在空气中含量高且化学性质不活泼的气体是 ;地壳中含量最高的金属元素是 ;形成化合物种类最多的元素是 。
14.(2022秋·河南南阳·九年级统考期末)回答下列问题。
(1)如图为某元素的原子结构示意图,该元素位于周期表中第 周期第ⅢA族。
(2)不同种元素最本质的区别是 。
15.(2022秋·河南平顶山·九年级统考期末)下图是A、B、C三种元素的相关信息。
(1)C元素的原子序数是 。
(2)A、B、C属于不同种元素的依据是 。
(3)化学性质相似的元素是 (填元素符号)。
16.(2022秋·河南信阳·九年级统考期末)用化学用语表示:
(1)7个钾原子 ;
(2)2个硫酸根离子 ;
(3)画出铝的原子结构示意图 。
17.(2022秋·河南信阳·九年级统考期末)根据下图提供的信息,回答相关问题。
(1)E原子中X为 。
(2)3个镁离子用化学符号表示为 。
(3)写出B、D两种微粒组成化合物的化学式 。
18.(2022秋·河南周口·九年级统考期末)地壳中含量最高的金属元素是 (填元素符号) ;硫酸铜的构成微粒有Cu2+和 (填离子符号) 。
19.(2022秋·河南周口·九年级期末)α﹣丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示.
(注:“”表示氮原子;“”表示碳原子;“”表示氧原子;“”表示氢原子,“﹣”表示原子之间相互连接.)
则α﹣丙氨酸中含有 种元素,其中碳、氧2种元素质量比为 ,其相对分子质量是 .
20.(2022秋·河南三门峡·九年级统考期末)如图Ⅰ是元素周期表中的一部分。这三种元素位于第 周期;等质量的这三种元素中所含原子个数最少的是 (填元素 符号,下同);这三种元素中与图Ⅱ原子位于 同一族的是 。
21.(2022秋·河南驻马店·九年级校考期末)研究表明,月球土壤中有数百万吨的氦-3.氦-3元素属于 (填“金属元素”、“非金属元素”或“稀有气体元素”),氦-3原子中质子数为2,中子数为1.则其原子结构示意图为下图中的 (填字母)。
22.(2022秋·河南郑州·九年级期末)图A是两种元素在元素周期表中的信息,图B是氟原子的原子结构示意图.
(1)图A方框的横线上填的是 ,图B方框的横线上的数字是 .
(2)钠元素属于 (填“金属”或“非金属”)元素.
23.(2022秋·河南南阳·九年级统考期末)我国“高分五号”全谱段高光谱卫星,其天线是用钛镍形状记忆合金制成的。下图是镍在元素周期表中的部分信息及原子结构示意图,则镍的相对原子质量为 ;图中 ;镍元素在元素周期表中处在第 周期。
24.(2022秋·河南开封·九年级校考期末)图1是溴原子的原子结构示意图。如图所示,请回答下列问题。
(1)图中x= 时,该原子属于非金属原子,溴元素的相对原子质量为 。
(2)下列A~E表示的微粒中:
与图1中的溴原子具有相似的化学性质的是 (填字母),其中属于离子的是 (填字母),属于同一种元素的是 (填字母),写出D的化学符号 。
25.(2022秋·河南焦作·九年级统考期末)近期我国科学家开发了一种基于二氧化钒的“冷热双吸”材料,有望助力实现“双碳”目标。钒元素在周期表中的信息及原子结构示意图如图所示,该示意图中的x为 ;钒的相对原子质量为 ;钒元素在元素周期表中位于第 周期。
26.(2022秋·河南周口·九年级校考期末)图1是铝元素在元素周期表中的相关信息,图2是几种微粒的结构示意图。回答下列问题:
(1)铝的相对原子质量为 。
(2)图2中,B所对应的元素位于元素周期表的第 周期。
(3)铝元素和镁元素的本质区别是 。
27.(2022秋·河南商丘·九年级统考期末)根据下列图示回答问题:
(1)图1是氯离子的结构示意图,X的值是 ,氯元素的原子序数是 。
(2)图2是元素周期表中的部分信息,甲的原子序数 (选填“大于”或“小于”)乙的原子序数。同时,由图1、图2可推测出氟原子的最外层电子数为 。
28.(2022秋·河南濮阳·九年级校联考期末)芯片是电脑、手机等的核心部件,碳基芯片采用石墨烯碳纳米管工艺,性能比硅基芯片更好,我国已突破半导体碳纳米管关键材料的技术瓶颈。请回答:
如图是硅元素在元素周期表中的部分信息及原子结构示意图,图中a= ,硅元素位于元素周期表中的第 周期;硅元素属于 (填“金属”或“非金属”)元素。
29.(2022秋·河南三门峡·九年级统考期末)如图为元素周期表中部分元素的相关信息以及A、B、C三种粒子的结构示意图。
(1)X的值为 。
(2)A、B、C三种粒子中,属于阳离子的是 (填离子符号)。
(3)图甲中与C粒子化学性质相似的是 (填元素符号)。
参考答案:
1.B
【详解】地壳中含量第二的元素是硅元素,故选B。
2.C
【详解】地壳中含量最多的前五种元素有:O、Si、Al、Fe、Ca,金属元素是汉字中带钅字旁的元素(金与汞除外),所以含量最多的金属元素是Al。故选C。
3.B
【详解】A、原子序数=核电荷数=质子数,选项说法正确,不符合题意;
B、质子数相同的微粒不一定属于同种元素,微粒种类很多种,当微粒为多原子分子或多原子离子时,就不是同种元素了,说法错误,符合题意;
C、元素的定义:是具有相同质子数(核电荷数)的同一类原子的总称,所以钠元素与其他元素最本质的区别是质子数不同,选项说法正确,不符合题意;
D、原子的最外层电子数决定化学性质,选项说法正确,不符合题意。
故选B。
4.D
【详解】A、由固态非金属元素名称有“石”字旁可知,硅属于固态非金属元素,错误;B、由原子中质子数=电子数可得,n=14-2-8=4,错误;C、硅的相对原子质量为28,错误;D、由原子结构中电子层数等于元素所在周期数可得,硅元素位于第三周期,正确。故选D。
5.B
【详解】利用元素的定义是具有核电荷数相同的同一类原子的总称的知识解决此题。
元素是具有核电荷数相同的同一类原子的总称,在原子中核电荷数等于质子数,故不同的元素质子数一定不同。
故选B。
点睛:不同元素的本质区别。
6.C
【详解】A.铝Al,氢H,选项错误;
B.氟F,汞Hg,选项错误;
C.锌Zn,铍Be,选项正确;
D.锰Mn,碘I,选项错误。
故选:C。
7.A
【详解】A、Cu为金属,由原子构成,故符号Cu既可以表示一种物质,又可以表示一种元素,还能表示一个原子,正确;
B、氧气是由分子构成的物质,故符号O可以表示一种元素,还能表示一个原子,但不能表示一种物质,不符合题意;
C、Ca+为错误的离子符号,应写为Ca2+,不符合题意;
D、Cl-为氯离子的符号,也可表示一个氯离子,不符合题意。
故选A。
8.C
【详解】这里的碘、氟、钙是指物质的组成,指的是组成物质的元素,故选C。
9.A
【详解】A、在元素周期表中,元素名称左上角的数字表示原子序数,故铕的原子序数是63,符合题意;
B、由“金”字旁可知,铕属于金属元素,不符合题意;
C、在原子中,原子序数=质子数=核外电子数,故铕的原子核外电子数为63,不符合题意;
D、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故铕的相对原子质量为152.0,不符合题意。
故选A。
10.A
【分析】根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可。
【详解】A、由图中信息铈的金字边旁可知,铈属于金属元素,故选项错误;
B、由图中信息可知,铈原子的质子数是58,故选项正确;
C、由图中信息,铈原子的原子序数为58,因为原子序数=核电荷数=质子数,所以核电荷数也为58,故选项正确;
D、由图中信息,铈原子的相对原子质量是140.1,故选项正确。
故选A。
【点睛】元素周期表反映了元素之间的内在联系,要注意理解和应用。
11.D
【详解】A、X原子最外层电子数是3,在化学反应中易失去3个电子而形成阳离子,失电子后形成的离子是X3+,故选项说法错误;
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,元素的相对原子质量为26.98,相对原子质量单位是“1”,不是“g”,故选项说法错误;
C、元素相对原子质量在数值上近似等于质子数加中子数,所以X原子的核内中子数=27-13=14,故选项说法错误;
D、根据X原子的原子结构示意图可知,X原子核外有3个电子层,则X元素位于元素周期表中的第三周期,故选项说法正确;
故选D。
12. 氮气/N2 氧化铝/Al2O3
【详解】空气中体积分数约为78%的气体是氮气;地壳中含量最高的非金属元素是氧元素,含量最高的金属元素是铝元素,二者组成的化合物是氧化铝。
13. 氮气/N2 铝元素/铝/Al 碳元素/碳/C
【详解】氮气约占空气体积的78%,含量高,且化学性质比较稳定,故填:氮气或N2;
地壳中元素含量由多到少依次是(前四位):O、Si、Al、Fe,故含量最高的金属元素是铝元素;
人类已经发现的物质中,绝大部分属于有机物,有机物中都含有碳元素,所以形成化合物种类最多的元素是碳元素。
14.(1)三
(2)质子数(或核电荷数)不同
【详解】(1)该元素的原子结构示意图表明该原子有3个电子层,所以该元素位于周期表中第三周期。
(2)元素是质子数(即核电荷数)相同的一类原子的总称,所以不同种元素最本质的区别是质子数不同或核电荷数不同。
15. 17 核内质子数不同 O、S
【详解】(1)在原子中,原子序数=核电荷数=核外电子数,x=2+8+7=17,所以C元素的原子序数是17;
(2)元素是质子数相同的一类原子的总称,质子数不同,元素的种类也不同,所以A、B、C属于不同种元素的依据是核内质子数不同;
(3)原子的最外层电子数相同,则元素的化学性质相似,A和B最外层电子数相同,A的质子数为8,是氧元素,B的质子数为16,是硫元素,所以化学性质相似的元素是O、S。
16.(1)7K
(2)
(3)
【详解】(1)原子用元素符号表示,多个原子就是在元素符号前面加上相应的数字,故7个钾原子表示为:7K;
(2)离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故2个硫酸根离子表示为:;
(3)在原子中,质子数=原子序数=核外电子数,故铝原子核外第一层有2个电子,第二层有8个电子,第三层有3个电子,故铝的原子结构示意图为: 。
17.(1)6
(2)3Mg2+
(3)MgCl2
【详解】(1)对于原子而言,核电荷数=核外电子数,故16=2+8+x,解得x=6;
(2)离子的表示方法为:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其元素符号前加上相应的数字,故3个镁离子可表示为:3Mg2+;
(3)B是Mg2+,D是Cl-,两者可以组成氯化镁化合物,其化学式为MgCl2。
18. Al
【详解】地壳含量较多的元素前四种按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,元素符号为Al。
离子的表示方法:在表示该离子的元素符合右上角,标出该离子所带的正负电核数,数字在前,正负符号在后,带1个电荷时,1要省略;构成硫酸铜的微粒有铜离子和硫酸根离子,硫酸根离子的符号为。
19. 四 9:8 89
【详解】由题中信息知,α﹣丙氨酸中含有C,N,H,O四种元素,其中碳、氧2种元素质量比为12×3∶2×16=9:8,其相对分子质量是12×3+2×16+14+7=89.
点睛∶本题主要考查α﹣丙氨酸的组成,相对分子质量等知识。
20. 三 Si Al
【详解】三种元素的原子核外都有三个电子层,则三种元素位于元素周期表中的第三周期,故填三;
等质量的元素中,原子的数目与相对原子质量成反比,三种元素的相对原子质量的大小关系为镁<铝<硅,则质量的这三种元素中所含原子个数最少的是硅元素,其元素符号为Si,故填Si;
由图II可知,m=31 2 8 18=3,与铝原子的最外层电子数相同,所以三种元素中与图Ⅱ原子位于同一族的是铝元素,其元素符号为Al,故填Al。
21. 稀有气体元素 A
【详解】氦、氖、氩等气体属于稀有气体,氦-3元素属于稀有气体元素,氦-3原子中质子数为2,中子数为1,则原子核内有2个正电荷,氦原子结构示意图为A。
22. Na 7 金属
【详解】(1)元素周期表中每一小格的右上角是元素符号,钠的元素符号为Na;原子中,质子数=核外电子数,图B方框的横线上的数字是9-2=7;
(2)钠元素属于金属元素,根据偏旁可以判断出。
23. 58.69 16 四/4
【详解】元素周期表一格中最下方的数字就是元素原子的相对原子质量,由图可知,镍的相对原子质量为58.69,故填58.69;原子中,核内质子数等于核外电子数,所以x=28 2 8 16=2,故填2;电子层数等于周期数,由图可知,镍原子的核外有4个电子层,所以镍元素在元素周期表中处在第四周期,故填四或4。
24.(1) 7 79.90
(2) E CD/DC DE/ED Cl-
【详解】(1)根据在原子中,质子数=核外电子数,则有当35=2+8+18+x时,该原子属于非金属原子,解得x=7;
由元素周期表中的一格可知,汉字下方的数字表示的是该元素的相对原子质量,故溴元素的相对原子质量为79.90;
(2)最外层电子数相同的粒子具有相似的化学性质,Br粒子的最外层电子数为7,故与图1中的溴原子具有相似的化学性质的是E;
当质子数≠核外电子数时,表示的是离子,故其中属于离子的是CD;
元素是具有相同质子数(即核电荷数)的一类原子的总称,图示中DE质子数相同,属于同一种元素;
D中质子数为17,核外电子数为2+8+8=18,质子数<核外电子数,表示的是阴离子(氯离子),化学符号为Cl-。
25. 2 50.94 4/四
【详解】在原子中,质子数=核外电子数,故23=2+8+11+x,解得x=2;在元素周期表的每一个小方格中,元素名称下面的数字为相对原子质量,故钒的相对原子质量为50.94;在元素周期表中,元素所处的周期数等于其原子的电子层数,由钒原子的原子结构示意图可知,其原子核外有4个电子层,故钒元素在元素周期表中位于第四周期。
【点睛】在元素周期表中,元素所处的周期数等于其原子的电子层数。
26.(1)26.98
(2)三/3
(3)质子数不同/核电荷数不同
【详解】(1)在元素周期表中,元素名称下方的数字表示相对原子质量,根据图1中元素周期表可知:铝的相对原子质量为26.98;
(2)电子层数决定周期数,B质子数大于核外电子数,故是原子失去最外层电子后形成的,其原子核外有3个电子层,所对应的元素位于元素周期表的第三周期;
(3)元素是质子数相同的一类原子的总称,故铝元素和镁元素的本质区别是质子数不同。
27.(1) 8 17
(2) 小于 7
【详解】(1)氯原子的核电荷数为17,原子最外层有7个电子,易得到1个电子形成带有1个单位负电荷的阴离子,因此X的值是8;原子中原子序数等于质子数等于核电荷数,故氯元素的原子序数是17;故填:8;17;
(2)同一周期从左到右,原子序数逐渐增大,氯为17号元素,所以甲的原子序数为16,乙的原子序数为18,即甲的原子序数小于乙的原子序数;氯元素、氟元素属于同一主族元素,原子的最外层电子数相同,因此氟原子的最外层电子数为7;故填:小于;7。
28. 14 3/三 非金属
【详解】原子序数等于核内质子数,所以a=14;元素周期数等于原子核外电子层数,硅元素位于元素周期表中的第三周期;硅的偏旁是石字旁,属于固体非金属元素。
29.(1)15
(2)Mg2+
(3)O
【详解】(1)元素周期表同一族,原子的最外层电子数相同;元素周期表同一周期,原子的电子层数相同,下一个周期比上一个周期多一个电子层;氮原子结构示意图为:,处于元素周期表中的第二周期,磷原子与氮原子处在同一族,磷原子处在第三周期,因此磷原子结构示意图为:,X=2+8+5=15;
(2)A、9<2+8=10,核外电子数大于核内质子数,该粒子带负电,属于阴离子;
B、12>2+8=10,核内质子数大于核外电子数,该粒子带正电,属于阳离子,符号为Mg2+;
C、16=2+8+6=16,核内质子数等于核外电子数,属于原子;
(3)最外层电子数相同,化学性质相似,C粒子最外层电子数为6,图甲中氧的最外层电子数为6,故图甲中与C粒子化学性质相似的是O。
一、单选题
1.(2022秋·河南新乡·九年级统考期末)“化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xī)”,如今把这种“矽”元素命名为
A.氧 B.硅 C.铝 D.铁
2.(2022秋·河南南阳·九年级期末)地壳中含量最多的金属元素符号是
A.Si B.Fe C.Al D.Ca
3.(2022秋·河南郑州·九年级统考期末)根据右图,下列关于钠元素的说法错误的是
A.钠的原子序数与核电荷数相等
B.质子数等于11的微粒一定属于钠元素
C.钠元素与其他元素最本质的区别是质子数不同
D.与钠元素的化学性质关系最密切的是钠原子的最外层电子数
4.(2022秋·河南周口·九年级统考期末)硅是信息技术的关键材料。下图为硅的原子结构示意图。下列说法正确的是
A.硅属于稀有气体元素 B.图中n的值为8
C.硅的相对原子质量为14 D.硅元素位于第三周期
5.(2022秋·河南郑州·九年级期末)一种元素与另一种元素的本质区别是
A.中子数不同 B.质子数不同 C.电子数不同 D.最外层电子数不同
6.(2022秋·河南开封·九年级校考期末)自然界中的物质都是由元素组成的,为了表达方便,国际上统一采用了元素符号来表示物质的组成。下列元素名称与其符号都正确的一组是
A.铝Cl 氢H B.氟F 贡Hg C.锌Zn 铍Be D.猛Mn 碘I
7.(2022秋·河南洛阳·九年级统考期末)既可以表示一种物质,又可以表示一种元素,还能表示一个原子的符号是
A.Cu B.O C.Ca+ D.Cl-
8.(2022秋·河南许昌·九年级期末)市场上销售的加碘食盐、含氟牙膏、高钙牛奶等,这里的碘、氟、钙是指
A.单质 B.分子 C.元素 D.原子
9.(2022秋·河南信阳·九年级统考期末)下列关于铕的说法中正确的是
A.原子序数为63 B.属于非金属元素
C.原子核外电子数为89 D.相对原子质量为152.0g
10.(2022秋·河南焦作·九年级校考期末)中国是世界稀土资源最丰富的国家。稀土是极其重要的战略资源,铈(Ce)是一种常见的稀土元素。下图是元素周期表中铈元素的相关信息,下列说法不正确的是
A.铈属于非金属元素 B.铈的原子序数为58
C.铈原子的核电荷数为58 D.铈的相对原子质量是140.1
11.(2022秋·河南许昌·九年级期末)下图是X原子的结构示意图和X元素在元素周期表中的信息。下列关于X的说法正确的是
A.X原子失电子后形成的离子是X3-
B.X元素的相对原子质量是26.98g
C.X原子的原子核内中子数为13
D.X元素位于元素周期表中的第三周期
二、课内填空
12.(2022秋·河南南阳·九年级统考期末)空气中体积分数约为78%的气体是 ,地壳中含量最高的非金属元素和金属元素组成的化合物是 。
三、填空题
13.(2022秋·河南周口·九年级统考期末)在空气中含量高且化学性质不活泼的气体是 ;地壳中含量最高的金属元素是 ;形成化合物种类最多的元素是 。
14.(2022秋·河南南阳·九年级统考期末)回答下列问题。
(1)如图为某元素的原子结构示意图,该元素位于周期表中第 周期第ⅢA族。
(2)不同种元素最本质的区别是 。
15.(2022秋·河南平顶山·九年级统考期末)下图是A、B、C三种元素的相关信息。
(1)C元素的原子序数是 。
(2)A、B、C属于不同种元素的依据是 。
(3)化学性质相似的元素是 (填元素符号)。
16.(2022秋·河南信阳·九年级统考期末)用化学用语表示:
(1)7个钾原子 ;
(2)2个硫酸根离子 ;
(3)画出铝的原子结构示意图 。
17.(2022秋·河南信阳·九年级统考期末)根据下图提供的信息,回答相关问题。
(1)E原子中X为 。
(2)3个镁离子用化学符号表示为 。
(3)写出B、D两种微粒组成化合物的化学式 。
18.(2022秋·河南周口·九年级统考期末)地壳中含量最高的金属元素是 (填元素符号) ;硫酸铜的构成微粒有Cu2+和 (填离子符号) 。
19.(2022秋·河南周口·九年级期末)α﹣丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示.
(注:“”表示氮原子;“”表示碳原子;“”表示氧原子;“”表示氢原子,“﹣”表示原子之间相互连接.)
则α﹣丙氨酸中含有 种元素,其中碳、氧2种元素质量比为 ,其相对分子质量是 .
20.(2022秋·河南三门峡·九年级统考期末)如图Ⅰ是元素周期表中的一部分。这三种元素位于第 周期;等质量的这三种元素中所含原子个数最少的是 (填元素 符号,下同);这三种元素中与图Ⅱ原子位于 同一族的是 。
21.(2022秋·河南驻马店·九年级校考期末)研究表明,月球土壤中有数百万吨的氦-3.氦-3元素属于 (填“金属元素”、“非金属元素”或“稀有气体元素”),氦-3原子中质子数为2,中子数为1.则其原子结构示意图为下图中的 (填字母)。
22.(2022秋·河南郑州·九年级期末)图A是两种元素在元素周期表中的信息,图B是氟原子的原子结构示意图.
(1)图A方框的横线上填的是 ,图B方框的横线上的数字是 .
(2)钠元素属于 (填“金属”或“非金属”)元素.
23.(2022秋·河南南阳·九年级统考期末)我国“高分五号”全谱段高光谱卫星,其天线是用钛镍形状记忆合金制成的。下图是镍在元素周期表中的部分信息及原子结构示意图,则镍的相对原子质量为 ;图中 ;镍元素在元素周期表中处在第 周期。
24.(2022秋·河南开封·九年级校考期末)图1是溴原子的原子结构示意图。如图所示,请回答下列问题。
(1)图中x= 时,该原子属于非金属原子,溴元素的相对原子质量为 。
(2)下列A~E表示的微粒中:
与图1中的溴原子具有相似的化学性质的是 (填字母),其中属于离子的是 (填字母),属于同一种元素的是 (填字母),写出D的化学符号 。
25.(2022秋·河南焦作·九年级统考期末)近期我国科学家开发了一种基于二氧化钒的“冷热双吸”材料,有望助力实现“双碳”目标。钒元素在周期表中的信息及原子结构示意图如图所示,该示意图中的x为 ;钒的相对原子质量为 ;钒元素在元素周期表中位于第 周期。
26.(2022秋·河南周口·九年级校考期末)图1是铝元素在元素周期表中的相关信息,图2是几种微粒的结构示意图。回答下列问题:
(1)铝的相对原子质量为 。
(2)图2中,B所对应的元素位于元素周期表的第 周期。
(3)铝元素和镁元素的本质区别是 。
27.(2022秋·河南商丘·九年级统考期末)根据下列图示回答问题:
(1)图1是氯离子的结构示意图,X的值是 ,氯元素的原子序数是 。
(2)图2是元素周期表中的部分信息,甲的原子序数 (选填“大于”或“小于”)乙的原子序数。同时,由图1、图2可推测出氟原子的最外层电子数为 。
28.(2022秋·河南濮阳·九年级校联考期末)芯片是电脑、手机等的核心部件,碳基芯片采用石墨烯碳纳米管工艺,性能比硅基芯片更好,我国已突破半导体碳纳米管关键材料的技术瓶颈。请回答:
如图是硅元素在元素周期表中的部分信息及原子结构示意图,图中a= ,硅元素位于元素周期表中的第 周期;硅元素属于 (填“金属”或“非金属”)元素。
29.(2022秋·河南三门峡·九年级统考期末)如图为元素周期表中部分元素的相关信息以及A、B、C三种粒子的结构示意图。
(1)X的值为 。
(2)A、B、C三种粒子中,属于阳离子的是 (填离子符号)。
(3)图甲中与C粒子化学性质相似的是 (填元素符号)。
参考答案:
1.B
【详解】地壳中含量第二的元素是硅元素,故选B。
2.C
【详解】地壳中含量最多的前五种元素有:O、Si、Al、Fe、Ca,金属元素是汉字中带钅字旁的元素(金与汞除外),所以含量最多的金属元素是Al。故选C。
3.B
【详解】A、原子序数=核电荷数=质子数,选项说法正确,不符合题意;
B、质子数相同的微粒不一定属于同种元素,微粒种类很多种,当微粒为多原子分子或多原子离子时,就不是同种元素了,说法错误,符合题意;
C、元素的定义:是具有相同质子数(核电荷数)的同一类原子的总称,所以钠元素与其他元素最本质的区别是质子数不同,选项说法正确,不符合题意;
D、原子的最外层电子数决定化学性质,选项说法正确,不符合题意。
故选B。
4.D
【详解】A、由固态非金属元素名称有“石”字旁可知,硅属于固态非金属元素,错误;B、由原子中质子数=电子数可得,n=14-2-8=4,错误;C、硅的相对原子质量为28,错误;D、由原子结构中电子层数等于元素所在周期数可得,硅元素位于第三周期,正确。故选D。
5.B
【详解】利用元素的定义是具有核电荷数相同的同一类原子的总称的知识解决此题。
元素是具有核电荷数相同的同一类原子的总称,在原子中核电荷数等于质子数,故不同的元素质子数一定不同。
故选B。
点睛:不同元素的本质区别。
6.C
【详解】A.铝Al,氢H,选项错误;
B.氟F,汞Hg,选项错误;
C.锌Zn,铍Be,选项正确;
D.锰Mn,碘I,选项错误。
故选:C。
7.A
【详解】A、Cu为金属,由原子构成,故符号Cu既可以表示一种物质,又可以表示一种元素,还能表示一个原子,正确;
B、氧气是由分子构成的物质,故符号O可以表示一种元素,还能表示一个原子,但不能表示一种物质,不符合题意;
C、Ca+为错误的离子符号,应写为Ca2+,不符合题意;
D、Cl-为氯离子的符号,也可表示一个氯离子,不符合题意。
故选A。
8.C
【详解】这里的碘、氟、钙是指物质的组成,指的是组成物质的元素,故选C。
9.A
【详解】A、在元素周期表中,元素名称左上角的数字表示原子序数,故铕的原子序数是63,符合题意;
B、由“金”字旁可知,铕属于金属元素,不符合题意;
C、在原子中,原子序数=质子数=核外电子数,故铕的原子核外电子数为63,不符合题意;
D、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故铕的相对原子质量为152.0,不符合题意。
故选A。
10.A
【分析】根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可。
【详解】A、由图中信息铈的金字边旁可知,铈属于金属元素,故选项错误;
B、由图中信息可知,铈原子的质子数是58,故选项正确;
C、由图中信息,铈原子的原子序数为58,因为原子序数=核电荷数=质子数,所以核电荷数也为58,故选项正确;
D、由图中信息,铈原子的相对原子质量是140.1,故选项正确。
故选A。
【点睛】元素周期表反映了元素之间的内在联系,要注意理解和应用。
11.D
【详解】A、X原子最外层电子数是3,在化学反应中易失去3个电子而形成阳离子,失电子后形成的离子是X3+,故选项说法错误;
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,元素的相对原子质量为26.98,相对原子质量单位是“1”,不是“g”,故选项说法错误;
C、元素相对原子质量在数值上近似等于质子数加中子数,所以X原子的核内中子数=27-13=14,故选项说法错误;
D、根据X原子的原子结构示意图可知,X原子核外有3个电子层,则X元素位于元素周期表中的第三周期,故选项说法正确;
故选D。
12. 氮气/N2 氧化铝/Al2O3
【详解】空气中体积分数约为78%的气体是氮气;地壳中含量最高的非金属元素是氧元素,含量最高的金属元素是铝元素,二者组成的化合物是氧化铝。
13. 氮气/N2 铝元素/铝/Al 碳元素/碳/C
【详解】氮气约占空气体积的78%,含量高,且化学性质比较稳定,故填:氮气或N2;
地壳中元素含量由多到少依次是(前四位):O、Si、Al、Fe,故含量最高的金属元素是铝元素;
人类已经发现的物质中,绝大部分属于有机物,有机物中都含有碳元素,所以形成化合物种类最多的元素是碳元素。
14.(1)三
(2)质子数(或核电荷数)不同
【详解】(1)该元素的原子结构示意图表明该原子有3个电子层,所以该元素位于周期表中第三周期。
(2)元素是质子数(即核电荷数)相同的一类原子的总称,所以不同种元素最本质的区别是质子数不同或核电荷数不同。
15. 17 核内质子数不同 O、S
【详解】(1)在原子中,原子序数=核电荷数=核外电子数,x=2+8+7=17,所以C元素的原子序数是17;
(2)元素是质子数相同的一类原子的总称,质子数不同,元素的种类也不同,所以A、B、C属于不同种元素的依据是核内质子数不同;
(3)原子的最外层电子数相同,则元素的化学性质相似,A和B最外层电子数相同,A的质子数为8,是氧元素,B的质子数为16,是硫元素,所以化学性质相似的元素是O、S。
16.(1)7K
(2)
(3)
【详解】(1)原子用元素符号表示,多个原子就是在元素符号前面加上相应的数字,故7个钾原子表示为:7K;
(2)离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故2个硫酸根离子表示为:;
(3)在原子中,质子数=原子序数=核外电子数,故铝原子核外第一层有2个电子,第二层有8个电子,第三层有3个电子,故铝的原子结构示意图为: 。
17.(1)6
(2)3Mg2+
(3)MgCl2
【详解】(1)对于原子而言,核电荷数=核外电子数,故16=2+8+x,解得x=6;
(2)离子的表示方法为:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其元素符号前加上相应的数字,故3个镁离子可表示为:3Mg2+;
(3)B是Mg2+,D是Cl-,两者可以组成氯化镁化合物,其化学式为MgCl2。
18. Al
【详解】地壳含量较多的元素前四种按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,元素符号为Al。
离子的表示方法:在表示该离子的元素符合右上角,标出该离子所带的正负电核数,数字在前,正负符号在后,带1个电荷时,1要省略;构成硫酸铜的微粒有铜离子和硫酸根离子,硫酸根离子的符号为。
19. 四 9:8 89
【详解】由题中信息知,α﹣丙氨酸中含有C,N,H,O四种元素,其中碳、氧2种元素质量比为12×3∶2×16=9:8,其相对分子质量是12×3+2×16+14+7=89.
点睛∶本题主要考查α﹣丙氨酸的组成,相对分子质量等知识。
20. 三 Si Al
【详解】三种元素的原子核外都有三个电子层,则三种元素位于元素周期表中的第三周期,故填三;
等质量的元素中,原子的数目与相对原子质量成反比,三种元素的相对原子质量的大小关系为镁<铝<硅,则质量的这三种元素中所含原子个数最少的是硅元素,其元素符号为Si,故填Si;
由图II可知,m=31 2 8 18=3,与铝原子的最外层电子数相同,所以三种元素中与图Ⅱ原子位于同一族的是铝元素,其元素符号为Al,故填Al。
21. 稀有气体元素 A
【详解】氦、氖、氩等气体属于稀有气体,氦-3元素属于稀有气体元素,氦-3原子中质子数为2,中子数为1,则原子核内有2个正电荷,氦原子结构示意图为A。
22. Na 7 金属
【详解】(1)元素周期表中每一小格的右上角是元素符号,钠的元素符号为Na;原子中,质子数=核外电子数,图B方框的横线上的数字是9-2=7;
(2)钠元素属于金属元素,根据偏旁可以判断出。
23. 58.69 16 四/4
【详解】元素周期表一格中最下方的数字就是元素原子的相对原子质量,由图可知,镍的相对原子质量为58.69,故填58.69;原子中,核内质子数等于核外电子数,所以x=28 2 8 16=2,故填2;电子层数等于周期数,由图可知,镍原子的核外有4个电子层,所以镍元素在元素周期表中处在第四周期,故填四或4。
24.(1) 7 79.90
(2) E CD/DC DE/ED Cl-
【详解】(1)根据在原子中,质子数=核外电子数,则有当35=2+8+18+x时,该原子属于非金属原子,解得x=7;
由元素周期表中的一格可知,汉字下方的数字表示的是该元素的相对原子质量,故溴元素的相对原子质量为79.90;
(2)最外层电子数相同的粒子具有相似的化学性质,Br粒子的最外层电子数为7,故与图1中的溴原子具有相似的化学性质的是E;
当质子数≠核外电子数时,表示的是离子,故其中属于离子的是CD;
元素是具有相同质子数(即核电荷数)的一类原子的总称,图示中DE质子数相同,属于同一种元素;
D中质子数为17,核外电子数为2+8+8=18,质子数<核外电子数,表示的是阴离子(氯离子),化学符号为Cl-。
25. 2 50.94 4/四
【详解】在原子中,质子数=核外电子数,故23=2+8+11+x,解得x=2;在元素周期表的每一个小方格中,元素名称下面的数字为相对原子质量,故钒的相对原子质量为50.94;在元素周期表中,元素所处的周期数等于其原子的电子层数,由钒原子的原子结构示意图可知,其原子核外有4个电子层,故钒元素在元素周期表中位于第四周期。
【点睛】在元素周期表中,元素所处的周期数等于其原子的电子层数。
26.(1)26.98
(2)三/3
(3)质子数不同/核电荷数不同
【详解】(1)在元素周期表中,元素名称下方的数字表示相对原子质量,根据图1中元素周期表可知:铝的相对原子质量为26.98;
(2)电子层数决定周期数,B质子数大于核外电子数,故是原子失去最外层电子后形成的,其原子核外有3个电子层,所对应的元素位于元素周期表的第三周期;
(3)元素是质子数相同的一类原子的总称,故铝元素和镁元素的本质区别是质子数不同。
27.(1) 8 17
(2) 小于 7
【详解】(1)氯原子的核电荷数为17,原子最外层有7个电子,易得到1个电子形成带有1个单位负电荷的阴离子,因此X的值是8;原子中原子序数等于质子数等于核电荷数,故氯元素的原子序数是17;故填:8;17;
(2)同一周期从左到右,原子序数逐渐增大,氯为17号元素,所以甲的原子序数为16,乙的原子序数为18,即甲的原子序数小于乙的原子序数;氯元素、氟元素属于同一主族元素,原子的最外层电子数相同,因此氟原子的最外层电子数为7;故填:小于;7。
28. 14 3/三 非金属
【详解】原子序数等于核内质子数,所以a=14;元素周期数等于原子核外电子层数,硅元素位于元素周期表中的第三周期;硅的偏旁是石字旁,属于固体非金属元素。
29.(1)15
(2)Mg2+
(3)O
【详解】(1)元素周期表同一族,原子的最外层电子数相同;元素周期表同一周期,原子的电子层数相同,下一个周期比上一个周期多一个电子层;氮原子结构示意图为:,处于元素周期表中的第二周期,磷原子与氮原子处在同一族,磷原子处在第三周期,因此磷原子结构示意图为:,X=2+8+5=15;
(2)A、9<2+8=10,核外电子数大于核内质子数,该粒子带负电,属于阴离子;
B、12>2+8=10,核内质子数大于核外电子数,该粒子带正电,属于阳离子,符号为Mg2+;
C、16=2+8+6=16,核内质子数等于核外电子数,属于原子;
(3)最外层电子数相同,化学性质相似,C粒子最外层电子数为6,图甲中氧的最外层电子数为6,故图甲中与C粒子化学性质相似的是O。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
